慢性萎缩性胃炎患者Runx3基因甲基化水平的研究
赵春娜 肖丽丽 王 倍 魏玥光
大庆油田总医院消化内科(163000)
慢性萎缩性胃炎患者Runx3基因甲基化水平的研究
赵春娜*肖丽丽王倍魏玥光
大庆油田总医院消化内科(163000)
背景:慢性萎缩性胃炎(CAG)是一种胃黏膜发生萎缩性改变的慢性胃炎,目前CAG外周血生物标记物的研究较少见。目的:探讨CAG患者外周血Runx3基因启动子区各CpG位点的甲基化水平。方法:选取2013年6月—2014年5月大庆油田总医院82例轻度CAG患者和73例中重度CAG患者,以45名胃黏膜正常者作为对照。采用MALDI-TOF-MS法测定Runx3基因启动子区各CpG位点的甲基化水平,荧光定量PCR法测定Runx3 mRNA表达,蛋白质印迹法测定Runx3蛋白表达。结果:与对照组和轻度CAG组相比,中重度CAG组Runx3基因启动子区CpG13、CpG14和CpG15位点的甲基化水平明显升高(P<0.05);Runx3 mRNA和蛋白表达明显降低(P<0.05)。而轻度CAG组Runx3基因各CpG位点的甲基化水平、Runx3 mRNA和蛋白表达与对照组无明显差异(P>0.05)。结论:CAG患者外周血Runx3基因启动子区CpG13、CpG14和CpG15位点的高甲基化可抑制Runx3表达,有望作为CAG临床分期的生物标记物。
胃炎, 萎缩性;Runx3;甲基化;生物学标记
Background: Chronic atrophic gastritis (CAG) is a kind of chronic gastritis with atrophic changes of gastric mucosa. The studies on peripheral blood biomarkers in CAG are rare. Aims: To investigate the methylation of peripheral blood CpG sites in Runx3 gene promoter region in CAG patients. Methods: Eighty-two mild CAG patients, 73 moderate to severe CAG patients from June 2013 to May 2014 at Daqing Oilfield General Hospital were enrolled, and 45 patients with normal gastric mucosa were served as controls. The methylation of CpG sites in Runx3 gene promoter region was measured by MALDI-TOF-MS. mRNA expression of Runx3 was determined by fluorescent quantitative PCR, and the protein expression of Runx3 was determined by Western blotting. Results: Compared with the control group and mild CAG group, methylation levels of CpG13, CpG14 and CpG15 sites in Runx3 gene promoter region were significantly increased in moderate to severe CAG group (P<0.05), the mRNA and protein expressions of Runx3 were significantly decreased (P<0.05). No significant differences in methylation of CpG sites in Runx3 gene promoter region and mRNA and protein expressions of Runx3 were found between mild CAG group and control group (P>0.05). Conclusions: The hypermethylation of peripheral blood CpG13, CpG14 and CpG15 sites in Runx3 gene promoter region can inhibit the expression of Runx3 in CAG patients, and can be used potentially as the biomarker for clinical staging of CAG.
慢性萎缩性胃炎(CAG)的发病机制目前尚不清楚,随着幽门螺杆菌(Hp)感染率的增高、环境污染加剧以及不健康的生活方式如高脂、高盐饮食、蔬菜水果摄入不足等问题的凸显,我国CAG的发病率呈上升趋势[1-2]。长期CAG改变可导致胃癌的发病率增高,CAG为公认的胃癌癌前病变,因此寻找CAG早期非侵袭性生物标记物可能有助于降低胃癌发病率[3-4],以达到早期预防和治疗的作用。
Runx3是一种重要的抑癌基因,其表达降低可通过影响机体多种蛋白如Smad的功能,导致肿瘤的发生。研究发现Runx3基因启动子区包含两个高度保守的CpG岛,可调控Runx3基因表达[5]。目前关于CAG患者Runx3基因甲基化水平的研究较少见,且缺乏甲基化CpG位点的分布位置的报道。本研究通过采用MALDI-TOF-MS法测定CAG患者外周血Runx3基因启动子区各个CpG位点的甲基化水平,旨在探讨其作为CAG生物标记物的可行性,从而为寻找CAG新的治疗靶点提供理论依据。
对象与方法
一、研究对象
收集2013年6月—2014年5月大庆油田总医院消化内科经胃镜检查确诊为CAG的患者155例。纳入标准:①年龄为20~60岁;②首次诊断为CAG。排除标准:①伴有肝肾疾病、糖尿病、心血管疾病、肿瘤、免疫系统疾病如过敏性鼻炎、皮炎或哮喘等疾病;②过去一年内长期服用(>3个月)维生素或微量元素补充剂、中药或其他免疫抑制剂等;③过去一年内曾暴露于医疗射线或铬汞补牙;④过去半年内烫染过头发或进行过家居装修;⑤过去半年内曾服用过治疗Hp的药物;⑥有胃癌、结肠癌等消化道肿瘤的家族史。选取同期45名胃镜检查黏膜正常者作为对照。本研究的设计方案由大庆油田总医院生物医学伦理委员会审查通过,所有纳入对象均签署知情同意书。
二、研究方法
1. 胃镜检查:纳入者均由同一位内镜医师行胃黏膜取材,根据病变部位选取五个方位的胃黏膜行活检。由两名病理科医师进行读片,如结果不一致,交由第三位经验更为丰富的病理科医师进行最终的判断。胃黏膜损伤程度分级:轻度:胃窦部浅层腺体呈局灶性萎缩、减少,而大小弯腺体正常;中度:胃窦部和小弯腺体均有萎缩、减少,且范围较轻度广泛;重度:胃窦部大部分萎缩、减少,仅残留少数原有腺体;大、小弯和弯腺体萎缩;或黏膜显著变薄,原有腺体完全萎缩、消失,以化生腺体代之。
2. 血样采集:采集受试者空腹外周静脉血10 mL,分装于两管。EDTA抗凝管6 mL,用于RNA、DNA和蛋白质的提取;抗凝管4 mL,分离血清,用于Hp感染情况的测定。
3. Runx3基因甲基化水平的测定:应用血液基因组DNA提取试剂盒(北京天根生化科技有限公司)提取DNA,并测定其浓度和质量。应用MALDI-TOF-MS法测定Runx3基因启动子区各CpG位点的甲基化水平。使用相关数据库(UCSC、Ensamble和NCBI)并结合文献资料,确定Runx3基因CpG岛的序列。采用Sequenom公司在线设计软件设计Runx3的引物序列,正向:5’-agg aag aga gGT TTT TGG GGA TGT AGG TTT GG-3’,反向:5’-cag taa tac gac tca cta tag gga gaa ggc tAA AAA ACA CTT CAT AAT AAA CCA CC-3’。按DNA甲基化试剂盒(Zymol公司)说明书对基因组DNA进行亚硫酸氢盐处理。PCR反应体系总体积为5 μL。反应条件:95 ℃ 4 min;95 ℃ 20 s,56 ℃ 30 s,72 ℃ 1 min,共45个循环;72 ℃ 3 min。每个PCR反应体系中加入0.3 μL虾碱性磷酸酶(SAP)和1.7 μL ddH2O混匀,SAP反应条件:37 ℃ 20 min;85 ℃ 5 min。碱基特异性酶切反应体系总体积为7 μL,37 ℃ 3 h。使用DNA质谱阵列基因分析系统(MassARRAYR)行质谱分析,测定Runx3基因启动子区各CpG位点的甲基化水平。
4. Runx3基因mRNA表达的测定:Trizol提取血液mRNA,测定RNA浓度和质量。逆转录合成cDNA(试剂购自南京诺唯赞生物科技有限公司)。利用美国Bio-Rad公司CFX-96荧光定量PCR仪行qRT-PCR(SYBR Premix Ex Taq试剂盒购自南京诺唯赞生物科技有限公司)。以β-actin为内参,对所有样品进行均一化处理,然后与对照组进行比较,以2-△△Ct法计算目的基因mRNA的表达量。
5. Runx3蛋白表达的测定:参照血液总蛋白提取试剂盒(南京诺唯赞生物科技有限公司)说明书抽提血液总蛋白,采用蛋白质印迹法测定Runx3蛋白表达。
三、统计学分析
结 果
一、一般情况
对照组、轻度CAG组和中重度CAG组患者性别、年龄、BMI、Hp感染率、吸烟和饮酒状况差异均无统计学意义(P>0.05)(表1),说明具有可比性。
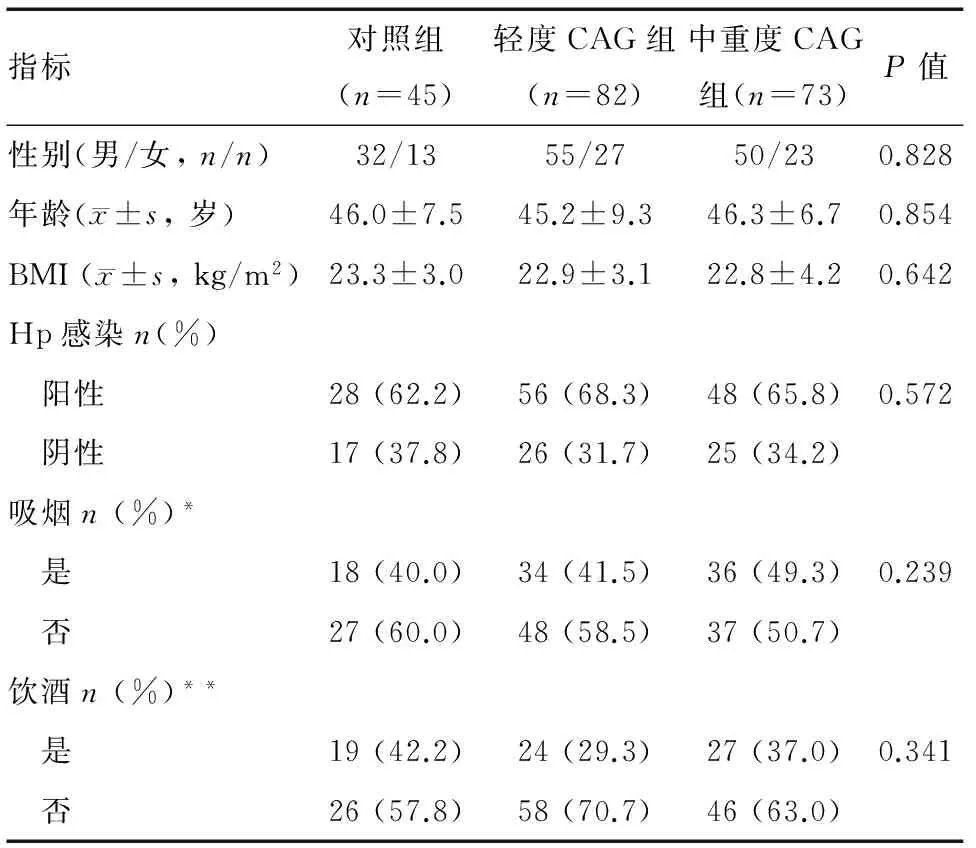
表1 三组研究对象的基本情况
*吸烟的定义:每天至少吸1支,且持续至少1年;亦包括戒烟不足1年者;**饮酒的定义:每周不少于3次,每次不少于2两白酒或1瓶啤酒
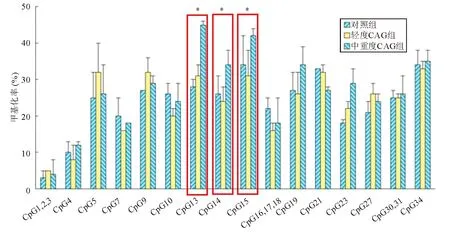
二、Runx3基因CpG位点的甲基化水平
与对照组和轻度CAG组相比,中重度CAG组中Runx3基因CpG13、CpG14和CpG15位点的甲基化水平明显升高(P<0.05),而轻度CAG组Runx3基因各CpG位点的甲基化水平与对照组相比差异无统计学意义(P>0.05)(图1)。
三、Runx3 mRNA和蛋白表达
与对照组和轻度CAG组相比,中重度CAG组Runx3 mRNA和蛋白表达明显降低(P<0.05),轻度CAG组Runx3 mRNA和蛋白表达与对照组相比差异无统计学意义(P>0.05)(图2、3)。

*与轻度CAG组和对照组比较,P<0.05

图3 各组Runx3蛋白表达(蛋白质印迹法)
讨 论
多数疾病的发生由环境因素和遗传因素共同调控[6-7]。CAG的发生、发展亦是基因-环境交互作用的结果,即环境污染和不健康饮食因素的暴露可通过多种不同途径影响相关基因的表达,进而导致CAG的发生。目前研究表明基因的表达受多种因素的调控,其中包括DNA甲基化水平和模式的改变。DNA甲基化是指在甲基转移酶作用下,以S-腺苷蛋氨酸(SAM)为甲基供体,将甲基转移至特定碱基的过程。其可通过影响染色质结构、DNA构象、DNA稳定性和DNA与蛋白质的相互作用,从而调控基因的表达,在多种疾病的发生和发展中起有至关重要的作用。
*与轻度CAG组和对照组比较,P<0.05
Runx3基因为Runx家族成员之一,位于人1号染色体短臂上。目前研究表明Runx3启动子区CpG岛的异常甲基化可引起mRNA和蛋白表达的降低或直接导致基因静默和表达缺失,进而导致多种疾病的发生,包括肝癌、胃癌等[8-9],且其甲基化水平可作为这些肿瘤发生、发展的生物标记物。近年有研究发现,Runx3是TGF-β信号转导通路中的转录因子,可通过加强Smad复合物与靶位点的结合并激活靶基因,起调控细胞生长发育、细胞周期、凋亡和恶性转化等作用[10]。研究发现Runx3基因内含2个高度保守的CpG岛,其甲基化水平可通过影响基因表达而导致TGF-β信号转导通路调节的紊乱,从而参与多种疾病的发生,特别是肿瘤,包括胃癌、肝癌、乳腺癌、膀胱癌等[11-14]。
CAG为胃癌的癌前病变,寻找其早期的生物标记物具有一定的临床意义。Zou等[15]的研究已证实胃癌患者存在Runx3基因的高甲基化改变,且Runx3基因启动子区甲基化水平与胃癌的发生、发展存在一定的正相关。本研究发现中重度CAG患者外周血Runx3基因启动子区CpG13、CpG14和CpG15位点的甲基化水平超过30%,且均显著高于胃黏膜正常者(P<0.05),与前期研究[15]中胃癌组织的变化趋势相一致。同时中重度CAG患者Runx3 mRNA和蛋白表达明显低于胃黏膜正常者(P<0.05),说明Runx3基因高甲基化可影响相应基因的表达,甚至引起蛋白表达的缺失,进而诱导胃黏膜的癌变。
综上所述,CAG患者外周血Runx3基因启动子区CpG13、CpG14和CpG15位点的高甲基化可抑制Runx3的表达,进而影响患者的临床症状,上述位点的甲基化有望作为CAG临床分期的生物标记物。
1 Sipponen P, Maaroos HI. Chronic gastritis[J]. Scand J Gastroenterol, 2015, 50 (6): 657-667.
2 Chen T, Sun L, He C, et al. Serum OPN expression for identification of gastric cancer and atrophic gastritis and its influencing factors[J]. PLoS One, 2014, 9 (12): e114005.
3 Tursi A, Grattagliano I, De Polo M, et al. Noninvasive prediction of chronic atrophic gastritis in autoimmune thyroid disease in primary care[J]. Scand J Gastroenterol, 2014, 49 (11): 1394-1396.
4 Watari J, Chen N, Amenta PS, et al.Helicobacterpyloriassociated chronic gastritis, clinical syndromes, precancerous lesions, and pathogenesis of gastric cancer development[J]. World J Gastroenterol, 2014, 20 (18): 5461-5473.
5 Berg M, Nordgaard O, Kørner H, et al. Molecular subtypes in stage Ⅱ-Ⅲ colon cancer defined by genomic instability: early recurrence-risk associated with a high copy-number variation and loss of RUNX3 and CDKN2A[J]. PLoS One, 2015, 10 (4): e0122391.
6 郑玉新. 暴露评估与暴露组研究—探索环境与健康的重要基础[J]. 中华预防医学杂志, 2013, 47 (2): 99-100.
7 Song H, Held M, Sandin S, et al. Increase in the prevalence of atrophic gastritis among adults age 35 to 44 years old in Northern Sweden between 1990 and 2009[J]. Clin Gastroenterol Hepatol, 2015, 13 (9): 1592-1600.e1.
8 Zhang X, He H, Zhang X, et al. RUNX3 promoter methylation is associated with hepatocellular carcinoma risk: A meta-analysis[J]. Cancer Invest, 2015, 33 (4): 121-125.
9 Lotem J, Levanon D, Negreanu V, et al. Runx3 at the interface of immunity, inflammation and cancer[J]. Biochim Biophys Acta, 2015, 1855 (2): 131-143.
10Bangsow C, Rubins N, Glusman G, et al. The RUNX3 gene -- sequence, structure and regulated expression[J]. Gene, 2001, 279 (2): 221-232.
11Zaidi SK, Sullivan AJ, van Wijnen AJ, et al. Integration of Runx and Smad regulatory signals at transcriptionally active subnuclear sites[J]. Proc Natl Acad Sci U S A, 2002, 99 (12): 8048-8053.
12Li QL, Ito K, Sakakura C, et al. Causal relationship between the loss of RUNX3 expression and gastric cancer[J]. Cell, 2002, 109 (1): 113-124.
13Barutcu AR, Hong D, Lajoie BR, et al. RUNX1 contributes to higher-order chromatin organization and gene regulation in breast cancer cells[J]. Biochim Biophys Acta, 2016, pii: S1874-9399(16)30170-5.[Epub ahead of print]
14Liu G, Xiang T, Wu QF, et al. Long noncoding RNA H19-derived miR-675 enhances proliferation and invasion via RUNX1 in gastric cancer cells[J]. Oncol Res, 2016, 23 (3): 99-107.
15Zou XP, Zhang B, Zhang XQ, et al. Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precan-cerous lesions[J]. Hum Pathol, 2009, 40 (11): 1534-1542.
(2015-10-08收稿;2015-10-28修回)
Investigation on Methylation of Runx3 Gene in Patients with Chronic Atrophic Gastritis
ZHAO Chunna, XIAO Lili, WANG Bei, WEI Yueguang.
Department of Gastroenterology, Daqing Oilfield General Hospital, Daqing, Heilongjiang Province (163000)
Gastritis, Atrophic;Runx3;Methylation;Biological Markers
10.3969/j.issn.1008-7125.2016.08.006
*Email: zjg122@sina.com

