趋化因子CCL20及其受体CCR6在肺腺癌组织中的表达及与复发转移的关系研究
张霄鹏,胡志娟,孟爱宏,贾晓梅,段国辰,王志康,赵庆涛
·论著·
趋化因子CCL20及其受体CCR6在肺腺癌组织中的表达及与复发转移的关系研究
张霄鹏,胡志娟,孟爱宏,贾晓梅,段国辰,王志康,赵庆涛
目的通过观察复发和非复发肺腺癌患者癌组织中CCL20和CCR6的表达情况,探讨CCL20和CCR6在肺腺癌发生发展中的作用。方法选取2009年2月—2011年12月河北省人民医院收治的肺腺癌患者162例,根据随访期间的复发转移情况分为复发组(n=50)和非复发组(n=112)。采用免疫组织化学染色检测CCL20和CCR6的表达;采用实时荧光定量PCR检测CCL20、CCR6 mRNA的表达,采用蛋白质印迹(Western blot)法检测CCL20、CCR6蛋白的表达。结果CCL20在肺腺癌组织中主要表达于细胞膜和细胞质,CCR6在肺腺癌组织中主要表达于细胞质,二者在肺腺癌癌旁组织中均无明显表达。复发组CCL20、CCR6高表达率〔CCL20:38(76.0%)比9(8.0%);CCR6:33(66.0%)比7(6.3%)〕和染色指数〔CCL20:(150.4±10.2)比(62.5±8.5);CCR6:(134.4±11.3)比(58.0±9.5)〕均高于非复发组,差异有统计学意义(P<0.05)。复发组CCL20、CCR6 mRNA表达较非复发组分别增加82.3%、56.4%,CCL20、CCR6蛋白表达较非复发组分别增加292.0%、188.0%,差异均有统计学意义(P<0.05)。结论CCL20和CCR6在肺腺癌组织中呈高表达,且与肺腺癌的发生发展相关。
肺肿瘤;趋化因子CCL20;受体,CCR6;复发;肿瘤转移
张霄鹏,胡志娟,孟爱宏,等.趋化因子CCL20及其受体CCR6在肺腺癌组织中的表达及与复发转移的关系研究[J].中国全科医学,2016,19(25):3065-3068,3073.[www.chinagp.net]
ZHANG X P,HU Z J,MENG A H,et al.Expression of chemokine CCL20 and its receptor CCR6 in lung adenocarcinoma and their relationship with recurrence or metastasis[J].Chinese General Practice,2016,19(25):3065-3068,3073.
肺癌是癌症相关死亡的首位原因[1]。趋化因子主要调节体内生理及病理情况下免疫细胞的转移,通过激活G蛋白偶联7次跨膜受体发挥作用[2]。不同的免疫细胞亚型表达特定的趋化因子受体,在靶器官中引导免疫细胞转移、滞留及发挥功能[3]。多种肿瘤细胞表达趋化因子和趋化因子受体[4]。通过激活趋化因子/趋化因子受体轴,诱导自分泌和旁分泌环的形成,促进肿瘤的生长、血管生成,破坏抗肿瘤的免疫反应[4-5]。例如,趋化因子CXCL12及其受体CXCR4对肿瘤的扩散、部位特异性转移以及患者存活起重要调节作用[4,6]。本研究通过观察肺腺癌组织趋化因子CCL20及其受体CCR6的表达和定位,进一步探讨CCL20及CCR6在非小细胞肺癌(NSCLC)发病中的作用以及与复发转移的关系。
1 对象与方法
1.1研究对象选取2009年2月—2011年12月河北省人民医院收治的肺腺癌患者162例。纳入标准:(1)根据国际抗癌联盟TNM分期系统进行术前及术后的组织病理分析[7],术前评估为TNMⅠ或Ⅱ期,术后病理证实为腺癌;(2)均采用胸腔镜肺癌根治术;(3)随访2年。排除标准:不愿合作者。根据随访期间的复发转移情况分为复发组(n=50)和非复发组(n=112)。本研究经河北省人民医院医学伦理委员会的批准,患者均签署知情同意书。
1.2研究方法
1.2.1手术方法及肺组织标本采集所有患者采用双腔气管插管和单肺通气,常规全身麻醉。采用胸腔镜肺癌根治术,根据病变的部位、性质和手术方式进行体位选择。通常采用侧卧位,分别在腋中线第7或第8肋间,腋前线第4或第5肋间,以及肩胛下线第8或第9肋间做切口以插入胸腔镜手术器械。标本袋收集病变样本,移出胸腔。操作器械退出胸膜腔后缝合切口,然后经一个原来的套管将胸腔引流管引出并固定于皮肤上,接水封瓶引流和进行肺的复张。部分病变肺组织以10%甲醛溶液固定;其余病变肺组织迅速放入液氮,并转移到-80 ℃冰箱保存。
1.2.2肺腺癌组织CCL20、CCR6免疫组织化学染色10%甲醛溶液固定,石蜡包埋的肺腺癌组织切片厚约4 μm。二甲苯脱蜡,梯度酒精水化,热修复140 ℃,2 min;3%过氧化氢去离子水孵育10 min,以阻断内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗2 min×3次;滴加鼠抗人CCL20单克隆抗体或鼠抗人CCR6单克隆抗体,4 ℃过夜,PBS冲洗2 min×3次;依次滴加聚合物辅助剂和辣根酶标记的兔抗IgG工作液,37 ℃孵育20 min,每步后均进行PBS冲洗,2 min×3次;二氨基联苯胺(DAB)显色,苏木精复染,常规脱水、透明、树胶封固镜检。PBS替代一抗作阴性对照。
1.2.3肺腺癌组织CCL20、CCR6免疫组织化学染色结果评价由2名有经验的病理医生采用双盲法评价组织切片CCL20和CCR6阳性肿瘤细胞比例和染色强度,评分均为0~3分,其中0~25%肿瘤细胞染色阳性为0分;26%~50%肿瘤细胞染色阳性为1分;51%~75%肿瘤细胞染色阳性为2分;76%~100%肿瘤细胞染色阳性为3分;趋化因子或其受体高表达的定义为50%以上的肿瘤细胞染色阳性;不着色,阴性为0分;淡黄色,弱阳性为1分;棕黄色,阳性为2分;棕褐色,强阳性为3分。每个标本计算染色指数:染色指数=染色强度×阳性肿瘤细胞比例/100%。
1.2.4肺腺癌组织CCL20、CCR6 mRNA表达的实时荧光定量PCR检测引物设计使用Primers软件,CCL20引物序列上游:5′-ATGTGCTGTACCAAGAGTTT-3′,下游:5′-CAAGTCTGTTTTGGATTTGC-3′;CCR6引物序列上游:5′-CCATTCTGGGCAGTGAGTCA-3′,下游:5′-AGCAGCATCCCGCAGTTAA-3′;甘油醛-3-磷酸脱氢酶(GAPDH)引物序列上游:5′-ATCCCATCACCATCTTCCAG-3′,下游:5′-GAGTCCTTCCACGATACCAA-3′。PCR热循环参数:95℃ 5 min,然后3步反应:95℃ 15 s,58℃ 30 s,72℃ 30 s,进行35个循环,于每个循环的第3步(即72℃ 30 s)收集荧光信号。扩增完毕后,进入结果分析界面,以GAPDH为内参照基因,与对照组相比,得到目的基因表达的相对定量值(RQ),将RQ用于统计分析。
1.2.5肺腺癌组织CCL20、CCR6蛋白表达的蛋白质印迹(Western blot)法检测提取肺腺癌组织总蛋白,测定总蛋白水平,上样蛋白总量为50 μg,以3%十二烷基硫酸钠(SDS)上样缓冲液定容于等体积,加入5×上样缓冲液,常温下聚丙烯酰胺凝胶(SDS-PAGE)电泳,4 ℃电转至聚偏二氟乙烯膜(PVDF)孵育相应一抗(1∶200)和二抗(1∶5 000),然后化学发光,X线曝光、显影、定影。用Quantity One软件分析Western blot图片,以目的蛋白与内参吸光度比值进行半定量分析。

2 结果
2.1两组CCL20、CCR6表达情况CCL20在肺腺癌组织中主要表达于细胞膜和细胞质,CCR6在肺腺癌组织主要表达于细胞质;二者在肺腺癌癌旁组织中均无明显表达(见图1)。复发组CCL20、CCR6阳性肿瘤细胞比例评分的总分分别为109、96分,非复发组分别为44、42分(见表1);复发组CCL20、CCR6染色强度评分的总分分别为138、140分;非复发组分别为142、138分(见表2)。

表1 两组CCL20、CCR6阳性肿瘤细胞比例评分分布情况〔n(分)〕
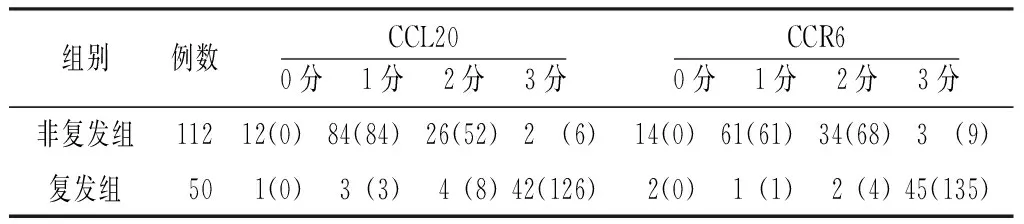
表2 两组CCL20、CCR6染色强度评分分布情况〔n(分)〕
2.2两组CCL20、CCR6高表达率和染色指数比较两组CCL20、CCR6高表达率和染色指数比较,差异均有统计学意义(P<0.05,见表3)。
2.3两组CCL20、CCR6 mRNA和蛋白表达比较复发组CCL20、CCR6 mRNA表达较非复发组分别增加82.3%、56.4%,CCL20、CCR6蛋白表达较非复发组分别增加292.0%、188.0%,差异均有统计学意义(P<0.05,见表4)。
3 讨论
近年来,肺癌已成为世界癌症相关死亡的首位原因。据估计,2010年,仅在美国,肺癌的新增病例为222 000人,死亡病例为157 000人[8]。腺癌常表现为周围型肺实质肿块。显微镜下可见到腺癌由新生的立方和柱状细胞构成,倾向于形成有纤维基质支持的腺样结构。细胞核可变大或不规则,含有明显的核仁,胞质中可见黏蛋白。腺癌倾向于气管外生长,但也可循肺泡壁蔓延,常在肺边缘部形成直径为2~4 cm的肿块。腺癌早期即可侵犯血管、淋巴管,常在原发癌引起症状前即已转移,易转移至肝、脑和骨,更易累及胸膜而引起胸腔积液[9]。

表3 两组CCL20、CCR6高表达率和染色指数比较
注:a为t值

表4 两组CCL20、CCR6 mRNA和蛋白表达比较

注:A为CCL20在肺腺癌组织中的表达情况;B为CCL20在癌旁组织中的表达情况;C为CCR6在肺腺癌组织中的表达情况;D为CCR6在癌旁组织中的表达情况
趋化因子组成趋化细胞因子家族,在生理状态及炎性状态下,趋化全身白细胞的迁移,参与血管的生成、胚胎的发育、自身免疫以及肿瘤的生长和转移[10]。BABA等[11]首先确定CCL20为GPR-CY4的高度选择性和功能性激动剂,然后按照趋化因子受体的命名法将此受体命名为CC趋化因子受体6或CCR6。经典钙动员和/或CCR6转染细胞系的迁移实验一致表明CCL20趋化因子的唯一受体是CCR6,且CCL20无法引发其他已知的趋化因子受体的生物应答[11]。趋化因子及其受体在多种细胞中表达,其中包括白细胞和肿瘤细胞[12]。一些癌细胞或肿瘤相关的白细胞产生的趋化因子是肿瘤细胞的生长因子。趋化因子也能通过吸引内皮细胞使血管再生或通过影响癌细胞的运动或迁移促进肿瘤的生长或转移。本研究结果显示,CCL20在肺腺癌组织中主要表达于细胞膜和细胞质,CCR6在肺腺癌组织中主要表达于细胞质,二者在肺腺癌癌旁组织中均无明显表达;复发组CCL20、CCR6高表达率和染色指数均明显高于非复发组;与非复发组相比,复发组肺腺癌组织中CCL20、CCR6 mRNA表达分别增加82.3%、56.4%,CCL20、CCR6蛋白表达分别增加292.0%、188.0%。
以往在其他恶性肿瘤的研究中,也发现了肿瘤细胞CCL20及CCR6表达增加。对人胰腺导管腺癌组织的诺瑟杂交分析显示,与正常胰腺组织相比,恶变组织中CCL20的转录明显上调[13]。原位杂交显示,导管样癌细胞和肿瘤相关巨噬细胞在体外均来源于CCL20 mRNA。而且胰腺肿瘤细胞系不仅表达了CCL20的转录,同时表达了其特异性受体CCR6的转录。反转录PCR(RT-PCR)分析和免疫组织化学染色发现,乳腺癌肿瘤细胞有CCL20 mRNA及蛋白的强烈表达[14]。RUBIE等[15]也研究了肝细胞癌中CCL19、CCL20、CCL21、CXCL12及其受体的表达,发现所有趋化因子在正常肝脏和肝细胞癌组织中均有表达,而CCL20是肝细胞癌组织中唯一表达明显上调的趋化因子。在肝细胞癌组织中唯一明显上调的趋化因子受体是CCR6。CHANG等[16]研究发现,鼻咽癌肿瘤细胞中CCL20过表达,与正常对照、完全缓解和长期无病患者比较,未治疗的、复发的和远处转移的鼻咽癌患者血清CCL20水平明显升高。在以有效的自分泌和旁分泌环为基础的前提下,结直肠癌肿瘤细胞以非极性的方式同时表达CCL20和CCR6,与正常结肠黏膜比较,结直肠癌黏膜CCR6表达上调,其相应的CCL20表达也上调[17]。KIRSHBERG等[18]研究了CCL20/CCR6/白介素17(IL-17)在NSCLC生长中的特异性作用,结果显示CCL20在77.5%的肿瘤患者中高表达,CCR6在16.5%的肿瘤患者中高表达,CCR6的高表达与短的无病存活相关,与疾病复发风险独立相关;CCL20刺激后癌细胞的克隆形成能力增加,这一效应部分依赖于ERK磷酸化和信号转导;在NSCLC患者中有IL-17表达,IL-17增加了癌细胞产生CCL20;CCL20/CCR6促进了NSCLC疾病的进展,CCR6被认为是潜在的新的预后标志物,CCL20/CCR6/IL-17轴是潜在的新的治疗靶点。
综上所述,肺腺癌组织中有CCL20和CCR6的高表达。复发和转移患者CCL20和CCR6表达比例更高,且CCL20、CCR6 mRNA和蛋白的表达明显增加。肺腺癌的发生发展可能与CCL20及CCR6高表达介导的肿瘤免疫反应有关。进一步研究其信号转导通路,可能为肺腺癌的治疗提供新的靶点。
作者贡献:张霄鹏负责全面工作;胡志娟负责论文撰写;孟爱宏负责筛选患者入组;贾晓梅负责资料收集;段国辰、王志康、赵庆涛负责完成手术临床操作。
本文无利益冲突。
[1]PARKIN D M,BRAY F,FERLAY J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]ZLOTNIK A,YOSHIE O.Chemokines:a new classification system and their role in immunity[J].Immunity,2000,12(2):121-127.
[3]MANTOVANI A,ALLAVENA P,SOZZANI S,et al.Chemokines in the recruitment and shaping of the leukocyte infiltrate of tumors[J].Semin Cancer Biol,2004,14(3):155-160.
[4]MANTOVANI A.Chemokines in neoplastic progression[J].Semin Cancer Biol,2004,14(3):147-148.
[5]BEIDER K,ABRAHAM M,BEGIN M,et al.Interaction between CXCR4 and CCL20 pathways regulates tumor growth[J].PLoS One,2009,4(4):e5125.DOI:10.1371/journal.pone.0005125.
[6]BURGER J A,KIPPS T J.CXCR4:a key receptor in the crosstalk between tumor cells and their microenvironment[J].Blood,2006,107(5):1761-1767.
[7]MOUNTAIN C F.Revisions in the international system for staging lung cancer[J].Chest,1997,111(6):1710-1717.
[8]JEMAL A,SIEGEL R,XU J,et al.Cancer statistics 2010[J].CA Cancer J Clin,2010,60(5):277-300.
[9]SAKASHITA S,SAKASHITA M,SOUND TSAO M.Genes and pathology of non-small cell lung carcinoma[J].Semin Oncol,2014,41(1):28-39.
[10]YOSHIE O,IMAI T,NOMIUYAMA H.Chemokines in immunity[J].Adv Immunol,2001,78:57-110.
[11]BABA M,IMAI T,NISHIMURA M,et al.Identification of CCR6,the specific receptor for a novel lymphocyte-directed CC chemokine LARC[J].J Biol Chem,1997,272(23):14893-14898.
[12]VICARI A P,CAUX C.Chemokines in cancer[J].Cytokine Growth Factor Rev,2002,13(2):143-154.
[13]KLEEFF J,KUSAMA T,ROSSI D L,et al.Detection and localization of Mip-3alpha/LARC/Exodus,a macrophage proinflammatory chemokine,and its CCR6 receptor in human pancreatic cancer[J].Int J Cancer,1999,81(4):650-657.
[14]BELL D,CHOMARAT P,BROYLES D,et al.In breast carcinoma tissue,immature dendritic cells reside within the tumor,whereas mature dendritic cells are located in peritumoral areas[J].J Exp Med,1999,190(10):1417-1426.
[15]RUBIE C,FRICK V O,WAGNER M,et al.Enhanced expression and clinical significance of CC-chemokine MIP-3 alpha in hepatocellular carcinoma[J].Scand J Immunol,2006,63(6):468-477.
[16]CHANG K P,HAO S P,CHANG J H,et al.Macrophage inflammatory protein-3alpha is a novel serum marker for nasopharyngeal carcinoma detection and prediction of treatment outcomes[J].Clin Cancer Res,2008,14(21):6979-6987.
[17]RUBIE C,OLIVEIRA V,KEMPF K,et al.Involvement of chemokine receptor CCR6 in colorectal cancer metastasis[J].Tumor Biol,2006,27(3):166-174.
[18]KIRSHBERG S,IZHAR U,AMIR G,et al.Involvement of CCR6/CCL20/IL-17 axis in NSCLC disease progression[J].PLoS One,2011,6(9):e24856.DOI:10.1371/journal.pone.0024856.
(本文编辑:崔沙沙)
Expression of Chemokine CCL20 and Its Receptor CCR6 in Lung Adenocarcinoma and Their Relationship with Recurrence or Metastasis
ZHANGXiao-peng,HUZhi-juan,MENGAi-hong,JIAXiao-mei,DUANGuo-chen,WANGZhi-kang,ZHAOQing-tao.DepartmentofThoracicSurgery,HebeiGeneralHospital,Shijiazhuang050051,China
Correspondingauthor:ZHANGXiao-peng,DepartmentofThoracicSurgery,HebeiGeneralHospital,Shijiazhuang050051,China;E-mail:13931115929@163.com
ObjectiveTo observe the expression status of CCL20 and CCR6 in cancer tissue of patients with recurrent and non-recurrent lung adenocarcinoma and explore the effects of CCL20 and CCR6 in the development of the disease.Methods162 lung adenocarcinoma patients who received treatment in Hebei General Hospital from February 2009 to December 2011 were selected.The patients were divided into recurrent group(n=50) and non-recurrent group(n=112) according to their recurrence and metastasis conditions.The expression,the mRNA expression and the protein expression of CCL20 and CCR6 were detected by immunohistochemistry staining,real-time PCR and Western-blot method respectively.ResultsCCL20 was mainly expressed in cell membrane and cytoplasm of lung adenocarcinoma tissue,while CCR6 expressed in cytoplasm of lung adenocarcinoma tissue.The two had no significant expression in para-carcinoma tissue of lung adenocarcinoma.The high-expression ratio and the staining index of CCL20 and CCR6 in recurrent group was significantly higher than those of the non-recurrent group(P<0.05).The high-expression ratio of CCL20 and of CCR6 between recurrent and non-recurrent group were 38(76.0%) to 9(8.0%) and 33(66.0%) to 7(6.3%) separately;and the staining index of CCL20 and CCR6 between the two groups were(150.4±10.2) to(62.5±8.5) and(134.4±11.3) to(58.0±9.5) respectively.Compared with non-recurrent group,the mRNA expression of CCL20 and CCR6 in recurrent group increased by 82.3% and 56.4% respectively,the protein expression of CCL20 and CCR6 increased by 292.0% and 188.0% respectively,showing significant differences(P<0.05).ConclusionPresenting high expression in lung adenocarcinoma tissue,CCL20 and CCR6 are related with the development of lung adenocarcinoma.
Lung neoplasms;Chemokine CCL20;Receptors,CCR6;Recurrence;Neoplasm metastasis
050051河北省石家庄市,河北省人民医院胸外科(张霄鹏,段国辰,王志康,赵庆涛),肾内科(胡志娟),门诊部(贾晓梅);河北医科大学第二医院呼吸内科(孟爱宏)
张霄鹏,050051河北省石家庄市,河北省人民医院胸外科;E-mail:13931115929@163.com
R 734.2
A
10.3969/j.issn.1007-9572.2016.25.013
2016-04-12;
2016-06-18)

