MAPK信号通路对地塞米松抑制Jurkat细胞增殖及诱导凋亡的影响
周焕娟,何 莉
MAPK信号通路对地塞米松抑制Jurkat细胞增殖及诱导凋亡的影响
周焕娟,何莉*
目的研究丝裂原活化蛋白激酶(MAPK)信号通路对地塞米松(Dexamethasone,DEX)诱导急性淋巴细胞白血病Jurkat细胞凋亡及抑制细胞增殖的影响。方法观察地塞米松、PD98059、SP600125、SB203580及地塞米松分别联合PD98059、SP600125、SB203580对Jurkat细胞增殖及凋亡的抑制作用。以急性淋巴细胞白血病Jurkat细胞为研究对象,应用WST-1法检测细胞的增殖活力;流式细胞术分析细胞凋亡。结果地塞米松对Jurkat细胞24 h和48 h抑制细胞增殖50%的药物浓度(IC50)分别为829、335 μM。100 μM以上地塞米松以时间、剂量依赖方式抑制Jurkat细胞增殖;地塞米松分别联合PD98059、SP600125可增加对Jurkat细胞增殖的抑制效应,联合SB203580对地塞米松抑制Jurkat细胞增殖无影响。10 μM地塞米松联合20 μM PD98059可显著增加地塞米松诱导Jurkat细胞凋亡的作用,细胞凋亡率由8.5%升至28.4%。结论急性淋巴细胞白血病Jurkat细胞为糖皮质激素耐药细胞。阻断p38MAPK对地塞米松抑制Jurkat细胞增殖无明显影响。阻断ERK、JNK信号通路均可增强地塞米松对Jurkat细胞的杀伤作用,达到逆转Jurkat细胞对地塞米松的耐药。急性淋巴细胞白血病Jurkat细胞糖皮质激素耐药可能与ERK、JNK通路的活化有关。
丝裂原活化蛋白激酶信号通路;地塞米松;耐药;凋亡;Jurkat细胞
0 引言
白血病是儿童恶性肿瘤中发病率最高的疾病,其中急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)约占70%[1],严重威胁儿童的健康成长。糖皮质激素(Glucocorticoid,GC)可引起淋巴细胞的凋亡及细胞周期G1停滞,抑制其生长与增殖,始终贯穿着整个化疗过程。国内外重要指南均将强的松单药治疗7 d诱导试验的效应作为评估儿童ALL预后的一个独立的危险因素[2]。然而,近年研究发现,在小儿初治ALL中,10%~20%表现为糖皮质激素原发耐药,复发病例中70%为GC耐药,严重威胁小儿ALL的疗效及预后。
丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)是细胞内广泛表达的丝氨酸/苏氨酸蛋白激酶,主要包括细胞外信号调节蛋白激酶(Extracellular signal-regulated kinase,ERK)、c-jun N末端激酶(c-jun N-terminal kinase,JNK)及p38MAPK途径,共同参与多种细胞反应的调节,如细胞增殖、分化、凋亡及细胞周期调控等。目前认为,细胞信号通路的异常激活或抑制与肿瘤耐药有密切关系[3]。ERK信号通路在CD4+T细胞对地塞米松(Dexamethasone,DEX)诱导细胞凋亡过程中发挥重要作用[4],活化JNK、p38MAPK信号通路引起的糖皮质激素受体功能受抑制与乳腺癌细胞糖皮质激素耐药相关[5]。目前,国内关于MAPK信号通路的异常激活或抑制是否会影响人ALL耐药细胞对糖皮质激素敏感性的相关研究较少。本研究采用糖皮质激素耐药Jurkat细胞,观察ERK、JNK及p38MAPK途径对DEX诱导Jurkat细胞凋亡的影响,寻找逆转ALL糖皮质激素耐药的方法。
1 材料与方法
1.1材料人急性T淋巴细胞白血病Jurkat细胞株,由中国医科大学中心实验室保存。RPMI 1640培养基购自美国Hyclone公司;胎牛血清购自天津灏天公司;WST-1购自碧云天公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自碧云天公司;地塞米松磷酸钠购自天津药业焦作有限公司;PD98059、SP600125及SB203580购自碧云天公司。
1.2方法
1.2.1细胞培养将Jurkat细胞株置于含10%胎牛血清的RPMI 1640培养液中,37 ℃、体积分数5% CO2、饱和湿度的培养箱内传代培养。台盼蓝染色,拒染率>95%为对数生长期细胞。取对数生长期细胞进行实验。
1.2.2实验分组单独应用DEX组、PD98059组、SP600125组、SB203580组和地塞米松分别联合PD98059、SP600125、SB203580组,并设立阴性对照及空白对照,每组设3个复孔,结果取平均值。
1.2.3WST-1法检测细胞增殖取对数生长期细胞,调整细胞密度为5×104/mL,将细胞悬液按每孔90 μL移至96孔板中,设立空白对照孔(无细胞孔)和阴性对照孔(未加药孔),每个样本设3个复孔;各试验孔加入10 μL相应梯度浓度药物,分别处理相应时间;每孔加入10 μL WST-1溶液,继续培养4 h后,在酶联免疫检测仪上以490 nm波长测定各孔吸光度(A)值。计算相应各孔的细胞抑制率。抑制率(%)=(对照组平均A值-实验组平均A值)/对照组平均A值×100%。抑制细胞增殖50%的药物浓度(IC50)采用回归法计算。
1.2.4Annexin V-FITC/PI双染法检测细胞凋亡取对数生长期细胞,予相应浓度和时间的药物处理后,1 000 r/min,离心5 min,弃上清,用PBS重悬细胞并计数,设阴性对照和空白对照(未加Annexin V-FITC)。取1×106个重悬细胞,1 000 r/min,离心5 min,弃上清,加入195 μL Annexin V-FITC 结合液重悬细胞;加入5 μL Annexin V-FITC并混匀。室温避光孵育10 min;1 000 r/min,离心5 min,弃上清,加入190 μL Annexin V-FITC 结合液重悬细胞;加入10 μL碘化丙啶染色液并混匀,冰浴避光放置10 min,进行流式细胞术检测。在双变量流式细胞仪的散点图上,X轴为Anexin V-FITC通道,Y轴为PI通道。左下象限(Anexin V-FITC-/PI-)代表活细胞,左上象限(Anexin V-FITC-/PI+)代表机械损伤细胞,右上象限(Anexin V-FITC+/PI+)代表坏死细胞,右下象限(Anexin V-FITC+/PI-)为凋亡细胞。
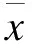
2 结果
2.1DEX、PD98059、SP600125、SB203580单用及联合应用对Jurkat细胞增殖的影响
2.1.1DEX对Jurkat细胞增殖的抑制作用1、10、100、500 μM DEX分别处理Jurkat细胞24、48 h。当DEX浓度达100 μM时,两组Jurkat细胞增殖抑制率比较差异有统计学意义,提示100 μM DEX作用48 h对Jurkat细胞有较明显的增殖抑制作用,表明Jurkat细胞为糖皮质激素耐药细胞。并且100 μM以上DEX对Jurkat细胞增殖抑制效应呈时间、剂量依赖性。见表1。DEX作用于Jurkat细胞24、48 h的IC50分别为 829、335 μM。
2.1.2PD98059、SP600125、SB203580对Jurkat细胞增殖的抑制作用20 μM PD98059、10 μM SP600125、20 μM SB203580分别处理Jurkat细胞48 h,对细胞的增殖抑制率分别为5.3%、6.5%和4.3%,与单用100 μM DEX组比较,三种阻滞剂对Jurkat细胞增殖无明显影响。见图1。

表1 DEX对Jurkat细胞的抑制增殖作用(%,n=3)
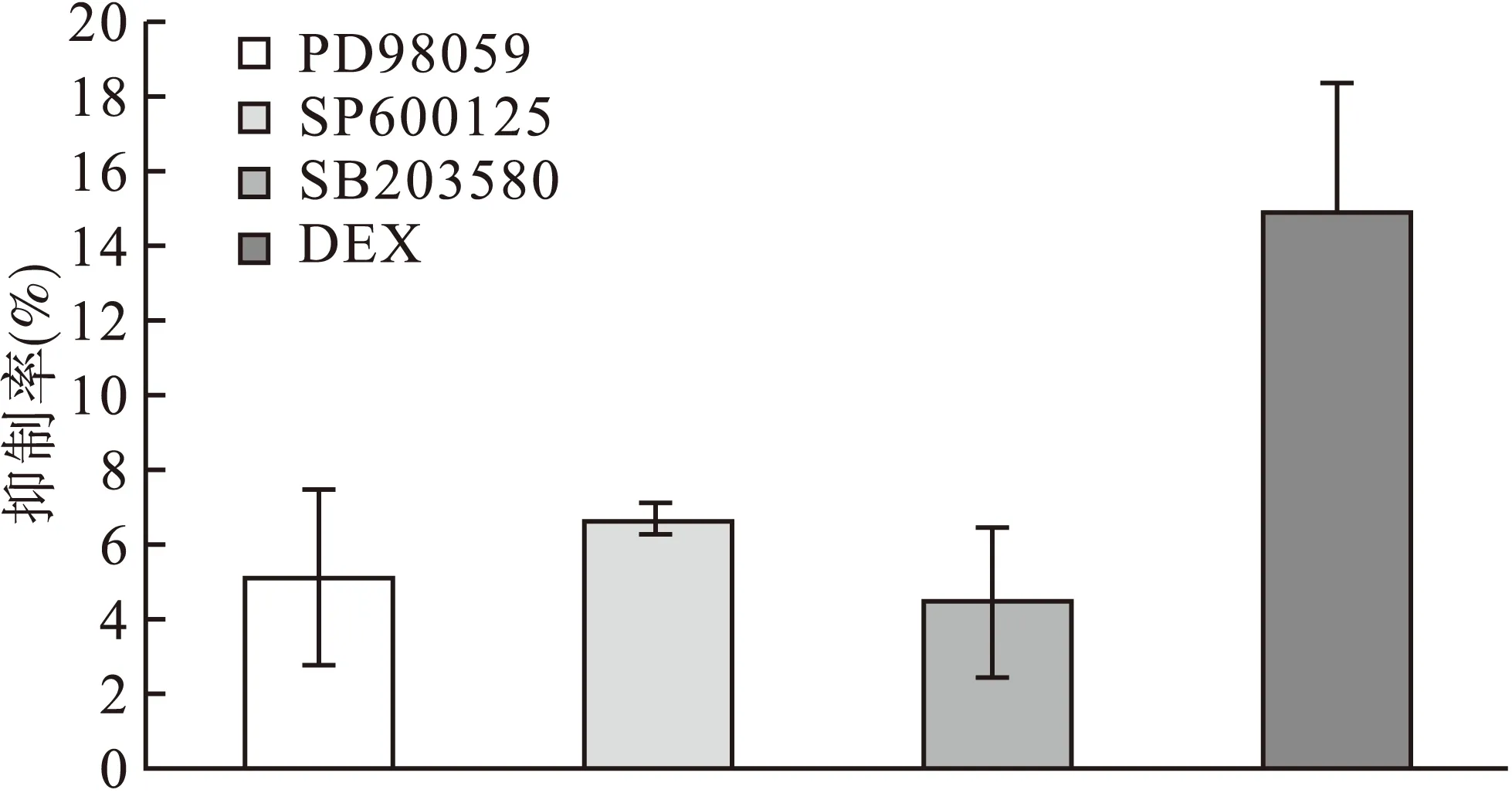
图1 PD98059、SP600125、SB203580、DEX对Jurkat细胞增殖的抑制作用
2.1.3DEX分别联合应用PD98059、SP600125、SB203580对Jurkat细胞增殖的抑制作用分别预先用20 μM PD98059、10 μM SP600125、20 μMSB203580处理Jurkat细胞1 h,然后加入1、10、100、500 μM DEX继续作用48 h。联合应用PD98059组可显著增加1、10、100 μM DEX对Jurkat细胞增殖的抑制作用。其抑制率分别由1.3%、5.6%、14.7%升至23.4%、24.7%、28.4% (t=22.19、12.68、3.80,P<0.05)。加用PD98059后,500 μM DEX 对Jurkat细胞增殖抑制率略升高,差异无统计学意义(t=2.50,P>0.05)。联合应用SP600125组可增加100、500 μM DEX对Jurkat细胞增殖的抑制作用,使其抑制率分别由14.7%、30.4%升至26.9%、39.1%,差异有统计学意义(t=3.84、3.24,P<0.05)。加用SP600125后,1、10 μM DEX 对Jurkat细胞的增殖抑制率无影响(t=2.02、1.95,P>0.05)。联合应用SB203580后,各浓度DEX对Jurkat细胞的增殖抑制作用无明显改变(t=0.69、0.87、2.53、1.25,P>0.05)。见图2。

图2 四组Jurkat细胞增殖抑制率比较(48 h)
2.2DEX、PD98059单独及联合应用对Jurkat细胞凋亡的影响
2.2.1DEX对Jurkat细胞凋亡的作用10 μM DEX作用Jurkat细胞48 h,细胞凋亡率为8.5%,提示Jurkat细胞对DEX诱导凋亡作用不敏感,为DEX耐药细胞株。见图3a。
2.2.2PD98059对Jurkat细胞凋亡的作用20 μM PD98059处理Jurkat细胞48 h,细胞凋亡率为7.4%,提示PD98059对Jurkat细胞无明显细胞毒作用。见图3b。
2.2.3DEX联合PD98059对Jurkat细胞凋亡的作用对照组、DEX组、PD98059组及DEX+PD98059组的凋亡率分别为5.8%±0.4%、8.5%±1.9%、7.4%±0.9%、28.4%±7.2%。结果表明,预先用20 μM PD98059处理Jurkat细胞1 h,然后加入 10 μM DEX继续作用48 h,细胞凋亡率由8.5%升至28.4%,差异有统计学意义 (t=4.62,P<0.05)。见图3c。提示PD98059可显著增强DEX的诱导凋亡作用,恢复Jurkat细胞对DEX的敏感性。见图4。

图3 三组Jurkat细胞凋亡情况比较(48 h)
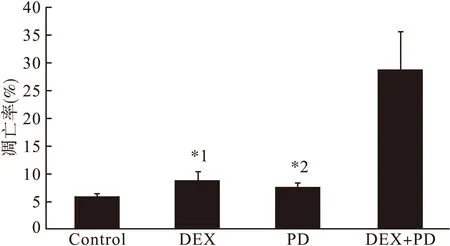
图4 DEX单用与联合PD98059对Jurkat细胞的凋亡作用
3 讨论
随着诊疗水平的提高和化疗方案的改进,小儿ALL的治愈率可达80%[6]。尽管近年多种新型化疗药物进入临床,糖皮质激素作为最早用于ALL化疗的药物,仍然贯穿于整个化疗过程。对糖皮质激素的敏感性已作为儿童ALL危险度判定、治疗方案选择和预后判断的一个重要的独立指标[7]。德国BFM研究表明,采用BFM90方案治疗的ALL糖皮质激素敏感患儿的5年无病生存率达80.7%,而糖皮质激素耐药者仅为31.8%[8]。由此可见,糖皮质激素耐药是小儿ALL治疗失败及复发的主要因素。本研究将DEX作用ALL Jurkat细胞24~48 h时,结果显示,100 μM DEX作用48 h才能出现明显的细胞增殖抑制作用。100 μM以上时,DEX以时间、剂量依赖方式抑制Jurkat细胞增殖,对DEX的耐药情况与孟浦等[9]报道一致。而对DEX敏感的细胞,Rambal等[10]报道,CCRF-CEM细胞在0.1 μM DEX处理48 h即可出现明显的细胞凋亡。说明Jurkat细胞为糖皮质激素耐药细胞株。
MAPK是细胞内重要的信号转导系统,主要包括ERK通路、JNK通路和p38MAPK通路,共同参与多种细胞反应的调节,如细胞增殖、分化、凋亡和细胞周期调控等。最近研究表明,这些通路的异常激活或阻断与肿瘤耐药产生有关[6]。Suzuki等[11]发现,联合应用ERK阻滞剂,可增加急性单核白血病THP-1及MV4-11细胞对伊马替尼的敏感性,说明抑制ERK信号通路,可以逆转急性单核白血病细胞对伊马替尼的耐药性。利用JNK阻滞剂SP600125处理卵巢癌顺铂敏感细胞株可增加对顺铂的耐药性,推测JNK信号通路的激活程度与卵巢癌细胞对顺铂的敏感性呈正相关[12]。阻断p38MAPK信号通路可增加小鼠白血病细胞L1210对长春新碱的敏感性,逆转长春新碱耐药[13]。
本研究以糖皮质激素耐药型Jurkat细胞株为研究对象,利用信号通路特异性阻滞剂联合DEX作用,探讨ERK、JNK及p38MAPK信号通路在糖皮质激素诱导淋巴细胞凋亡过程中的作用。结果显示,联合应用ERK通路阻滞剂PD98059,可增强DEX对Jurkat细胞增殖的抑制作用,其中以1、10 μM DEX对Jurkat细胞增殖抑制率的增加最显著,分别由1.3%、5.6%增加至22.4%、24.7%。流式细胞结果证实,预先用PD98059处理1 h后再加10 μM DEX继续作用48 h,可显著增加DEX对Jurkat细胞诱导凋亡作用,细胞凋亡率由8.5%升至28.4%。以同样剂量的PD98059单独处理Jurkat细胞,对细胞无影响。Rambal等[10]研究发现,T淋巴细胞白血病Molt-4细胞联合1 μM DEX和5 μM PD98059共同作用72 h,细胞凋亡率约为60%,比单用DEX升高6倍。由此可见,在多种糖皮质激素耐药型T-ALL细胞中,通过阻断ERK信号通路可恢复其对糖皮质激素的敏感性,使较低浓度DEX也可发挥明显的细胞增殖抑制和诱导细胞凋亡作用。因此,ERK信号通路的异常激活可能参与ALL糖皮质激素耐药的产生,阻断该通路可作为逆转糖皮质激素耐药治疗的新靶点。
JNK信号通路对于不同的细胞类型及刺激的产生,在调节细胞凋亡及存活过程发挥不同作用。Qu等[14]发现,联合As2O3和JNK特异性阻滞剂SP600125处理急性早幼粒白血病NB4细胞,可阻断As2O3诱导的细胞生长阻滞和细胞凋亡作用。本研究结果显示,联合SP600125与DEX处理Jurkat细胞48 h,可见加用SP600125可增加100、500 μM DEX对Jurkat细胞增殖的抑制作用,使其抑制率分别由14.7%、30.4%增加至26.9%、39.1%。而低浓度DEX (1、10 μM)对Jurkat细胞无增殖抑制作用。提示阻断JNK信号通路后,仍需较高浓度DEX才能出现明显的细胞毒作用。由此可见,阻断JNK信号通路可增加ALL Jurkat细胞对糖皮质激素的敏感性,ALL细胞糖皮质激素耐药的产生可能与JNK的异常激活有关,阻断该通路是一种潜在的逆转糖皮质激素耐药的治疗方法。
p38MAPK信号通路是细胞内抑制增殖途径。Miller等[15]研究表明,DEX作用于糖皮质激素敏感型CEM细胞24 h后,可观察到p38MAPK磷酸化水平升高,提示糖皮质激素介导p38MAPK活化,DEX诱导细胞凋亡过程需要p38MAPK参与,阻断p38MAPK信号通路可显著减弱糖皮质激素对淋巴细胞的杀伤作用[16-19]。本研究结果表明,联合DEX与p38MAPK通路阻滞剂SB203580 作用48 h,对DEX引起的Jurkat细胞增殖抑制效果无明显影响。其原因考虑为Jurkat细胞对糖皮质激素耐药,细胞内p38MAPK处于低表达水平,被阻断后对下游分子转录表达的作用不明显。推断p38MAPK信号通路受抑可能成为糖皮质激素耐药产生的机制。
总之,ALL Jurkat细胞为糖皮质激素耐药细胞。阻断p38MAPK对地塞米松抑制Jurkat增殖无明显影响;阻断ERK、JNK信号通路均可增强地塞米松对Jurkat细胞的杀伤作用,逆转Jurkat细胞对地塞米松诱导细胞凋亡耐药;阻断ERK信号通路可显著增加低浓度DEX对Jurkat细胞的诱导凋亡作用。由此推测,急性淋巴细胞白血病细胞糖皮质激素耐药与ERK、JNK信号通路的异常激活和p38MAPK通路阻断有关。特异性阻断ERK、JNK信号通路或激活p38MAPK信号通路可能成为逆转ALL糖皮质激素耐药的新的治疗方法。
[1]郑胡镛.儿童急性淋巴细胞白血病治疗进展[J].实用儿科临床杂志,2007,22(3):167-169.
[2]Hamilton A,Gallipoli P,Nicholson E,et al.Targeted therapy in haematological malignancies[J].J Pathol,2010,220(4):404-418.
[3]沈松杰.MAPK信号转导通路在肿瘤化疗耐药中的作用[J].国外医学:肿瘤学分册,2005,32(8):579-582.
[4]Tsitoura DC,Rothman PB.Enhancement of MEK/ERK signaling promotes glucocorticoid resistance in CD4+ Tcells[J].J Clin Invest,2004,113(4):619-627.
[5]Szatmary Z,Garabedian MJ,Vilcek J.Inhibition of glucocorticoid receptor-mediated transcriptional activation by p38 mitogen-activated protein (MAP) kinase[J].J Biol Chem,2004,279(42):43708-43715.
[6]Fulda S.Tumor resistance to apoptosis[J].Int J Cancer,2009,124(3):511-515.
[7]帖利军,顾龙君,宋得莲,等.儿童急性淋巴细胞白血病早期治疗反应的预后价值:上海儿童医学中心单中心的临床报告[J].中国当代儿科杂志,2009,11(1):5-9.
[8]Schrappe M,Reiter A,Zimmermann M,et al.Long-term results of four consecutive trials in childhood ALL performed by the ALL-BFM study group from 1981 to 1995.Berlin-Frankfurt-Munster[J].Leukemia,2000,14(12):2205-2222.
[9]孟浦,张慈伟,潘峰.Survivin 基因在糖皮质激素敏感型和糖皮质激素耐药型白血病细胞株中的表达差异及意义[J].实用儿科临床杂志,2010,25(15):1136-1139.
[10]Rambal AA,Panaguiton ZL,Kramer L,et al.MEK inhibitors potentiate dexamethasone lethality in acute lymphoblastic leukemia cells through the pro-apoptotic molecule BIM[J].Leukemia,2009,23(10):1744-1754.
[11]Suzuki M,Abe A,Imagama S,et al.BCR-ABL-independent and RAS / MAPK pathway-dependent form of imatinib resistance in Ph-positive acute lymphoblastic leukemia cell line with activation of EphB4[J].Eur J Haematol,2010,84(3):229-238.
[12]Cuadrado A,Garcia-Fernandez LF,Gonzalez L,et al.Aplidin induces apoptosis in human cancer cells via glutathione depletion and sustained activation of the growth factor receptor,Src,JNK,and p38MAPK[J].J Biol Chem,2003,278(1):241-250.
[13]Barancik M,Bohacova V,Kvackajova J,et al.SB203580,a specific inhibitor of p38-MAPK pathway,is a new reversal agent of P-glycoprotein-mediated multidrug resistance[J].Eur J Pharm Sci,2001,14(1):29-36.
[14]Qu W,Bortner CD,Sakurai T,et al.Acquisition of apoptotic resistance in arsenic-induced malignant transformation:role of the JNK signal transduction pathway[J].Carcinogenesis,2002,23(1):151-159.
[15]Miller AL,Komak S,Webb MS,et al.Gene expression profiling of leukemic cells and primary thymocytes predicts a signature for apoptotic sensitivity to glucocorticoids[J].Cancer Cell Int,2007,7:18-33.
[16]张莹,周晋,李殿俊,等.JNK传导通路在砷制剂治疗白血病中的作用[J].中国肿瘤,2004,13(4):264-266.
[17]何莉,李丹,侯科佐,等.p38丝裂原活化蛋白激酶调节急性淋巴细胞性白血病CEM细胞株糖皮质激素受体功能的分子机制研究[J].中华儿科杂志,2007,45(9):687-691.
[18]Zhao YN,Guo X,Ma ZG,et al.Pro-apoptotic protein BIM in apoptosis of glucocorticoid-sensitive and -resistant acute lymphoblastic leukemia CEM cells[J].Med Oncol,2011,28(4):1609-1617.
[19]Heidari N,Miller AV,Hicks MA,et al.Glucocorticoid-mediated BIM induction and apoptosis are regulated by Runx2 and c-Jun in leukemia cells[J].Cell Death Dis,2012,19(3):e349.
Effect of MAPK signal pathway on proliferation and apoptosis inhibited and induced by dexamethasone in Jurkat cells
ZHOU Huan-juan,HE Li*
(Department of Pediatrics,the First Affiliated Hospital of China Medical University,Shenyang 110001,China)
ObjectiveTo study the effect of mitogen-activated protein kinase (MAPK) signal pathway on the inhibition of proliferation and apoptosis induced by dexamethasone in glucocorticoid-resistance Jurkat cell line.MethodsThe inhibition of proliferation and apoptosis of Jurkat cell,after being treated respectively with dexamethasone,PD98059,SP600125,SB203580 and dexamethasone combined with PD98059,SP600125 and SB203580,was observed.The proliferation and apoptosis was detected by WST-1 assay and flow cytometry respectively using Jurkat cell as the subjects.ResultsThe 24 h and 48 h IC50of dexamethasone to Jurkat cell was 829 μM and 335 μM.Dexamethasone inhibited the proliferation of Jurkat cell in a dose-/time- dependent manner when the concentration was more than 100 μM.Dexamethasone combined with PD98059 and SP600125 could enhance the inhibition effect of dexamethasone,but no significant inhibition effect was observed when it was combined with SB203580.Dexamethasone 10 μM combined with PD98059 20 μM could significantly promote the apoptosis induced by dexamethasone in Jurkat cell.The apoptosis rate rose from 8.5% to 28.4%.ConclusionAcute lymphoblastic leukemia Jurkat cell is resistant to glucocorticoid.Inhibiting p38MAPK has no obvious influence on the proliferation of Jurkat cell,while inhibiting ERK or JNK signal pathway can enhance the effect of dexamethasone on Jurkat cell,thus reversing the resistance of Jurkat to dexamethasone.The activation of ERK and JNK signal pathway plays an important role in glucocorticoid resistance of acute lymphoblastic leukemia.
Mitogen-activated protein kinase signal pathway;Dexamethasone;Resistance;Apoptosis;Jurkat cell
2016-04-27
中国医科大学附属第一医院儿科,沈阳 110001
辽宁省高等学校科研项目计划(2008821);2.辽宁省博士启动基金资助项目(20081050)
10.14053/j.cnki.ppcr.201608004

