一株基因克隆干扰菌的鉴定及其发酵液降解DNA活性分析
刁文涛王雪妍陈晓飞冯菲宁萌周伏忠
(1. 河南省科学院生物研究所有限责任公司,郑州 450008;2. 河南省微生物工程重点实验室,郑州 450008)
一株基因克隆干扰菌的鉴定及其发酵液降解DNA活性分析
刁文涛1,2王雪妍2陈晓飞1冯菲1宁萌2周伏忠1,2
(1. 河南省科学院生物研究所有限责任公司,郑州 450008;2. 河南省微生物工程重点实验室,郑州 450008)
旨在寻找导致基因克隆失败的原因,检测整个电泳环境中是否存在对DNA有强降解力的菌株。依据菌体形态,革兰氏反应以及16S rDNA序列对DNA降解菌株进行鉴定,琼脂糖凝胶电泳分析菌株对DNA的降解活性。结果显示,从DNA电泳槽中分离到了一株菌,革兰氏染色鉴定为阴性菌,对该菌进行液体培养,利用质粒pUC19作为底物,检测该菌发酵液对DNA的降解能力,发现该菌发酵液能够迅速并彻底地降解DNA,其最佳降解温度为45℃,将该菌命名为DD(DNA degrading)。对该菌的16S rDNA进行测序比对后,发现其与粘质沙雷氏菌(Serrtia marcescens)的16S rDNA序列同源性高达100% 。结合菌体形态,革兰氏反应以及16S rDNA序列结果,DD菌株为一株粘质沙雷氏菌,DNA降解活性分析显示其具有很强的DNA降解能力。
DNA降解;pUC19;粘质沙雷氏菌
现代生命科学的许多领域都会用到分子克隆技术来构建重组载体,在分子克隆的过程中,一般会利用限制性内切酶对目的基因片段进行酶切,回收酶切后的目的基因片段连接到指定的载体中,回收目的基因时一般会用到琼脂糖凝胶回收的方法对目的基因片段进行纯化[1]。而本实验室利用琼脂糖凝胶回收的方法回收酶切后目的基因片段,再连接到特定的载体中时,屡屡失败,转化平板上无克隆长出,而利用酚氯仿异戊醇抽提沉淀的方法代替琼脂糖凝胶回收来回收酶切后目的基因片段[1],然后再连接转化就可获得很多阳性克隆,说明在利用琼脂糖凝胶法回收目的基因时,目的基因遭到了破坏,一种可能就是在电泳缓冲液中存在DNA水解酶,在DNA电泳的过程中就对DNA进行了部分水解。
电泳槽中的DNA水解酶极有可能来自于槽中的微生物,于是我们取电泳槽内的电泳液进行涂板培养,分离到的粘质沙雷氏菌就是一种能够分泌DNA水解酶的细菌[2]。粘质沙雷氏菌又称灵杆菌,能够分泌灵菌红素而呈红色[3-6],属革兰氏阴性菌,分布广泛,在土壤、水体和植物中都有分布,对人类、昆虫和真菌都可致病[7-12]。为了适应多种多样的环境,有效利用环境中的营养,粘质沙雷氏菌可以分泌多种酶[2,8,10-16],而DNA水解酶就是其中的一种,其水解核酸时对核酸的长度和序列无特异性要求,而且对DNA和RNA都有同样的水解效果[17,18]。
本研究利用质粒pUC19作为底物检测筛选到的菌株DD的DNA降解能力,旨在检测DNA电泳系统中该菌株的污染是否为导致分子克隆失败的原因。
1 材料与方法
1.1材料
1.1.1质粒 pUC19(天根生化科技有限公司)。
1.1.2主要试剂 DNA胶回收试剂盒(天根生化科技有限公司)、细菌基因组提取试剂盒(OMEGA)、革兰氏染色试剂盒(北京路桥技术有限责任公司)、Tris、乙酸、EDTA等。
1.1.3培养基 YPD固体及液体培养基。
1.2方法
1.2.1菌株分离 取200 μL DNA电泳槽中的TAE电泳缓冲液均匀涂布在YPD固体平板上,25℃倒置培养2 d,挑取单克隆并在新鲜的YPD平板上划线,重复3次,挑取单克隆进行保存,并进行后续实验。
1.2.2DNA降解 在0.3 μg质粒pUC19(10 μL)的水溶液中加入1 μL DD(DNA degradation)菌的培养16 h的发酵液,在一定条件下反应一段时间后,通过加热终止反应,然后用1%的琼脂糖凝胶进行电泳,经EB(溴化乙腚)染色后,在紫外光下观察DNA降解情况。
1.2.3菌株鉴定 利用细菌基因组提取试剂盒提取了DD菌的基因组DNA,以其为模板,通过PCR(引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGYTACCTTGTTACGACTT-3'。PCR程序:95℃ 5 min;95℃ 30 s,52℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min),获得该菌的16S rDNA,然后对其序列进行测定,在NCBI数据库中进行序列比对,并对培养2 d的DD菌的菌落形态进行简单观察。
2 结果
2.1菌株分离
从DNA电泳槽中取200 μL TAE电泳缓冲液均匀涂布在YPD固体平板上,25℃培养箱中倒置培养2 d,长出了许多相似的菌落,挑取单个菌落在新鲜的YPD平板上划线,重复3次,得到了如图1-A所示的菌落,菌落为红色,突起,中心不透明,边缘不规则,在37℃培养箱中培养该菌,菌落形态如图1-B所示,菌落为白色,革兰氏染色的结果如图1-C所示,表明该菌为革兰氏阴性菌。
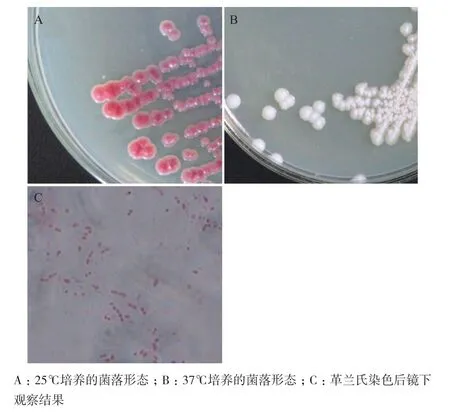
图1 DD菌的菌落形态与革兰氏染色结果
2.2发酵液对DNA降解能力的检测
挑取单一菌落接种到2 mL YPD培养基中,28℃,180 r/min培养16 h后,14 000 r/min离心10 min后收集上清液,经0.2 μm滤膜过滤。在10 μL质粒pUC19水溶液中加入1 μL发酵液,25℃反应2 h,以新鲜的YPD培养基作为对照,反应结束后,用1%琼脂糖凝胶进行电泳检测。结果(图2)显示,经发酵液处理的pUC19被彻底降解,说明DD菌的发酵液对DNA具有明显的降解活性。按照上述方法25℃反应不同时间,并在70℃处理10 min终止反应,电泳结果如图3所示。可见,DD菌的发酵液能够迅速的降解DNA,具有很强的降解能力。

图2 琼脂糖凝胶电泳分析DD发酵液的DNA降解活性

图3 琼脂糖凝胶电泳分析DD发酵液处理DNA不同时间的结果
2.3发酵液的DNA水解活性失活温度检测
为了检测发酵液的最高耐受温度,在不同温度下对发酵液进行10 min预处理,然后再加入到质粒pUC19的溶液中进行反应,25℃反应30 min后琼脂糖凝胶电泳检测。结果(图4)显示,DD发酵液降解DNA的能力在50℃时开始受到不可逆的破坏,55℃处理10 min基本可以完全破坏其DNA降解能力。
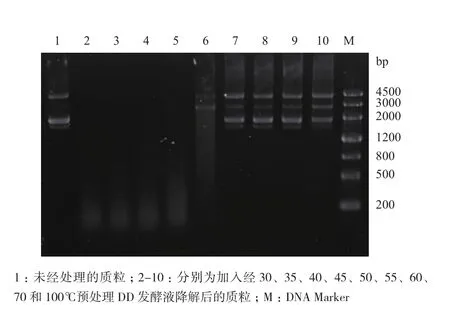
图4 琼脂糖凝胶电泳分析经不同温度处理的发酵液的DNA降解活性
2.4发酵液最佳降解温度检测
为了检测DD菌的发酵液降解DNA的最适温度,在不同的温度条件下进行了降解反应,为了降低反应速度以便观察,对发酵液进行了2倍稀释,在10 μL 质粒pUC19水溶液中加入1 μL稀释后的发酵液,在不同的温度条件下反应5 min,然后70℃处理10 min终止反应。电泳结果(图5)显示,DD发酵液降解DNA的最适反应温度在45℃附近。
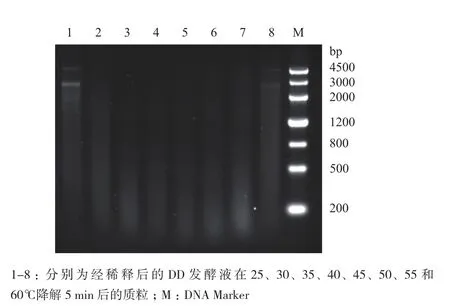
图5 琼脂糖凝胶电泳分析经不同温度下发酵液的DNA降解活性
2.5菌株鉴定
用引物27F/1492R对DD菌的基因组进行扩增得到了其16S rDNA片段,测序后在NCBI数据库中进行比对,发现该序列与粘质沙雷氏菌的16S rDNA序列的匹配度达到100%。图1中DD菌的菌落形态与革兰氏染色结果也作为菌种鉴定的依据。
3 讨论
在寻找分子克隆实验的失败原因的过程中,我们从电泳槽中分离到了一株具有很强的DNA降解能力的细菌,其与粘质沙雷氏菌的16S rDNA序列匹配度达到100%,其菌落形态与革兰氏染色结果也符合粘质沙雷氏菌的特征,粘质沙雷氏菌在28℃左右因合成灵菌红素而呈红色,而温度升高到37℃时因灵菌红素合成途径关闭而呈白色[19],这与该菌菌落颜色随温度而变化的特点也一致,其胞外物质具有降解DNA的能力也与文献[2]报道相符,综合这些结果可以确定该菌为一株粘质沙雷氏菌。本研究检测了该菌株分泌的核酸酶对质粒pUC19的降解能力,其分泌物在室温条件下能够快速的降解DNA,这可能就是导致利用琼脂糖凝胶回收的DNA片段进行连接时总是失败的原因。在本实验室中,琼脂糖凝胶电泳回收DNA后,对回收的DNA进行再次电泳检测时,虽然能够看到清晰的大小正确的目的基因片段,但是连接仍然失败,而利用酚氯仿异戊醇抽提沉淀的方法代替琼脂糖凝胶回收来回收酶切后目的基因片段时,就可成功地将目的基因连接到载体中,说明导致回收DNA片段连接失败的原因可能是DNA在电泳时,其末端被水解掉了很少几个核苷酸残基,也说明DNA对该菌分泌的核酸酶极为敏感,与本研究中检测到的该菌发酵液对DNA的强大的降解能力相符,少量的污染即能够短时间内导致DNA的部分水解而影响分子克隆实验。所以进行分子克隆的实验环境中应尽量避免接触粘质沙雷氏菌,一经污染,便会严重影响分子克隆实验的进程。
虽然本研究检测到粘质沙雷氏菌可能会是导致基因克隆失败的原因,但是其分泌的核酸酶作为唯一一种能降解所有形式核酸的水解酶,在蛋白质纯化等需要除去核酸的工艺中还是有着显著的应用价值[18,20,21]。
4 结论
结合菌体形态,革兰氏反应以及16S rDNA序列结果,推断DD菌株为一株粘质沙雷氏菌,其胞外分泌物在50℃以下具有很强的DNA降解能力,最适降解温度在45℃左右。
[1]萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 第3版.黄培堂, 译. 北京:科学出版社, 2008.
[2]Eaves GN, Jeffries CD. Isolation and properties of an exocellular nuclease of Serratia Marcescens[J]. J Bacteriol, 1963, 85(2):273-278.
[3]黄小龙, 黄东益, 周双清, 等. 粘质沙雷氏菌产灵菌红素培养基的筛选[J]. 生物技术, 2009, 5:65-67.
[4]韦凤. 产灵菌红素粘质沙雷氏菌发酵条件优化及色素性质的研究[D]. 金华:浙江师范大学, 2012.
[5]周围. 粘质沙雷氏菌次生代谢产物灵菌红素的生理与生物学活性的研究[D]. 重庆:西南大学, 2014
[6]张丹峰, 杨培周, 姜绍通. 一株分离自鳜鱼肠道的粘质沙雷氏菌(Serratia marcescens)HFUT 1301的鉴定及灵菌红素的分析[J]. 现代食品科技, 2015, 6:78-83, 204.
[7]Wilfert JN, Barrat FF, Ewing WH, et al. Serratia marcescens:biochemical, serological, and epidemiological characteristics and antibiotic susceptibility of strains isolated at Boston City Hospital[J]. Appl Microbiol, 1970, 19(2):345-352.
[8]Wilkowske CJ, Washington JA 2nd, Martin WJ, et al. Serratia marcescens. Biochemical characteristics, antibiotic susceptibility patterns, and clinical significance[J]. JAMA, 1970, 214(12):2157-2162.
[9]Grimont PA, Grimont F. The genus Serratia[J]. Annu Rev Microbiol, 1978, 32:221-248.
[10]Sokalski SJ, Jewell MA, Asmus-Shillington AC, et al. An outbreak of Serratia marcescens in 14 adult cardiac surgical patients associated with 12-lead electrocardiogram bulbs[J]. Arch Intern Med, 1992, 152(4):841-844.
[11]Suh Y, Alpaugh M, Krause KL, et al. Differential secretion of isoforms of Serratia marcescens extracellular nuclease[J]. Appl Environ Microbiol, 1995, 61(11):4083-4088.
[12]Matsuo H, Kosaka K, Iwata K, et al. Necrotizing soft tissue infection caused by Serratia marcescens in a patient treated with tocilizumab[J]. Kansenshogaku Zasshi, 2015, 89(1):53-55.
[13]Bromke BJ, Hammel JM. Regulation of extracellular protease formation by Serratia marcescens[J]. Can J Microbiol, 1979, 25 (1):47-52.
[14]Lyerly DM, Kreger AS. Importance of serratia protease in the pathogenesis of experimental Serratia marcescens pneumonia[J]. Infect Immun, 1983, 40(1):113-119.
[15]魏巍, 贺淹才, 方柏山, 等. 粘质沙雷氏菌几丁质酶(ChiC)基因克隆及其生物信息学分析[J]. 江西农业大学学报,2006, 3:444-448.
[16]朱绮霞, 陈英, 张搏, 黄日波. 粘质沙雷氏菌脂肪酶基因的克隆表达和酶学性质的研究[J]. 生物技术, 2010, 5:12-16.
[17]Filimonova MN, Krause KL, Benedik MJ. Kinetic studies of the Serratia marcescens extracellular nuclease isoforms[J]. Biochem Mol Biol Int, 1994, 33(6):1229-1236.
[18]杨海艳. 灵杆菌非特异性核酸酶的原核表达、纯化及活性分析[D]. 杨凌:西北农林科技大学, 2011.
[19]徐虹, 徐美娟, 杨套伟, 等. 温度对粘质沙雷氏菌合成灵菌红素的影响[J]. 微生物学报, 2014, 5:517-524.
[20]蔡俊杰. 粘质沙雷氏菌胞外核酸酶重组表达纯化及鉴定[D].上海:上海交通大学, 2011.
[21] 邓丹丹. 灵杆菌非特异性核酸酶的固定化及酶学特性研究[D]. 杨凌:西北农林科技大学, 2013.
(责任编辑 狄艳红)
Isolation and Identification of a Bacterium Disturbing Molecular Cloning,and Analysis of DNA-Degrading Activity of Its Fermentation Broth
DIAO Wen-tao1,2WANG Xue-yan2CHEN Xiao-fei1FENG Fei1NING Meng2ZHOU Fu-zhong1,2
(1. Institute of Biology Co.,Ltd.,Henan Academy of Sciences,Zhengzhou 450008;2. Key Laboratory of Microbial Engineering of Henan Province,Zhengzhou 450008)
This work aims to analyze the reason that resulted in the failure of cloning and to check if there are some microorganisms strongly degrading DNA in the environment of electrophoresis chamber. The colony morphology,gram staining and the 16S rDNA sequence were utilized to identify the strain degrading DNA,and agarose gel electrophoresis was for analyzing the DNA-degrading activity. As results,a strain was isolated from DNA electrophoresis chamber,and identified as gram-negative bacterium. Then it was cultured in YPD medium,and the capacity of the fermentation broth degrading DNA was detected using plasmid pUC19 as substrate. The strain quickly and sufficiently degraded DNA at the optimal temperature 45℃,thus this strain was designated DD(DNA degrading). The sequence alignment of the DD by the 16S rDNA showed that this DD had 100% identity with the that of Serrtia marcescens. Conclusively,the bacterial strain DD isolated from DNA electrophoresis chamber is a Serrtia marcescens strain possessing significant DNA-degrading activity based on the results of colony morphology,gram staining,and 16S rDNA sequence.
DNA degradation;pUC19;Serratia marcescens
10.13560/j.cnki.biotech.bull.1985.2016.08.032
2015-12-08
河南省省级重点实验室专项(122300413214),河南省重点攻关计划项目(142102210087,152102210167)
刁文涛,男,博士,研究方向:微生物资源和分子遗传;E-mail:diao_wen_tao@163.com
周伏忠,男,硕士,研究方向:微生物资源研究与产品研发;E-mail:zdsyszfz001@163.com

