利用酵母双杂交系统筛选雷竹SOC1相互作用蛋白
潘现飞 施泉 林新春 徐英武 曹友志
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,临安 311300)
利用酵母双杂交系统筛选雷竹SOC1相互作用蛋白
潘现飞 施泉 林新春 徐英武 曹友志
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,临安 311300)
在雷竹(Phyllostachys violascens)中找到SUPPRESSOR OF OVEREXPRESSION OF CONSTANSl(SOCl)在开花途径中的作用靶标,进一步探索SOCl的作用机制。构建pGBKT7-PvSOC1诱饵表达载体,通过SMART技术构建开花时期的雷竹cDNA文库,酵母双杂交筛选与SOC1互作的蛋白,并对其进行分析鉴定。结果显示,成功构建了可用于酵母双杂交的cDNA文库,文库的转化率为每微克pGADT7-Rec 3.0×106转化子,文库滴度为7.5×106cfu/mL,插入片段主要在250-2 000 bp之间。通过酵母双杂交实验得到与诱饵蛋白PvSOC1相互作用的蛋白,筛选到的靶标蛋白经鉴定是一个富含亮氨酸的蛋白激酶,特征氨基酸序列在不同物种中非常保守,与水稻中的同源蛋白亲缘性最高。
雷竹;SOC1;cDNA文库;酵母双杂交;蛋白质互作
开花是高等植物由营养生长向生殖生长转变的重要标志[1],MADS-box基因家族编码一类转录因子,在调控植物开花时间和花形态形成中发挥重要作用[2],而SOCl是MADS-box基因家族的一员,能够介导来自光周期途径、春化途径、自主途径和赤霉素途径的花时基因信号[3],作用于下游花分生组织特异基因,促进植物开花,是参与植物开花的一个重要基因,对SOC1蛋白及与其相互作用蛋白的研究对探究植物开花有很大帮助。
雷竹(Phyllostachys violascens)为禾本科竹亚科刚竹属竹种,是中国特有的优良经济竹种。雷竹开花现象十分普遍[4],观察结果显示,雷竹开花时间不规律,开花前具有一些明显的预兆,表现为雷竹笋出土时间提早,产量低,个体比正常笋较小,颜色偏红。多数雷竹开花后不久便死亡,造成竹林的整体衰败。现阶段,对雷竹开花调控机理方面的研究报道还比较少。本课题组目前已获得雷竹SOCl的编码序列,以此为基础进行相关实验,相信可以更好地帮助了解雷竹开花的分子调控机制。
分子生物学中,若想特异性反映某种组织或细胞在特定发育阶段表达的编码基因,构建cDNA文库具有明显的优势。同时,酵母双杂交(yeast two hybrid,Y2H)是一种快速检测和鉴定蛋白质相互作用的方法[5],其原理是通过激活报告基因的表达来研究蛋白质的相互作用[6],利用已知蛋白质通过双杂交技术从酵母cDNA文库中筛选与之相互作用的靶标蛋白,对实验研究有很大的帮助[7,8],该技术已经在拟南芥、水稻等许多植物研究中得到广泛应用[9,10]。本实验通过构建开花时期雷竹的酵母双杂交cDNA文库,并利用花期调控蛋白SOC1作为诱饵,筛选参与调控雷竹开花的蛋白,以期为研究SOC1的作用机制奠定基础。
1 材料与方法
1.1材料
1.1.1实验材料 材料来源为浙江省临安市浙江农林大学校园竹种园内3-4月份开花时期的雷竹,每隔一周分别采取嫩叶、成熟叶、竹茎、花芽和花,液氮速冻后保存到-80℃超低温冰箱。
1.1.2实验试剂 克隆载体T-Vector pMD19(simple)购自TaKaRa公司,诱饵表达载体pGBKT7、pGADT7、酵母菌株AH109/Y187购自Clontech公司。酵母双杂交试剂盒BD Matchmaker Library Construction & Screening Kits、Aureobasidin A(AbA)、酵母培养和转化试剂购自Clontech公司。酵母质粒提取试剂盒购自北京天根生化公司,构建重组载体所用各种酶、DNA Marker、胶回收纯化试剂盒、LB培养基组分胰蛋白胨和酵母膏购自TaKaRa公司,引物合成和测序由上海生工生物工程公司完成。
1.2方法
1.2.1诱饵表达载体构建 根据雷竹SOCl编码序列设计引物对其CDS区进行PCR扩增,上游引物:5'-CGGAATTCATGGTGCGGGGGAAGACGCA-3',下游引物:5'-GCGTCGACTCAAGCATGGTTAGCCCGAT-3',产物连接到T-Vector pMD19(simple)克隆载体,转化大肠杆菌DH5α感受态细胞,阳性克隆菌液送上海生工生物工程公司测序,将测序正确的阳性克隆提取质粒。将阳性克隆质粒与pGBKT7载体同时进行双酶切反应,酶切产物回收,T4 DNA连接酶连接5 h,连接产物转化大肠杆菌DH5α感受态细胞,单克隆菌斑进行PCR鉴定得到阳性转化子并进行质粒酶切鉴定。
1.2.2诱饵蛋白毒性及自激活检测 将空载体pGBKT7质粒(对照)和重组质粒pGBKT7-PvSOC1分别转入酵母AH109感受态细胞分别涂布于SD/-Trp和 SD/-Trp/-Leu/-Ade/-His固体培养基上,30℃孵育2-3 d,观察菌落形态及其颜色,以此判断是否具有自激活活性。
1.2.3cDNA文库的建立 将采集的雷竹不同部位样品混合,在液氮中快速研磨成粉状,采用Trizol法提取总RNA。用Oligo(dT)Primer合成第一条单链cDNA,以单链cDNA为模板进行LD-PCR合成双链cDNA,采用SPINTMTE-400柱子纯化双链cDNA,回收大于500 bp 双链DNA,利用1%琼脂糖凝胶电泳检测纯化后的双链cDNA。cDNA文库构建的具体步骤参照崔红军等[11]说明的文库构建方法进行,采用醋酸锂方法制备完酵母感受态细胞,在10 mL的灭菌离心管中加入20 μL双链cDNA、6 μL pGADT7-Rec、20 μL变性处理的鲑鱼精、600 μL酵母Y187感受态细胞以及2.5 mL新鲜配制的PEG/LiAc溶液,轻轻混匀,30℃温育45 min,加入160 μL DMSO,42℃水浴20 min,700 r/min离心5 min,弃上清,重悬沉淀于3 mL YPD Liquid Medium中。30℃摇晃培养90 min。700 r/min离心5 min,弃上清,重悬沉淀于30 mL 0.9% NaCl中。
1.2.4cDNA文库的质量评定 转化后的悬浮液分别稀释10、100、1 000和10 000倍,涂布150 μL稀释液在100 mm SD/-Leu固体培养基平板上,30℃培养,统计菌落数量,计算转化率,平均转化率(每微升 pGADT7-Rec的转化子数)=平板单克隆数量×稀释倍数×150。用含有25%甘油的YPD冷冻培养基重悬浮、合并所有SD/-Leu固体培养基上的阳性克隆,采用相同的方法稀释菌液,用血球计数板统计细胞浓度。文库滴度=平板上单菌落数×稀释倍数×10/mL。采用PCR检测法计算文库重组率,随机挑取单克隆菌落作为模板(由于酵母属于真核细胞,细胞壁较厚,需反复冻融裂解细胞,以裂解过的细胞液为模板),用pGADT7-Rec通用引物进行菌液PCR,上游引物:5'-CTATTCGATGATGAAGATA CCCCACCAAACCC-3',下游引物:5'-GTGAACTTGC GGGGTTTTTCAGTATCTACGATT-3',1%琼脂糖凝胶电泳检测反应产物。重组率计算方法为:

1.2.5诱饵载体的酵母双杂交筛选 从涂布有诱饵载体转化菌液的SD/-Trp固体平板上挑取菌落,在SD/-Trp液体培养基上30℃过夜培养至OD600超过0.8。离心弃上清,重悬浮于3 mL SD/-Trp液体培养基,加入1 mL雷竹cDNA文库菌液,在2 L锥形瓶中用45 mL 2×YPDA液体培养基30℃、50 r/min孵育约20 h。离心弃上清,用0.5×YPDA液体培养基重悬浮涂布于营养缺陷型固体培养基SD/-Ade/-His/-Leu/-Trp/X-α-gal上,30℃倒置培养2-3 d。
1.2.6酵母共转化验证 将筛选到的阳性菌斑扩大培养提取质粒,PCR检测插入片段的大小,将大于500 bp的单克隆质粒转化大肠杆菌DH5α感受态细胞,得到的阳性单克隆送上海生工生物工程公司测序。
将提取的含有互作基因的文库酵母质粒与pGADT7-Rec分别同pGBKT7-PvSOC1质粒共转化酵母菌株Y2H Gold感受态细胞,涂布于缺失固体培养基SD/-Trp/-Leu上,30℃培养2-3 d,菌落小量培养后悬滴于 SD/-Trp/-Leu/-His/-Ade/X-α-gal固体培养基,30℃培养观察生长情况。
2 结果
2.1诱饵载体的构建
以雷竹cDNA为模板扩增SOCl基因,得到条带单一的约681 bp的产物(图1-A),将目的片段连接到T-Vector pMD19(simple),送公司测序,结果证实与雷竹SOCl序列一致,用EcoR I和Sal I双酶切pMD19-PvSOC1和空载pGBKT7质粒,获得含有相同黏性末端的目的片段和线性载体,T4连接酶连接后转化DH5α感受态细胞,获得重组质粒,小量双酶切重组质粒得到与预期大小一致的目的条带(图1-B),说明诱饵载体pGBKT7-PvSOC1构建成功。
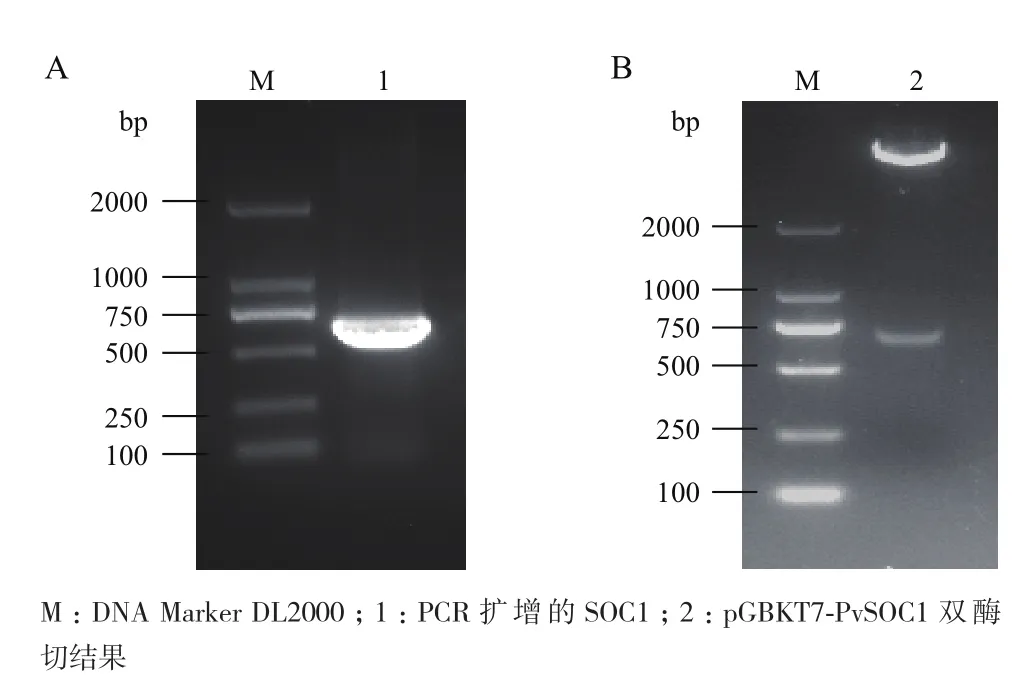
图1 PvSOC1片段扩增(A)及诱饵载体双酶切(B)电泳图
2.2诱饵蛋白载体自激活和毒性检测
用诱饵载体与空载体分别转化酵母AH109菌株,转化菌落可以在SD/-Trp上生长获得白色菌落,直径大于2 mm,蓝白斑筛选实验未变色,且诱饵载体和对照相比生长速度无明显差距。说明诱饵载体没有毒性,且不具有自激活性,可以用于下一步筛选实验。
2.3雷竹cDNA文库建立和质量评定
提取雷竹不同部位不同时间混合样品总RNA,电泳检测RNA的完整性。结果(图2)显示,总RNA有3条带,28S和18S条带清晰,28S亮度约为18S的2倍且5.8S较弱,说明总RNA完整性好,未发生降解,符合建库要求。以此RNA为模板反转录合成cDNA,并经双链cDNA过柱纯化,除去小片段(图3)。经计算,得到的文库平均转化率为每微克pGADT7-Rec 3.0×106转化子,文库细胞浓度约为9.0×106/mL,文库滴度约为7.5×106cfu/mL。随机挑取24个文库单克隆培养并提取质粒,用载体通用引物进行质粒PCR检测插入片段的大小,结果(图4)显示插入片段主要在250-2 000 bp之间,总体结果说明文库质量满足进一步的实验需求。
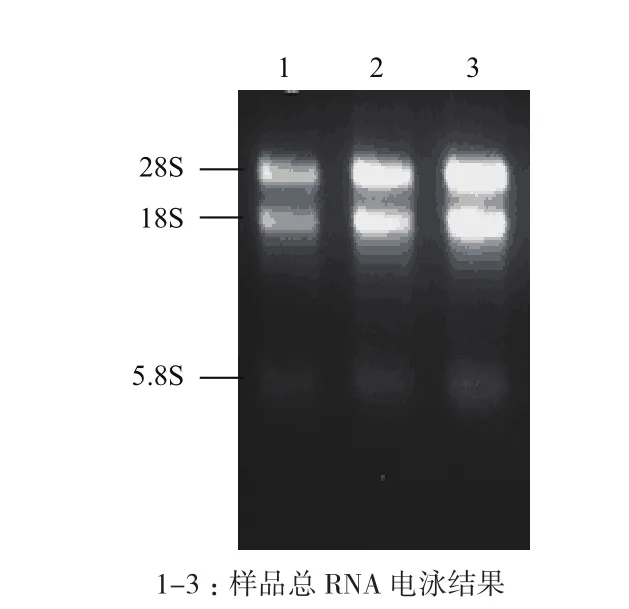
图2 总RNA电泳图
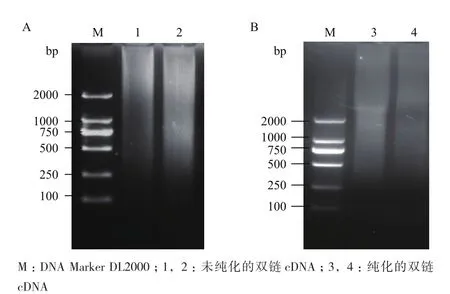
图3 未纯化(A)和纯化后(B)的双链cDNA电泳图

图4 阳性克隆质粒检测电泳图
2.4筛选与PvSOC1相互作用的文库蛋白
以PvSOC1为诱饵蛋白进行酵母双杂交筛选雷竹cDNA文库,在SD/-Trp/-Leu/-His/-Ade/X-α-gal固体培养基上30℃培养2-3 d长出蓝色菌斑(图5),菌落PCR检测(图6),除去含有500 bp以下小片段的单克隆后,将得到的单克隆扩大培养提取质粒并送生物公司测序。
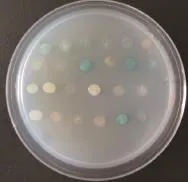
图5 互作蛋白的筛选
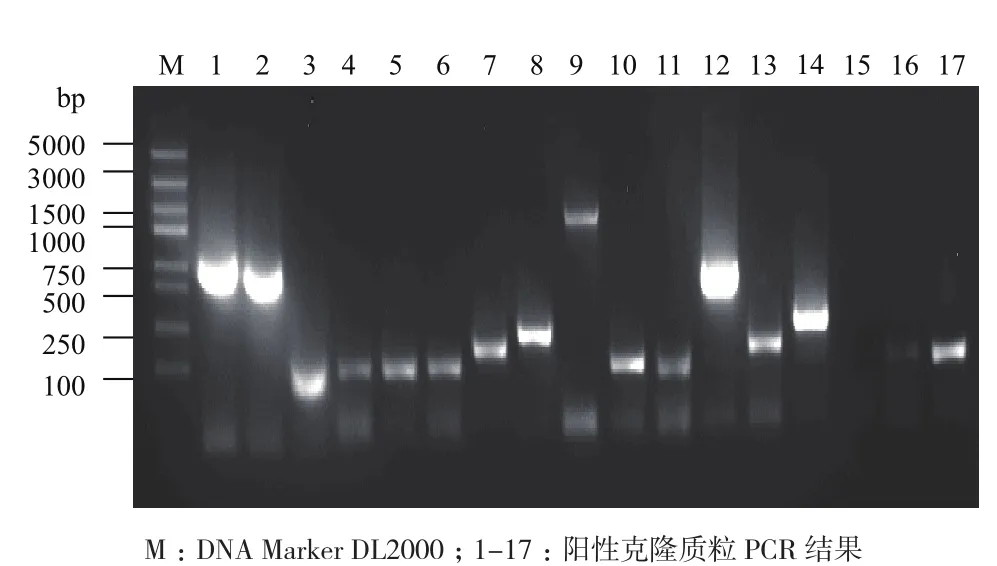
图6 质粒验证互作蛋白
2.5相互作用酵母体内验证
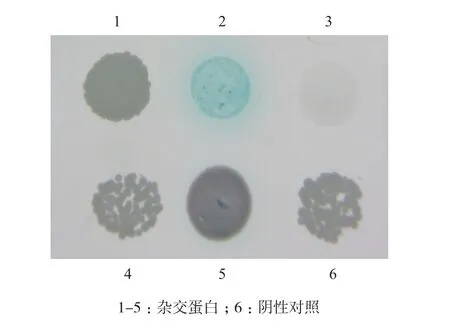
将阳性单克隆文库质粒(阳性对照)及pGADT7-Rec空载体质粒(阴性对照)分别与诱饵载体质粒pGBKT7-PvSOC1共转入酵母菌株Y2H Gold感受态细胞,涂布于SD/-Trp/-Leu营养缺陷型固体培养基上,30℃培养3-5 d,挑取阳性单克隆并小量活化,悬滴法在SD/-Trp/-Leu/-His/-Ade/X-α-gal固体培养皿上点板,30℃倒置培养。结果(图7)表明,在SD/-Trp/-Leu培养基上阳性对照组都能正常生长,而在SD/-Trp/-Leu/-His/-Ade/X-α-gal培养基上,只有一个阳性对照单克隆变蓝,说明筛选到一个文库蛋白与诱饵蛋白真正存在相互作用。
2.6目标蛋白的生物信息学分析
对筛选到的蛋白进行生物信息学分析,结果显示,该蛋白编码基因cDNA全长为1 721 bp,含有一个完整的ORF序列,长度为1 377 bp,编码459个氨基酸,蛋白分子量约为50.22 kD,等电点为6.98。
将该蛋白的氨基酸序列在NCBI中进行blastp分析,显示该蛋白和水稻、玉米、高粱中的同源序列一致性达到77%、76%和70%,利用生物学软件进行不同物种间该蛋白氨基酸序列比对(图8),显示该蛋白的特征氨基酸序列在不同物种中较为保守,结构分析表明该蛋白属于 LRR-RI超家族,是一个富含亮氨酸的类受体蛋白激酶。不同物种中的该同源蛋白聚类分析(图9)显示,雷竹和水稻聚为一支,亲缘关系最近。
3 讨论
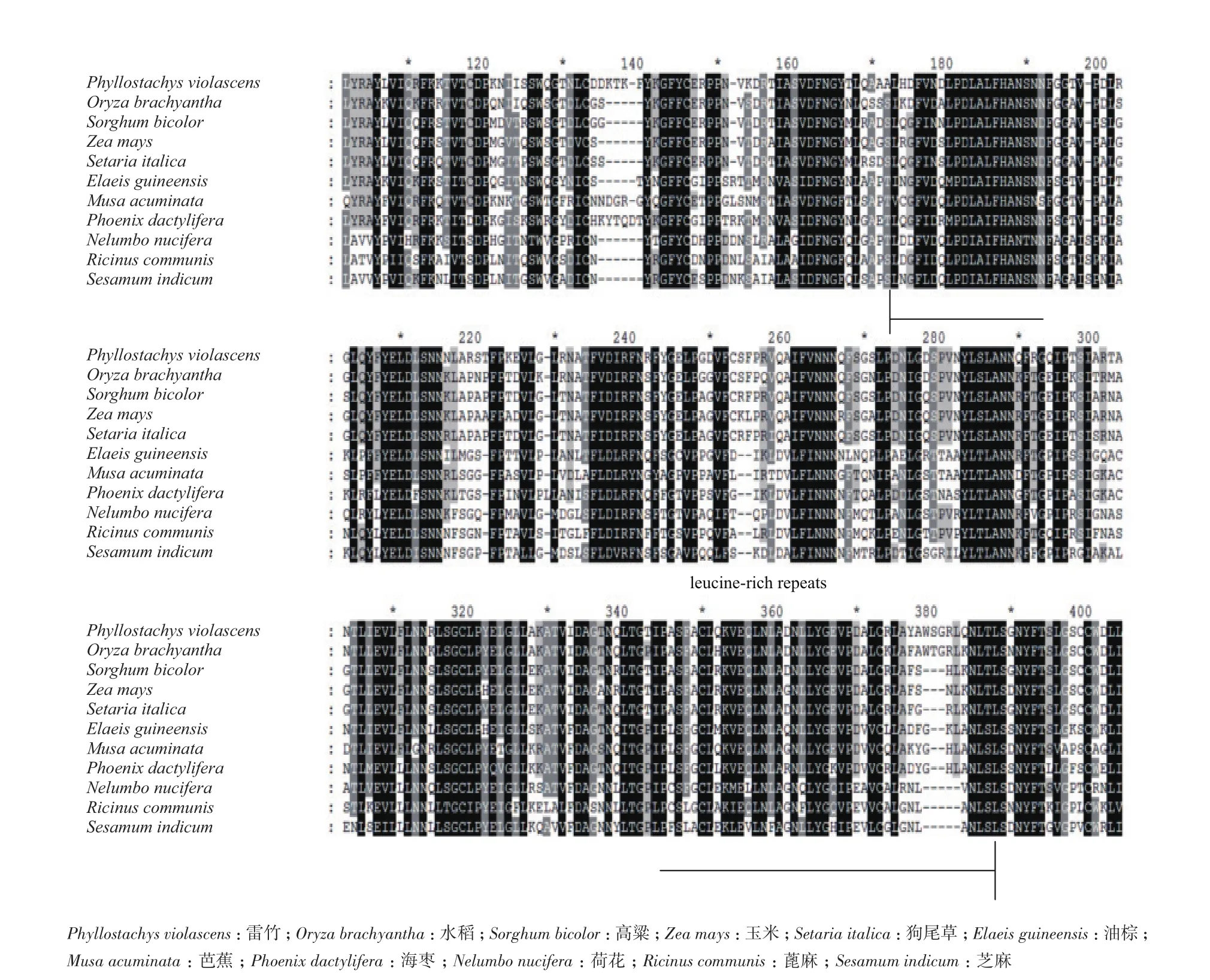
图8 不同物种中目标蛋白序列比对图
近年来关于高等植物开花的研究非常多,已经确定的开花途径有自主途径、光周期途径、春化途径、赤霉素途径,各条途径不是独立发挥作用,而是相互联系和影响,协同控制开花,4条途径的相应基因组成响应外源信号和协同自身发育状况的通路共同对开花时期进行控制[12]。以模式植物拟南芥和金鱼草等为材料,通过对突变体的研究与分子克隆等手段,分离和研究了许多参与植物开花过程的关键基因,如SOCl、FLC、FT等,4条开花途径主要通过调节这些整合因子的表达水平来调节花发育和控制开花时间[13-15]。找到与这些整合因子有相互作用的其他已知或未知蛋白可以帮助我们更好地研究植物开花机制。虽然植物开花研究得很多,但是调控开花的机制在分子层面的阐述还不是很完善[16],与竹子开花相关的研究更少[17]。
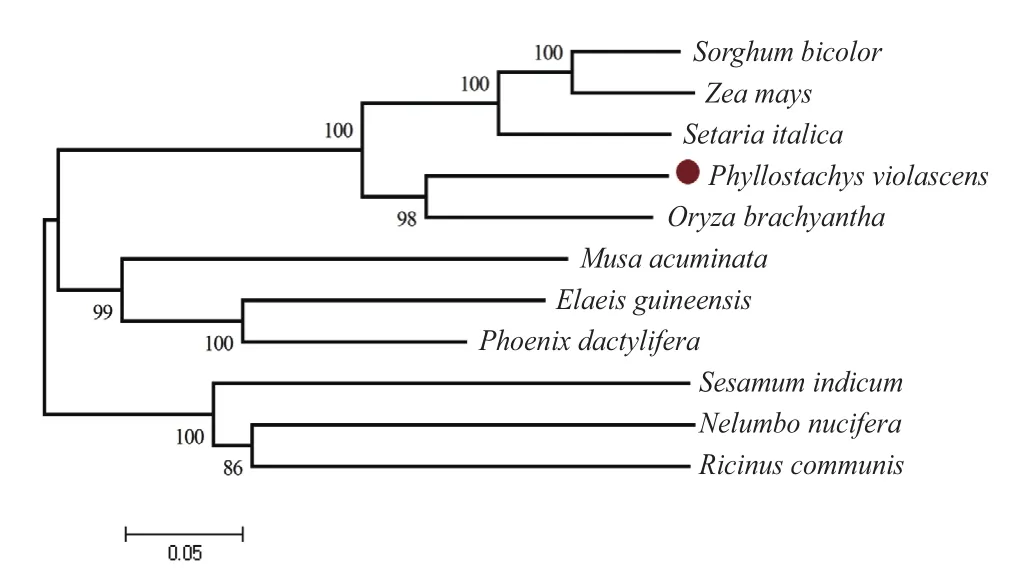
图9 不同物种中目标蛋白聚类分析
酵母双杂交技术自报道以来,已被广泛应用于确定生物体中的蛋白质与蛋白质之间的互作关系[18]。同时构建cDNA文库是分子生物学中常用的一种方法,而cDNA文库和酵母双杂交技术相结合可以更方便地研究已知蛋白与靶蛋白之间的互作关系,对研究功能特异性的蛋白有重要作用。目前关于构建竹子酵母双杂交cDNA文库的报道还很少。本实验成功构建了花期雷竹酵母双杂交cDNA文库,并筛选到与雷竹SOC1蛋白存在相互作用的蛋白,对后续研究雷竹开花奠定了重要的实验基础,而实验中仅选择了一小部分阳性单克隆进行验证和测序,尚有许多后续工作需要进行,相信会有更多的文库靶蛋白被鉴定出来,从而进一步研究这些蛋白在雷竹开花时期的功能。
很多实验表明,SOC1蛋白与很多激酶存在相关性。有研究显示,在蛋白激酶Casein Kinase2 α-Subunits(CKAs)突变体拟南芥中,SOCl的表达与野生型中SOCl的表达有明显差异[19],表明SOC1的含量变化是激酶的突变效应之一。同时,与野生型相比,在同一生长阶段,ckala2a3三突变体中开花整合因子FT和SOCl的表达量大量减少,表现为影响开花时间[20]。还有证据表明,在拟南芥中开花整合因子SOC1能够影响气孔开放,而蛋白质磷酸化酶PP1是植物叶片蓝光信号途径中的重要成员[21],后者与气孔开放相关,暗示SOC1蛋白的磷酸化或去磷酸化可能会影响其功能进而参与调控植物生命活动。
本实验构建了开花时期的雷竹cDNA文库,并筛选到了一个与开花整合因子SOC1存在相互作用的蛋白激酶,为雷竹开花过程相关基因的克隆和功能研究提供了很好的前提条件,筛选的目标蛋白激酶的特征氨基酸序列在不同物种中非常保守,推测其功能也可能具有保守性并在植物开花过程中发挥作用,但是关于该激酶的具体功能及其作用机制还有待进一步的研究。
4 结论
成功构建了雷竹开花时期可用于酵母双杂交的cDNA文库,文库的转化率为每微克pGADT7-Rec 3.0 ×106转化子,文库滴度为7.5×106cfu/mL,插入片段主要在250-2 000 bp之间。利用该cDNA文库得到与诱饵蛋白PvSOC1相互作用的蛋白,经鉴定靶标蛋白是一个富含亮氨酸的蛋白激酶,不同物种中的同源蛋白都含有此特征氨基酸序列,且与水稻中的同源蛋白亲缘性最高。
[1]Moon J, Suh SS, Lee H, et al. The SOC1 MADS box gene integrates vernalization and gibberellin signals for flowering in Arabidopsis[J]. The Plant Journal, 2003, 35(5):613-623.
[2]张则婷, 学宝. MADS-box基因在植物发育中的功能[J]. 植物生理学通讯, 2007, 43(2):218-222.
[3]Ramanayake S. Flowering in bamboo:an enigma[J]. Cey J Sci(Bio Sci), 2006, 35(2):95-105.
[4]林新春, 袁晓亮, 林绕, 等. 雷竹开花生物学特性研究[J]. 福建林学院学报, 2010(4):333-337.
[5]Fukao Y. Protein-protein interactions in plants[J]. Plant and Cell Physiology, 2012, 53(4):617-625.
[6]Fields S, Song O. A novel genetic system to detect protein-protein interactions. [J]. Nature, 1989, 340(6230):245-246.
[7]Ito T, Chiba T, Ozawa R, et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome[J]. Proceedings of the National Academy of Sciences, 2001, 98(8):4569-4574.
[8]James P, Halladay J, Craig EA. Genomic libraries and a host strain designed for highly efficient two-hybrid selection in yeast[J]. Genetics, 1996, 144(4):1425-1436.
[9] Costa M, Nobre MS, Becker JD, et al. Expression-based and co-localization detection of arabinogalactan protein 6 and arabinogalactan protein 11 interactors in Arabidopsis pollen and pollen tubes[J]. BMC Plant Biology, 2013, 13(1):7.
[10] Singh R, Lee MO, Lee JE, et al. Rice mitogen-activated protein kinase interactome analysis using the yeast two-hybrid system[J]. Plant Physiology, 2012, 160(1):477-487.
[11]崔红军, 张军杰, 黄玉碧. 玉米根部酵母双杂交cDNA文库的构建及评价[J]. 分子植物育种, 2008, 6(1):161-164.
[12]张学文, 洪亚辉, 赵燕. 植物开花时期的分子控制[J]. 湖南农业大学学报:自然科学版, 2004, 29(6):523-528.
[13] 刘丽娜, 刘伟, 叶庆生. 春化作用相关基因FLC的研究进展[J]. 西北植物学报, 2004, 23(12):2229-2234.
[14]汤青林, 许俊强, 宋明, 等. 芥菜开花信号整合子的两个核心转录因子FLC和SVP相互作用的体外检测[J]. 园艺学报,2011, 38(12):2317-2324.
[15]张婧. 高等植物开花基因 FT 研究进展[J]. 现代农业科技,2012(3):31-32.
[16]Sarma VV. Flowering of Melocanna baccifera(Bambusaceae)in northeastern India[J]. Curr Sci, 2009, 96(9):1165.
[17]Lin CS, Lin CC, Chang WC. Effect of thidiazuron on vegetative tissue-derived somatic embryogenesis and flowering of bamboo Bambusa edulis[J]. Plant Cell, Tissue and Organ Culture, 2004,76(1):75-82.
[18]Chen J, Carter MB, Edwards BS, et al. High throughput flow cytometry based yeast two-hybrid array approach for large-scale analysis of protein-protein interactions[J]. Cytometry Part A,2012, 81(1):90-98.
[19]Mulekar JJ, Bu Q, Chen F, et al. Casein kinase II α subunits affect multiple developmental and stress-responsive pathways in Arabidopsis[J]. The Plant Journal, 2012, 69(2):343-354.
[20]Lu S X, Liu H, Knowles SM, et al. A role for protein kinase casein kinase2 a-subunits in the Arabidopsis circadian clock1[J]. Plant Physiol, 2011, 157(3):1537.
[21]Kimura Y, Aoki S, Ando E, et al. A flowering integrator, SOC1,affects stomatal opening in Arabidopsis thaliana[J]. Plant and Cell Physiology, 2015, 56(4):640-649.
(责任编辑 李楠)
Screening for the Interaction Proteins of SOC1 from Phyllostachys violascens Using Yeast Two-Hybrid System
PAN Xian-fei SHI Quan LIN Xin-chun XU Ying-wu CAO You-zhi
(The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A & F University,Lin'an 311300)
This work aims to study the target proteins of suppressor of overexpression of constans1(SOCl)in flowering way of Phyllostachys violaceus and to explore the action mechanism of SOCl. The pGBKT7-PvSOC1 vector was constructed as the bait protein,then the cDNA library of P. violascens flowering was established using SMART technology,and the interaction proteins with SOC1 were screened by yeast two-hybrid system as well as analyzed and identified. The results showed that the cDNA library for yeast two-hybrid was constructed successfully,the conversion rate of the library was about 3.0×106converters per μg pGADT7-Rec,and the capacity of the library was up to 7.5×106cfu/mL and the insert fragments were distributed from 0.25 kb to 2 kb. The protein interacted with the bait protein PvSOC1 was screened through the yeast two-hybrid technology. The screened target protein was identified as a protein kinase containing plentiful leucine which amino acid sequence was very conservative in different species,and had the highest affinity with rice.
Phyllostachys violascens;SOC1;cDNA library;yeast two-hybrid;protein interaction
10.13560/j.cnki.biotech.bull.1985.2016.08.030
2016-01-20
国家自然科学基金项目(31270715),浙江农林大学人才启动基金项目(2012FR079)
潘现飞,男,硕士,研究方向:生物大分子结构与功能;E-mail:panxianfei0829@163.com
曹友志,男,博士,研究方向:植物分子生物学;E-mail:yzcao@zafu.edu.cn

