长链多不饱和脂肪酸EPA、DHA的基因工程研究进展
李文宗 王磊
(中国农业科学院生物技术所,北京 100081)
综述与专论
长链多不饱和脂肪酸EPA、DHA的基因工程研究进展
李文宗 王磊
(中国农业科学院生物技术所,北京 100081)
长链多不饱和脂肪酸(long chain polyunsaturated fatty acid,LCPUFA)对维持人体健康具有重要作用,对其需求逐年增加,但是由于环境污染与渔业资源的下滑,有限的鱼油资源越来越不能满足人们需求。运用现代生物技术人们已相继分离了多个LCPUFA合成相关基因,并阐明了多条LCPUFA合成代谢途径。通过转基因技术在高等植物中成功合成了对人体健康十分重要的长链多不饱和脂肪酸,尤其是二十碳五烯酸(EPA),二十二碳六烯酸(DHA)。综述了LCPUFA的合成途径及转基因研究的最新进展,分析合成LCPUFA存在的问题及解决方法,并对未来多不饱和脂肪酸EPA,DHA的基因工程研究进行展望。
长链多不饱和脂肪酸;EPA;DHA;转基因植物
长链多不饱和脂肪酸,指含有两个或两个以上双键且碳链长度为18-22个碳原子的直链脂肪酸,大部分由寒冷地区的水生浮游植物合成。长链多不饱和脂肪酸(long chain polyunsaturated fatty acid,LCPUFA)按照从甲基端开始第1个双键的位置不同,可分为ω-3和ω-6多不饱和脂肪酸[1]。它同维生素、矿物元素一样是人体的必需营养素,是一类在医学[2]和保健[3]方面有重要作用的物质。ω-3长期摄入量不足容易导致心脏和大脑等重要器官功能障碍。ω-3不饱和脂肪酸中对人体最重要的两种不饱和脂肪酸是二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)。EPA即二十碳五烯酸的英文缩写,可以帮助降低胆固醇和甘油三酯的含量,促进体内饱和脂肪酸代谢。具有降低血液黏稠度,增进血液循环,提高组织供氧的作用。可防止脂肪在血管壁的沉积,预防动脉粥样硬化的形成和发展、预防脑血栓、脑溢血、高血压等心血管疾病[4],被称为“血管清道夫”。DHA是神经系统细胞生长及维持的一种主要成分,是大脑和视网膜的重要构成成分,在人体大脑皮层中含量高达20%,在眼睛视网膜中所占比例最大,约占50%,因此,对胎婴儿智力和视力发育至关重要[5-7],同时还具有软化血管的功效,俗称“脑黄金”。研究发现一些植物来源的多不饱和脂肪酸能够在人体内被转化为EPA和DHA,但是效率比较低[8]。LCPUFA主要来源于深海鱼类,但鱼类自身合成能力很有限,主要靠食用单细胞藻类和浮游植物通过食物链富集[9]。由于人们生活水平的提高和渔业资源的减少[10],以及重金属和有机物造成的海洋污染[11-14],LCPUFA的市场供需差额越来越大,单纯地靠从鱼类食物中摄取已不能满足需要。利用基因工程手段,通过转基因植物生产LCPUFA具有成本低、重金属含量低、减少海洋捕捞、保护生态等优点,并能补充满足人们的营养健康需求[15,16]。
1 LCPUFA的生物合成途径
1.1需氧型LCPUFA合成途径
人和动物可从膳食来源或通过转换亚油酸(linoleic acid,LA)或亚麻酸(α-linolenic acid,ALA)而获得ω-3长链多不饱和脂肪酸,LA和ALA是人类膳食中的必须脂肪酸。尽管人类和许多其他脊椎动物能够将植物来源的LA或ALA转换为长链多不饱和脂肪酸,但这种转换的速率比较低,且随着年龄的增长其转化效率越来越低。由于农作物和园艺植物以及其他被子植物不具有合成长链ω-3脂肪酸如EPA、DHA所需要的酶。因此与动物不同,高等植物不能合成EPA和DHA,而微藻类、苔藓和真菌可以合成ω-3长链多不饱和脂肪酸,它们的合成往往需要一系列的氧去饱和与延长反应(图1),都是以必需脂肪酸LA和ALA为前体物质,丙二酸单酰辅酶A为二碳单元供体,在一系列脂肪酸脱氢酶与脂肪酸延长酶的催化作用下,最终合成长链多不饱和脂肪酸[17-19]。而目前研究清楚的主要有△4、△6和△8途径(图1)。
1.1.1△6途径 △6途径的研究最为详细,该途径以LA和ALA为底物,当以LA为底物时在△6-脱氢酶的去饱和作用下生成γ-亚麻酸(GLA),而γ-亚麻酸在△6-延长酶的延长作用下合成二高γ-亚麻酸(DGLA),最后二高γ-亚麻酸在△5-脱氢酶的作用下生成花生四烯酸(ARA)。当以ALA为底物时,在△6-脱氢酶的去饱和作用下生成十八碳四烯酸(SDA),而十八碳四烯酸(SDA)在△6-延长酶的延长作用下合成二十碳四烯酸(ETA),最后二十碳四烯酸(ETA)在△5-脱氢酶的作用下生成二十碳五烯酸(EPA)。其中ARA可以在 △17-脱氢酶的作用下生成EPA。
1.1.2△8途径 △8途径与△6途径的主要差别在于△6途径中最初底物首先在△6-脱氢酶的催化下进行脱氢反应,然后进行碳链延长。而△8途径在△9-碳链延长酶的作用下,先进行碳链延长再氧化脱氢。当以LA为底物时在△9-延长酶的延长作用下生成二十碳二烯酸,而后二十碳二烯酸在△8-脱氢酶的作用下生成二高γ-亚麻酸(DGLA),最后二高γ-亚麻酸在△5-脱氢酶的作用下生成花生四烯酸(ARA)。当以ALA为底物时在△9-延长酶的延长作用下生成二十碳三烯酸,而后二十碳三烯酸在△8-脱氢酶的作用下生成二十碳四烯酸,最后二十碳四烯酸在△5-脱氢酶的作用下生成EPA。
1.1.3△4途径 △4途径一般发生在低等生物中,是EPA转化为DHA的主要途径。EPA在△5-延长酶的作用下生成二十二碳五烯酸(DPA)而后二十二碳五烯酸(DPA)在△4-脱氢酶的作用下最终生成DHA。
1.2厌氧型LCPUFA合成途径
该途径存在于海洋微生物体内。其在催化生成LCPUFA时与需氧型LCPUFA合成途径[20]较类似,均以乙酰辅酶A为最初底物,丙二酸单酰辅酶A为二碳单元供体经过缩合、脱水及还原等过程不断加入二碳单元,延长碳链合成最终产物。该过程中需要一种关键的酶即复合体酶一聚酮体合成酶(polyketide synthase,PKS),它是由基因组中的3个或4个开放阅读框编码的亚单位组成的多结构域酶[21]。该途径比需氧型LCPUFA合成途径相对简单。
2 利用转基因植物合成EPA和DHA
2.1△6途径产生多不饱和脂肪酸的研究进展
将来自紫草科琉璃苣属植物(Borago officinalis)的△6-desaturase基因和来自小立碗藓(Physcomitrella patens)的△6-elongase基因和来自高山被孢霉(Mortierella alpina)的 △5-desaturase基因与种子特异性启动子连接成功构建表达载体,转化到亚麻(Linum usitatissimum)和烟草(Nicotiana tabacum)[22]中,从而获得△6合成途径。结果在种子中ARA,EPA只有很少的积累,大约只有1.0% 的 AA和 0.8%的 EPA。同时也发现了大量的中间产物,其中γ-亚麻酸(g-linolenic acid,GLA)和十八碳四烯酸(stearidonic acid,SDA)等的含量较高[22]。结果分析认为第二步的反应即从SDA到ETA的过程中△6-elongase碳链延长的效率很低,仅为10%,出现“瓶颈”现象。
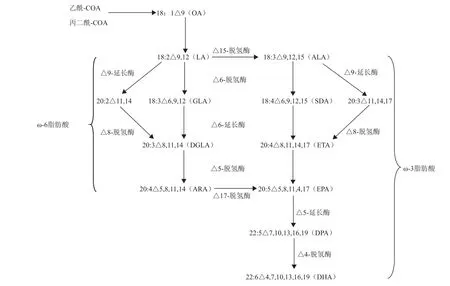
图1 需氧型LCPUFA的生物合成途径
当EPA在转基因植物中能成功合成以后,Rbert等把目标放在了获取更多的DHA,Robert等[23]将斑马鱼(Daniorerio)的△6/△5- 双功能脱氢酶基因、秀丽线虫(Caenorhabditis elegans)的△6-elongase基因 、盐生巴夫藻(Pavlova salina)的△5-elongase基因和△4-desaturase基因分2步转入拟南芥中,最终生成了0.5%的DHA,来自于斑马鱼(Daniorerio)的△6/△5-双功能脱氢酶基因在行使去饱和作用时是以酰基-CoA 中的脂肪酸为底物,其产物可直接被△6-碳链延长酶利用,大大提高了碳链延长效率,突破了“瓶颈”现象。但是可能是由于脱氢酶来源于动物在植物中的活性不高,导致最终得到的DHA的含量也不高。虽然结果不尽如人意,但是证明了在转基因植物中可以合成DHA。
使用芥菜为转基因植物合成LCPUFA,Wu等[24]采用相同的方法先将来自于畸雌腐霉(Pythium irregulare)的△6-desaturase基因和来自于海洋破囊壶菌(Thraustochytrium sp.)的△5-desaturase基因和来自于小立碗藓(Physcomitrella patens)的△6-elongase基因与种子特异性启动子连接成功构建表达载体,转化到芥菜中,产生了约7.7%的ARA和0.8%的 EPA。为了得到更多的EPA,Wu等[24]在此基础上又加入了来自于金盏花(Calendulaofficinalis)的△12-desaturase基因,目的在于为了增加LA的含量与减少18:2n-9副产物的生成,加入了来自于海洋破囊壶菌(Thraustochytrium sp.)的△6-elongase基因,为了加强碳链延长过程从而克服“瓶颈”现象。加入来自于畸雌腐霉(Pythium irregulare)的ω3 desaturase基因,为了促进花生四烯酸转变为EPA,结果显示最终EPA浓度达到了8%。随后Wu等[24]又加入了来自于虹鳟(Oncorhynchus mykiss)的△5-elongase基因与来自于海洋破囊壶菌(Thraustochytrium sp.)的△4-desaturase基因,形成了DHA的合成途径,研究人员又加入了溶血磷脂酰基转移酶(LPAAT),它可以增强脂肪酸从磷脂中转换到酰基辅酶A中的能力从而进一步克服“瓶颈”现象。最后他们将这9个基因与特异性启动子连接成功后转化,最后在种子中得到约0.2%的DHA,最高含量可以达到1.5%。
Kinney等[25]以大豆为转基因受体,将来自于异枝水霉(Saprolegnia diclina)的 △6-desaturse基因,高山被孢霉(Mortierella alpina)的△6-elongase基因,高山被孢霉(Mortierella alpine)的△5-desaturase基因,异枝水霉(Saprolegnia diclina)的△17-desaturase基因,巴夫藻(Pavlova viridis)的△5-elongases基因,裂殖壶菌(Schizochytrium limacinum)的△4-desaturase基因,拟南芥的FAD3基因与特异性启动子连接,成功构建表达载体后转化大豆。Kinney等[25]最终得到的结果显示,转基因大豆种子中EPA的含量为l9.5%,几乎没有ARA。这是由于转基因大豆中包含来自异枝水霉的△17-脂肪酸脱氢酶,催化ARA脱氢后形成了更多的EPA。而DHA的含量最高能达到3.1%。与转基因烟草、亚麻不同的是大豆中碳链延长反应没有受到明显限制,从SDA到二十碳四烯酸的延长率为56%,使二十碳脂肪酸的含量高达40.2%[26]。
Cheng等[27]将畸雌腐霉(Pythium irregulare)的△6-desaturase基因,海洋破囊壶菌(Thraustochytrium sp.)的△5-desaturase基因和△6-elongase 基因,致病疫霉菌(Phytophytora infestans)的ω3 desaturase基因,金盏花(Calendula officinalis)的 △12-desaturase基因与特异性启动子napin[28]连接,成功构建表达载体Napin-A。随后他们将表达载体Napin-A转化到无芥酸芥菜型油菜株系(Zero-erucic B. juncea line l424),高芥酸埃塞俄比亚芥株系(Higherucic B. carinata line)及无芥酸埃塞俄比亚芥株系(Zero-erucic B. carinata line)3个不同的转基因受体中以探究不同转基因受体对长链多不饱和脂肪酸合成的影响发现,无芥酸芥菜型油菜株系中EPA的含量最高达到10.8%,二十二碳五烯酸(DPA)达到0.4%,△6-desaturase与△5-desaturase的脱氢效率分别为57.7%和80.8%。△6-elongase的转换效率为35.2%。在高芥酸埃塞俄比亚芥株系中EPA的含量最高达到13.7%,DPA达到1.4%,△6-desaturase与△5-desaturase的脱氢效率分别为81.8%和87.8%。△6-elongase的转换效率为41.9%。在无芥酸埃塞俄比亚芥株系中EPA的含量最高能达到25%,DPA达到4.0%,△6-desaturase与△5-desaturase的脱氢效率分别为91.5%和86.5%。△6 -elongase的转换效率为51.9%。对比结果发现无芥酸埃塞俄比亚芥是最优的转基因受体。来自麦角菌(Claviceps purpurea)的ω3 desaturase基因[29]具有将ω-6多不饱和脂肪酸转变为ω-3多不饱和脂肪酸的功能,来自畸雌腐霉(Pythium irregulare)的ω3 desaturase基因[30]能高效的将花生四烯酸(ARA)转变为EPA。将这两个基因与畸雌腐霉(Pythium irregulare)的△6-desaturase基因,海洋破囊壶菌(Thraustochytrium sp.)的△5-desaturase基因和假微型海链藻(Thalassiosira pseudonana)的elongase基因一起构建表达载体转化芥菜,结果显示这两个基因能大大增加芥菜中EPA的含量[27]。这为今后在植物中合成长链多不饱和脂肪酸提供了新的高效的基因。
Ruiz-Lopez等[31]以亚麻荠(Camelina sativa)为转基因受体,将来自于海洋真核微藻(Ostreococcus tauri)的Δ6-desaturase基因,小立碗藓(Physcomitrella patens)的△6-elongase基因,海洋破囊壶菌(Thraustochytrium sp.)的△5-desaturase基因,大豆疫霉菌(Phytophthora sojae)的△12-desaturase基因,致病疫霉(Phytophthora infestans)的ω3 desaturase基因与特异性启动子连接,成功构建EPA表达载体。结果显示EPA的含量最高可以达到31%。其中SDA的平均含量为2.9%,表明了△6-elongase基因具有高效的延长作用,突破了“瓶颈”现象。ω-6多不饱和脂肪酸GLA,二高γ-亚麻酸与ARA的含量分别为2.7%、0.8%和1.7%,且ω-3多不饱和脂肪酸与ω-6多不饱和脂肪酸的浓度比值为9∶1,表明该途径能有效的减少ω-6多不饱和脂肪酸及中间产物的产生。为了进一步得到DHA,Ruiz-Lopez等依据以上研究,在其基础之上加入来自于海洋真核微藻(Ostreococcus tauri)的△5-elongases基因,赫氏圆石藻(Emiliania huxleyi)的 Δ4-desaturase 基因,将这7个基因与特异性启动子连接,成功构建DHA表达载体。最终结果显示EPA与DHA的含量最高能达到12%和14%[31],非常接近于鱼油中EPA与DHA的含量(即13%EPA,13%DHA)。
目前所知,得到的DHA含量最高的是 Petrie和Liu等[32]在拟南芥中利用△-6途径得到的。DHA的最高含量能达到15.1%。Liu等将来自于芽殖酵母(Lachancea kluyveri)的△12-desaturase基因,毕赤酵母(Pichia pastoris)的 △15-desaturase 基因,细小微胞藻(Micromonas pusilla)的 △6-desaturase基因,塔胞藻(Pyramimonas cordata)△6-elongases基因和△5-elongases基因,盐巴夫微藻(Pavlova salina)的△5-desaturases基因和△4-desaturases 基因与特异性启动子以及烟草花叶病毒的沉默阻抑物连接成功构建表达载体,转化拟南芥[32]。来自于细小微胞藻(Micromonas pusilla)的 △6-desaturase在整个合成途径中起到了至关重要的作用,△6-desaturase具有偏向性,在植物中对ω3脂肪酸底物的转换效率高于对ω6脂肪酸底物的转换效率即对作为脂肪酸底物的ALA的△6-去饱和酶的活性高于对LA的△6-去饱和酶活性,从而提高了EPA、DPA、DHA的水平,且该△6-desaturase还具有△8-desaturase的活性。同时最重要的一点是对作为脂肪酸底物的ALA-COA的△6-desaturase活性要高于对作为脂肪酸底物的连接与磷脂酰胆碱(PC)的sn-2位置的ALA的△6-desaturase活性,因此大大的提高了△6-elongases的延长效率,突破了“瓶颈”且能在植物中高效的表达。在此途径中还有一个重要的酶即来自于塔胞藻的△5-elongases,该酶可以高效的将EPA转换为DPA从而提高DHA的含量[32]。
2.2△8途径产生多不饱和脂肪酸的研究进展
Qi等[33]在拟南芥中成功构建了多不饱和脂肪酸的合成途径。将 Ca35S启动子分别与来自于等鞭金藻(Isochrysis galbana)的△9-elongases基因、纤细裸藻(Euglena gracil)的△8-desaturase基因及高山被孢霉(Mortierella alpina)的△5-desaturase基因连接,成功构建合成 LCPUFA的△8途径,最终虽在转基因拟南芥叶片中检测到含量为 18.8%的非内源二十碳 LCPUFA,其中 ARA 为 6.6%,EPA 3.0%,但种子中几乎没有目的脂肪[33]。此途径中的△9-碳链延长酶直接利用拟南芥内酰基-CoA库中富含的LA-CoA、ALA-CoA进行碳链延长,酶促底物不需由磷脂库向酰基辅酶A库的转运,绕过了“瓶颈”有利于LCPUFA 的起始合成。虽结果不是很理想,但提供了一个产生LCPUFA的新方案。
3 转基因植物合成EPA、DHA存在的问题及解决方法
3.1酰基-PC库与酰基-COA库之间高效的酰基转换
在植物、苔藓和微藻类中,VLC-PUFA去饱和作用天然发生在主要属于酰基-PC库的脂肪酸底物,而延长作用发生在酰基-COA库的底物,也就是说在合成LCPUFA的过程中去饱和反应与碳链延长反应的底物需要在酰基-PC库与酰基-COA库之间来回不停地转换,但是在植物体内植物内源的酰基转移酶并不能有效的催化它们之间的转换,从而影响最终EPA与DHA的产量[34]。其实脂肪酸在酰基-PC库与酰基-CoA库之间相互转换时,多种酶可促进此过程。酰基-CoA:溶血磷脂酰基转移酶(the acyl-CoA:lysophospatidylcholine acyltrasferase,LPCAT)就是其中的一种,Domergue等[35]认为此酶对目的脂肪酸的积累可能非常有用,因其不仅可催化酰基-CoA中的脂肪酸转移到酰基-PC库中,也可催化溶血磷脂中sn-2脂肪酸形成酰基-CoA,从而实现高效的酰基转换。同时还可使用依赖于酰基-CoA的△6-desaturase,能大大提高△6-elongases的延长效率,最终产生更多长链多不饱和脂肪酸。
3.2合成LCPUFA时产生的中间产物和副产物
前面介绍的研究中转基因植物在合成长链多不饱和脂肪酸的过程中也都发现生成了大量的中间产物(GLA;dihomo-gamma-linolenic acid,DGLA)和副产物(sciadonic acid,SCA;juniperonic acid,JUN),约占35%[37]。这些中间产物和副产物组成复杂且营养价值低,应将其浓度降到最低[38]。可利用具有偏好性的酶,如来自于细小微胞藻(Micromonas pusilla)的 △6-去饱和酶[32]及更加高效的酶。
3.3提高终产物DHA的含量
在目前的研究中,人们已经成功的在转基因植物中稳定获得EPA与DHA,DHA的浓度最高能达到15.1%[32],但在一定程度上我们还可以继续进行合成途径的优化得到更大浓度的DHA。(1)选取合适的LCPUFA受体,种子中富含亚油酸或亚麻酸如大豆,油菜等油料植物都是很好的LCPUFA受体。(2)要选取合适的目标基因,有时候基因的功能虽然相同但是来源不同的两个基因在行使功能的时候效率可能相差很大。同时我们拿到目标基因以后要进行密码子优化[39],可以提高LCPUFA的合成效率。(3)载体的构建,构建载体时需要选择合适的启动子,选择启动子时不仅要考虑基因表达的时间特异性、空间特异性还要注意受体植物本身的特异性[28]。在构建表达载体时,每一个转化的基因前后都有特异的启动子与终止子从而构成一个完整的表达框。基因工程手段可以生产出只含有EPA的ω-3不饱和脂肪酸(针对中老年人,因为EPA具有类激素效应,孕妇、儿童等特殊群体要避免摄入);或者生产出高DHA的ω-3不饱和脂肪酸,适合不同人群的需要。利用基因工程改良作物,在植物中生产EPA或DHA将大大的弥补市场上长期缺乏的鱼油资源,具有重要的应用价值和前景。
4 展望
长链多不饱和脂肪酸,尤其是EPA与DHA对人体健康和发育具有非常重要的作用,一般约20 kg深海鱼类可以提取出1 kg鱼油,1 kg鱼油中大概有30-120 g是DHA(鱼油中DHA和EPA的比例通常都保持在1∶3左右)。即一小瓶深海鱼油保守估计也需要20 kg以上的鲭鱼(Mackerel)、沙丁鱼(Sardines)、金枪鱼(Tuna)、鲸鱼(Whale)或者其他深海鱼类。但大西洋蓝鳍金枪鱼濒临灭绝,其他多种金枪鱼的生存状态也先后拉响了警报,多种鲸鱼数量更是锐减。当各种海洋资源在人类巨大的消费能力下都显得捉襟见肘时,现有的鱼油越来越不能满足人们的需求[40]。利用基因工程技术在植物中合成长链多不饱和脂肪酸可以化解深海鱼油资源的匮乏,满足人们的健康需求。已有的研究结果展示出了在植物中生产多不饱和脂肪酸EPA、DHA的巨大潜力,按照EPA或DHA占植物含油量的5%-10%计算,一亩油菜可以生产EPA或DHA 4-8 kg,按4 kg计算也相当于33-133 kg的深海鱼油。而且利用
[1]Schmitz G, Ecker J. The opposing effects of n-3 and n-6 fatty acids. [J]. Prog Lipid Res, 2008, 47(2):147-155.
[2]张洪涛, 单雷, 毕玉平. n-6和n-3多不饱和脂肪酸在人和动物体内的功能关系[J]. 山东农业科学, 2006(2):115-1201.
[3]陈银基, 周光宏, 徐幸莲. N-3 多不饱和脂肪酸对疾病的预防与治疗作用[J]. 中国油脂, 2006(9):31-34.
[4]Saravanan P, Davidson NC. Cardiovascular effects of marine omega-3 fatty acids[J]. Lancet, 2010, 376(9740):540-550.
[5]Das UN, Fams MD. Long-chain polyunsaturated fatty acids in the growth and development of the brain and memory[J]. Nutrition,2003, 19(1):62-65.
[6]Crawford MA, et al. Are deficits of arachidonic and docosahexaenoic acids responsible for the neural and vascular complications ofpreterm babies?[J]. Am J Clin Nutr, 1997, 4 Suppl:1032S-1041S.
[7]Spite M. Deciphering the role of n-3 polyunsaturated fatty acidderived lipid mediators in health and disease[J]. Proc Nutr Soc,2013, 72(4):441-450.
[8]曾硕士, 江黎明, 元冬娟. 脂肪酸去饱和酶的研究进展[J].生命科学, 2008, 20(5):816-820.
[9]Williams CM, Burdge G. Long-chain n-3 PUFA:plant v. marine sources[J]. Proc Nutr Soc, 2006, 65(1):42-50.
[10] Cressey D. Aquaculture:Future fish[J]. Nature, 2009, 458 (7237):398-400.
[11] 郝颖, 汪之和. EPA、DHA的营养功能及其产品安全性分析[J].现代食品科技, 2006, 22(3):180-182.
[12]Brustad M, Sandanger TM, Nieboer E. 10th anniversary review:when healthy food becomes polluted-implications for public healthy and dietary advice[J]. J Environ Monit, 2008, 10:422-427.
[13]Jacobs MN, Santillo D, Johnston PA, et al. Organochlorine residues in fish oil dietary supplements:comparison with industrial grade oils[J]. Chemosphere, 1998, 37:1709-1721.
[14]Bourdon JA, Bazin TM, Arnason TT, et al. Polychlorinated biphenyls(PCBs)contamination and aryl hydrocarbon receptor (AhR)agonist activity of omega-3 polyunsaturated fatty acid supplements:implications for daily intake of dioxins and PCBs[J]. Food Chem Toxicol, 2010, 48:3093-3097.
[15]Tocher D. Issues surrounding fish as a source of ω-3 long chain polyunsaturated fatty acids[J]. Lipid Technol, 2009, 21:13-16.
[16] Venegas-Calerón M, et al. An alternative to fish oils: Metabolic engineering of oil-seed crops to produce omega-3 long chain polyunsaturated fatty acids[J]. Prog Lipid Res, 2010, 2:108-119.
[17] Qiu X, et al. Identification of a Delta 4 fatty acid desaturase from Thraustochytrium sp. involved in the biosynthesis of docosahexanoic acid by heterologous expression in Saccharomyces cerevisiae and Brassica juncea[J]. J Biol Chem, 2001, 34:31561-31566.
[18] Spyehalla JP, Kinney AJ, Browse J. Identification of an animal omega-3 fatty acid desatarase by heterologous expression in Arabidopsis[J]. Proc Natl Acad Sci USA, l997, 18:1 242-l 147.
[19] Damude HG, et al. Identification of bifunetional △ 12/x3 fatty acid desaturases for improving the ratio of x3 to x6 fatty acids in microbes and plants[J]. PNAS, 2006, 203:9 446-9 452.
[20] Sayanova OV, Napier JA. Eicosapentaenoic acid:biosynthetic routes and the potential for synthesis in transgenic plants[J]. Phytochemistry, 2004, 65(2):147-158.
[21]Bentley R, Bennett JW. Constructing polyketides:from collie to combinatorial biochemistry[J]. Annu Rev Microbiol, 1999, 53:411-456.
[22]Abbadi A, et al. Biosynthesis of very-long-chain polyunsaturated fatty acids in transgenic oilseeds:constraints on their accumulation[J]. Plant Cell, 2004, 16:2734-2748.
[23]Robert SS, Singh SP, Zhou XR, et al. Metabolic engineering of Arabidopsis to produce nutritionally important DHA in seed off[J]. Funct Plant Biol, 2005, 32:473-479.
[24]Wu GH, Truksa M, Datla N, et al. Stepwise engineering to produce high yields of very long-chain polyunsaturated fatty acids in plants[J]. Nat Bioteehnol, 2005, 23(8):1013-1017.
[25]Kinney AJ, et al. Production of very long chain polyunsaturated fatty acids in oilseed plants:US, 2004/0172682 AI[P]. 2004-09-02.
[26]Parker-Barnes JM, et al. Identification an d characterization of an enzyme involved in the elonga- tion of n-6 and n-3 polyrunsaturated fatty acids[J]. PNAS, 2000, 97:8284-8289.
[27] Cheng B, et al. Towards the production of high levels of eicosapentaenoic acid in transgenic plants:the effects of different host species,genes and promoters[J]. Transgenic Res, 2010, 2:221-229.
[28]Wahlroos T, Susi P, Solovyev A, et al. Increase of histidine content in Brassica rapa subsp. oleifera by over-expression of histidine-rich fusion proteins[J]. Mol Breed, 2004, 14:455-462.
[29] Meesapyodsuk D, Reed DW, et al. Primary structure, regioselectivity, and evolution of the membrane-bound fatty acid desaturases of Claviceps purpurea[J]. J Biol Chem, 2007, 28:20191-20199.
[30]Bauer J, Wu GH, Qiu X. Isolation and characterization of a novel pythium omega-3 desaturase with specificity to all omega-6 fatty acids longer than 18 carbon chains:US, 2015/0211032 AI[P]. 2015-17-30.
[31] Ruiz-Lopez N, Haslam RP, et al. Successful high-level accumulation of fish oil omega-3 long-chain polyunsaturated fatty acids in a transgenic oilseed crop[J]. Plant J, 2014, 2:198-208.
[32]Petrie JR, et al. Metabolic engineering plant seeds with fish oil-like levels of DHA[J]. PLoS One, 2012, 7(11):| 49165.
[33]Qi B, Fraser T, Mugford S, et al. Production of very long chain polyunsaturated omega -3 and omega-6 fatty acids in plants[J]. Nat Bioteehnol, 2004, 22:739-745.
[34]戴晓峰, 肖玲, 武玉花, 等, 植物脂肪酸去饱和酶及其编码基因研究进展[J]. 植物学通报, 2007(1):105-113.
[35]Domergue F, et al. Relief for fish stocks:oceanic fatty acids in transgenic oilseeds[J]. Trends Plant Sci, 2005, 10:112-116.
[36] Sayanova O, et al. The role of Δ6-desaturase acyl-carrier specificity in the efficient synthesis of long-chain polyunsaturated fatty acids in transgenic plants[J]. Plant Biotechnol J, 2012, 2:195-206.
[37]Jaworski J, Cahoon EB. Industrial oils from transgenic plants[J]. Curr Opin Plant Biol, 2003, 6(2):178-84.
[38]Gómez Candela C, Bermejo López LM, et al. Importance of a balanced omega 6/omega 3 ratio for the maintenance of health:nutritional recommendations. [J]. Nutr Hosp, 2011, 2:323-329.
[39] 刘汉梅, 何瑞, 张怀渝, 等. 玉米同义密码子偏爱性分析[J].农业生物技术学报, 2 01 0, 1 8(3):456-461.
[40] 陈殊贤, 郑晓辉. 微藻油和鱼油中DHA的特性及应用研究进展[J]. 食品科学, 2013, 34(21):439-444.
(责任编辑 狄艳红)
Research Progress on Genetic Engineering for Long-chain Polyunsaturated Fatty Acids EPA and DHA
LI Wen-zong WANG Lei
(Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081)
Long-chain polyunsaturated fatty acids(LCPUFAs)play an important role in maintaining human health. The demand of edible EPA and DHA has significantly increased in recent years. However,the fish oil resource is obviously reduced due to the environmental pollution and the decline of the fishery resources,thus can't meet the demands of people. The researchers have successively separated multiple genes that involved in LCPUFA synthesis and clarified the multiple LCPUFA synthetic pathways. LCPUFAs,especially DHA and EPA,have been successfully produced in monocot and dicot plants through genetic engineering. We summarized the latest research progress of LCPUFAs bio-synthesis and genetic engineering in higher plants,and analyzed the issues of LCPUFA synthesis,then proposed the possible solutions,and had an prospect of LCPUFA by genetic engineering.
long-chain polyunsaturated fatty acids;EPA;DHA;transgenic plant
10.13560/j.cnki.biotech.bull.1985.2016.08.001
2015-11-13
李文宗,男,硕士,研究方向:植物分子生物学与基因工程;E-mail:lwzm1010@163.com
王磊,男,博士,研究员,研究方向:植物分子生物学与基因工程;E-mail: wanglei01@caas.cn

