三种不同方法提取葵花油的性质比较
覃建龙,李 杨,2,齐宝坤,张巧智,隋晓楠,江连洲,2,*,孙梦琪
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
三种不同方法提取葵花油的性质比较
覃建龙1,李杨1,2,齐宝坤1,张巧智1,隋晓楠1,江连洲1,2,*,孙梦琪1
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
本文旨在研究不同提取方法(水酶法;溶剂法;冷榨法)对葵花油的脂肪酸组成、理化性质、酚类物质、生育酚含量、抗氧化活性和氧化稳定性的影响。采用了清除DPPH自由基、抑制β-胡萝卜素-亚油酸乳化体系褪色实验和清除ABTS+·阳离子方法评价葵花油的抗氧化活性,并通过等温DSC测定了三种葵花油的氧化稳定性。结果表明:提取方法对葵花油脂肪酸组成的影响不显著(p<0.05)。与溶剂法和水酶法相比,冷榨法葵花油表现出较优质的产品特性。溶剂法葵花油的总酚含量(TPC,0.29 mg/g)、邻苯二酚含量(ODC,0.45 mmol/kg)和总生育酚含量(TTC,1090.81 mg/kg)最高,并且具有最强的DPPH自由基(IC50,3.54 mg/mL)、ABTS+·阳离子清除能力(TEAC,652.33 μmol/L)以及最强的抑制β-胡萝卜素褪色能力(C%,45.93%)。不同提取方法对葵花油的氧化稳定性影响显著(p<0.05),氧化稳定性依次为:溶剂法>水酶法>冷榨法。
葵花油,不同提取方法,理化性质,抗氧化活性,氧化稳定性
葵花油因其含有丰富的多不饱和脂肪酸而被认为是一种营养健康的植物油脂。葵花油的亚油酸含量高达60%以上,对于降低胆固醇、预防心血管疾病具有良好的效果[1]。目前,植物油脂的提取方法主要有溶剂法和机械压榨法。溶剂法是利用固-液萃取原理[2-3],提取率高达95%~98%,饼粕干基中残油率<1%,但存在溶剂残留等问题,所残留的溶剂不仅危害人体的呼吸系统和神经中枢,而且造成环境污染[4-5]。并且,饼粕需要经过脱溶处理,提高了生产成本,导致蛋白变性,降低了蛋白的利用率[6]。机械压榨法中的冷榨法主要是采用物理方法,借助机械外力,将油脂从油料的子叶细胞中挤压出来[7]。冷榨法制油工艺简单,所需配套设备较少,所制得的油脂风味纯正,并且无需经过进一步的精炼,是一种环境友好型的制油技术。水酶法是近年来一种新兴的提油技术,其主要原理是以机械和酶解为手段降解植物细胞壁及油体蛋白,进而释放油脂。其最大的优势是提取油脂反应条件温和,油料蛋白变性率低,对于后续加工生产及利用都比较具备优势[8]。目前,对葵花油的研究主要集中在葵花油化学成分的分析、水酶法提取工艺的优化和水酶法采用不同生物酶对葵花油提取率和品质的影响,对于水酶法提取的葵花油与其他方法提取葵花油的抗氧化活性和氧化稳定性的研究较少[9-10]。
本实验旨在对水酶法提取葵花油、溶剂法浸提葵花油和冷榨法提取葵花油进行对比,测定其理化性质、脂肪酸组成、抗氧化物质含量、抗氧化活性以及氧化稳定性,以期为葵花油的工业化生产和质量控制提供理论参考和实验依据。
1 材料与方法
1.1材料与仪器
葵花籽产自吉林洮南;Protex 7L(2.4 AU/g)无锡杰能科生物工程有限公司;1.1-二苯基-2-苦肼基 DPPH、石油醚、没食子酸、乙醇、Tween40、二氧化锰、亚油酸、β-胡萝卜素、无水硫酸钠、硫代硫酸钠、酚酞、浓盐酸、浓硫酸、碘化钾、氯仿等上述所用试剂均为分析纯。
JE-502电子天平上海浦春计量仪器有限公司;电子分析天平梅特勒-托利多仪器(上海)有限公司;F2102型植物试样粉碎机天津泰斯特仪器有限公司;电热恒温水浴锅余姚市东方电工仪器厂;1600PC紫外-可见分光光度计上海美谱达仪器有限公司;Agillent 6890-5973气相色谱-质谱联用仪安捷伦科技有限公司。
1.2葵花油的制备方法
1.2.1溶剂法将25 g的葵花籽粉放入到索氏抽提器中,采用125 mL的石油醚进行回流抽提3 h后,用旋转蒸发仪回收石油醚,将所制备的葵花油转移至具盖的棕色细口瓶中,置于-20 ℃保存,以备后续实验。
1.2.2水酶法水酶法制备葵花油的步骤参照Dominguez等[11]制备葵花油的方法,将所制备的葵花油转移至具盖的棕色细口瓶中,置于-20 ℃保存,以备后续实验。
1.2.3冷榨法冷榨法葵花油采用德国贝尔斯顿家庭智能ZYJ902型冷榨机制取,然后在4500 r/min,4 ℃离心15 min除杂,所制得的葵花油转移至具盖的棕色细口瓶中,置于-20 ℃保存,以备后续实验。
1.3实验方法
1.3.1理化指标的测定色泽:参照GB/T 22460-2008 动植物油脂罗维朋比色法[12];酸价:参照AOCS Cd-63-2009方法[13];过氧化值:参照AOCS Cd 8b-90-2009方法[14];p-茴香胺值:参照AOCS Cd 18-90-2011方法[15];共轭二烯、共轭三烯:参照IUPAC(1979),II.D.23方法[16];磷脂含量测定:参照AOCS Ca 19-86-2009方法[17];生育酚:采用高效液相色谱测定[18];脂肪酸分析测定:采用气相色谱-质谱联用仪测定[19];总酚含量:参照Singleton,1965方法测定[20],以没食子酸记;邻苯二酚含量:参照Arranz,2008方法测定[21],以邻苯二酚记。
1.3.2抗氧化活性的测定
1.3.2.1清除DPPH自由基能力葵花油清除DPPH自由基能力,采用Siger等[22]的方法稍作改进。将葵花油稀释成浓度为0.1~8.0 mg/mL的乙醇溶液,并配制成浓度为0.05 mg/mL的DPPH乙醇溶液备用。将2 mL葵花油乙醇溶液快速加入到2 mL新鲜配制的DPPH乙醇溶液中,快速混匀置于暗处,室温下反应30 min后,在517 nm处测定其吸光值A,同时以无水乙醇作对照,记为A0。计算公式如下:
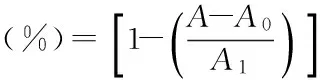
式(1)
式中:A,2.0 mL葵花籽油乙醇溶液(0.1~8.0 mg/mL)与2.0 mL无水乙醇溶液在室温反应后517 nm处的吸光值;A1,2.0 mL DPPH乙醇溶液与2.0 mL无水乙醇混合液在517 nm处的吸光值。
1.3.2.2β-胡萝卜素-亚油酸乳化体系法葵花油抑制β-胡萝卜素褪色实验采用Miraliakbari等[23]的方法并略有改动。取3 mL浓度为5 mg/10 mL的β-胡萝卜素氯仿溶液转移到蒸发瓶中,用旋转蒸发器在低于40 ℃的温度条件下将氯仿挥发掉;然后,加入100 mL的蒸馏水,40 mg亚油酸,400 mg的Tween40,混合形成β-胡萝卜素-亚油酸乳化体系;接下来,分别取4.8 mL的上述乳状液与200 μL油样混匀(对照组以甲醇代替油样,空白组为无β-胡萝卜素的乳状液)在50 ℃水浴中保温反应,每隔10 min在470 nm波长处测定吸光值,直至120 min。计算公式如下:
式(2)
其中:A0 Sample、A0 Blank、A0 Control为初始样品、空白组和对照组的吸光值,At Sample、At Blank、At Control为任意时刻样品、空白组和对照组的吸光值。
1.3.2.3清除ABTS+·阳离子能力葵花油清除自由基ABTS+·阳离子能力采用Berg等[24]的方法。将5mmol/LABTS溶液和1g二氧化锰混合,在室温、避光条件下反应30min,形成ABTS+·储备液,使用前用无水乙醇稀释成工作液,使其在734nm波长下的吸光值为0.7±0.02。葵花油用7%的β-环糊精丙酮(50%)溶液稀释,制得实验样品。取80μL的上述制得的实验样品与1.0mL的ABTS+·工作液混匀(对照组为添加80μLβ-环糊精),室温下避光反应1min后,在734nm波长处测定吸光值。结果根据Trolox标准曲线计算,用Trolox当量(TEAC)表示。
1.3.3氧化稳定性的测定采用Q100型差示扫描量热仪(DSC,differentialscanningcalorimetry)分别测定三种不同方法提取的葵花油在110、120、130、140 ℃时的氧化诱导时间(IP,Inductionperiod)。测定条件参考Arain等[25]的方法:样品用量为5.0±0.25mg,氧气(纯度为99.8%)流量为50mL/min。
1.4统计分析方法
所有实验至少进行3次,结果以“平均值±标准偏差”表示,实验数据用SPSSStatistics19软件进行统计分析,采用ANOVA检验进行差异显著性分析。
2 结果与讨论
2.1三种葵花油的脂肪酸组成
三种葵花油的提油率和脂肪酸组成见表1。三种提取方法的提油率存在显著差异(p<0.05),溶剂法的提油率最高,其次为冷榨法,水酶法最低。由表1可知,葵花油中的不饱和脂肪酸在86%以上,其中油酸和亚油酸分别在30%和55%左右。多不饱和脂肪酸是不同提取方法葵花油的主要组成,这是由于葵花油具有较高的亚油酸含量,而饱和脂肪酸仅占12%左右(表1)。结果表明,提取方法对葵花油的脂肪酸组成没有显著影响,这与Gharibzahedi等[26]的研究结果一致。
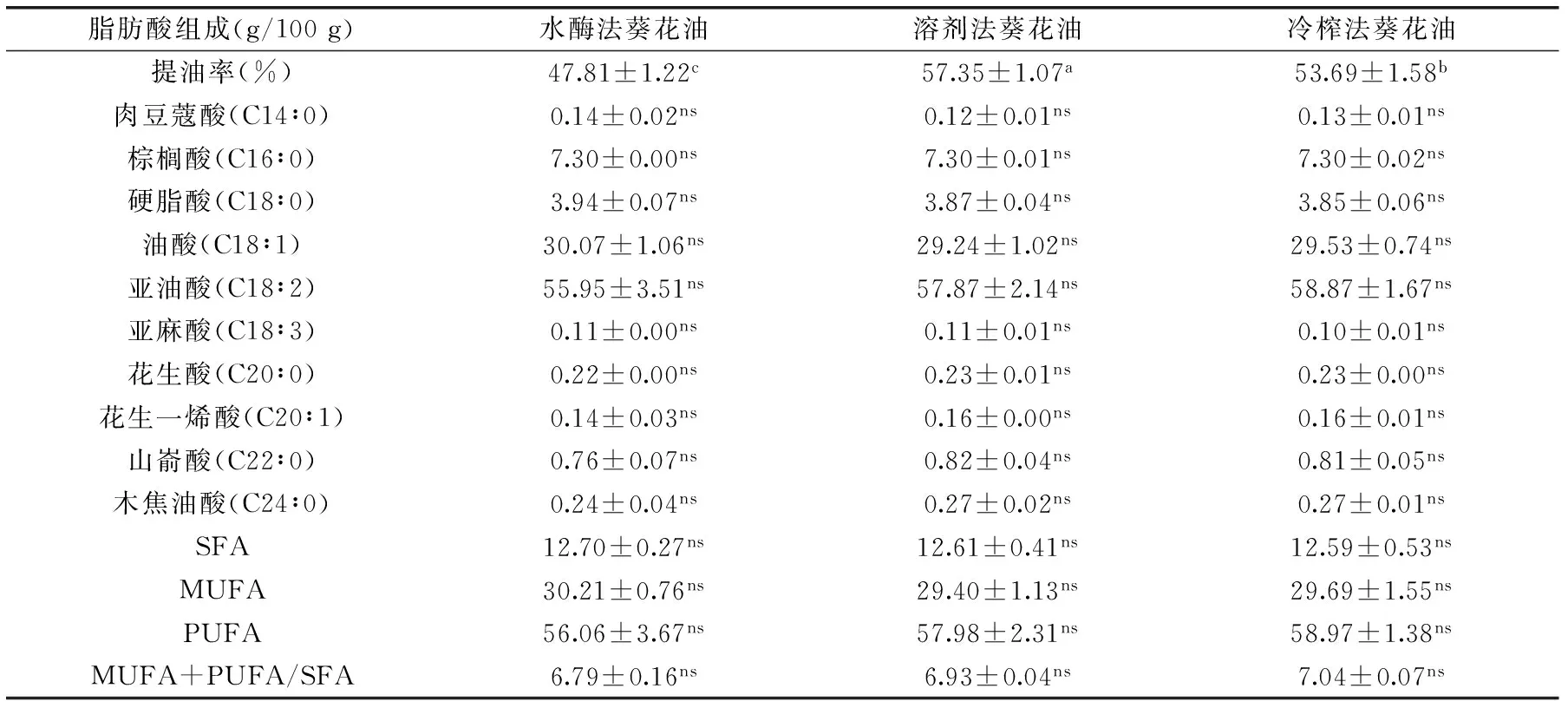
表1 不同提取方法对葵花油脂肪酸组成的影响Table 1 Effect of different extraction methods on the fatty acid composition of sunflower oils
注:a-c代表不同提取方法葵花油脂肪酸组成的差异显著性p<0.05;ns代表差异不显著。
2.2三种葵花油的理化性质
三种葵花油的部分理化性质见表2。由表2可知,水酶法葵花油颜色最浅,冷榨法葵花油次之,溶剂法葵花油颜色最深。溶剂法葵花油颜色最深,其一可能是由于有机溶剂将部分脂溶性色素浸提出来,导致油脂的颜色加深;其二,在采用有机溶剂浸提葵花油时,较高的浸提温度使得物料中的蛋白质和糖类物质发生美拉德反应,导致油脂颜色变暗。比较三种葵花油的密度,不存在显著差异(p<0.05)。三种葵花油的折光系数大小依次为冷榨法葵花油>溶剂法葵花油>水酶法葵花油。折光系数的大小与油脂的不饱和程度有关,油脂不饱和程度越高,折光系数越大,这与三种葵花油的脂肪酸组成分析结果一致(见表1)。三种葵花油,溶剂法葵花油的密度最小,其次为冷榨法葵花油,水酶法葵花油的密度最大,这可能与溶剂法葵花油中的溶剂残留有关。
由表2可以看出,三种葵花油的酸价存在显著差异(p<0.05)。酸价的大小与油脂中游离脂肪酸含量的高低有关,酸价越大,游离脂肪酸的含量越高。溶剂法葵花油酸价最高,水酶法葵花油居中,且显著高于冷榨法葵花油,这是由于水酶法葵花油未经过脱酸精炼工艺;而同样未经精炼的溶剂法葵花油的酸价是水酶法葵花油的9.6倍,这是由于水作为水酶法提油的反应介质溶解了一部分的游离脂肪酸[27],这与Robert等[28]的研究结果一致。过氧化值表征的是氢过氧化物的含量,用以评价脂质氧化的初级阶段。从表2可以看出,三种葵花油的过氧化值差异显著(p<0.05)。溶剂法葵花油的过氧化值最高,其次是水酶法葵花油,冷榨法葵花油最低,其主要原因是溶剂法葵花油的制备过程温度较高、时间较长,而水酶法制油工艺温度较低、条件温和,并且水酶法葵花油的部分油脂是以油滴的形式存在于O/W的乳状液中,阻止了空气与油脂的直接接触,同时酶解过程中所产生的低分子蛋白作为抗氧化物质,降低了水酶法葵花油的氧化速率[29]。p-茴香胺值表征的是氢过氧化物降解产生的次级氧化产物(醛、酮、酸等)的含量,用以评价脂质氧化的次级阶段。

表2 不同提取方法葵花油的部分理化性质Table 2 Some of physicochemical quality parameters of sunflower oils from different extraction methods
注:a-c代表不同提取方法葵花油理化指标间的差异显著性p<0.05。
从表2中可以看出,三种葵花油的p-茴香胺值存在显著差异(p<0.05),水酶法葵花油的p-茴香胺值最高(4.65±0.36),溶剂法葵花油居中(2.56±0.17),冷榨法葵花油最低(1.55±0.09)。溶剂法葵花油的K232和K270值高于水酶法葵花油和冷榨法葵花油,表明溶剂法葵花油的氧化程度较高。
三种提取方法所制得的葵花油的总酚(TPC)、邻苯二酚(ODC)和生育酚(VE)的含量见表2。其中,溶剂法葵花油的TPC和ODC含量最高,水酶法葵花油居中,冷榨法葵花油最低。高效液相色谱的结果表明,溶剂法葵花油含有最高的α-生育酚和γ-生育酚(826.14、250.41 mg/kg),其次是水酶法葵花油(679.44、219.10 mg/kg),冷榨法葵花油最低(618.94、217.74 mg/kg)。
2.3三种葵花油的抗氧化活性
DPPH是一种稳定的以氮为中心的自由基,在无水乙醇中呈现紫色,当加入具有自由基清除能力的物质后,溶液颜色变浅、吸光度降低,从而间接地反映出油脂中活性物质的抗氧化能力。一般以清除率为50%时所需要的样品浓度(IC50)来表示物质的抗氧化能力,IC50越大,表明该物质的抗氧化能力越低。三种葵花油清除DPPH自由基的能力见图1a。溶剂法葵花油具有最强的清除DPPH自由基能力(IC50,3.54 mg/mL),水酶法葵花油次之(IC50,4.76 mg/mL),冷榨法葵花油最低(IC50,7.17 mg/mL)。这与成文虎等[30]的研究结果一致。
脂溶性抗氧化剂的抗氧化活性常常采用抑制β-胡萝卜素-亚油酸乳化体系的褪色实验来评价,因此可以将其应用在评价葵花油的抗氧化活性中。在50 ℃的恒温水浴锅中,乳化体系中的亚油酸氧化形成氢过氧化物,而作为一种自由基攻击β-胡萝卜素的双键结构,从而导致乳化体系褪色。Jayaprakasha 等[31]人研究发现存在于核桃油中的抗氧化物质具有猝灭乳化体系中氢过氧化物的能力。因此,乳化体系的褪色速率取决于油脂中的抗氧化物质的含量和活性。β-胡萝卜素的剩余率见图1b。结果表明,溶剂法葵花油具有最高的抗氧化活性(C%,45.93%),水酶法葵花油居中(C%,34.50%),冷榨法葵花油最低(C%,28.08%)。
不同提取方法葵花油的TEAC见图1c,并且差异显著(p<0.05)。溶剂法葵花油的TEAC最大(652.33 μmol/L),其次是水酶法葵花油(374.67 μmol/L),冷榨法葵花油最小(291.00 μmol/L)。由此可见,溶剂法葵花油清除ABTS+·阳离子的能力是冷榨法葵花油的2.3倍。
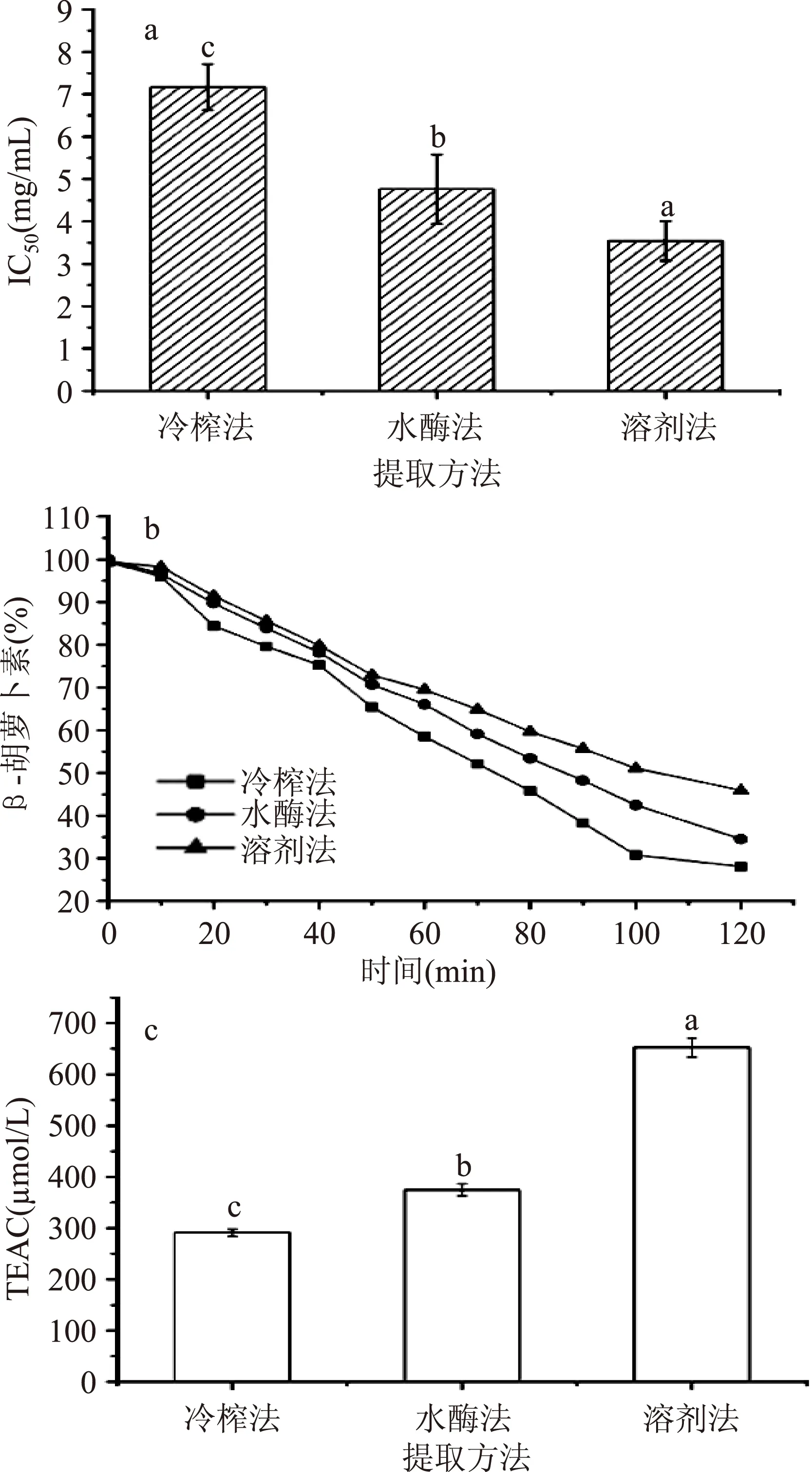
图1 不同提取方法葵花油(a)清除DPPH自由基的能力; (b)β-胡萝卜素的剩余率及 (c)Trolox抗氧化能力当量(TEAC)Fig.1 Antioxidant activities of sunflower oils from different extraction methods
2.4三种葵花油氧化稳定性
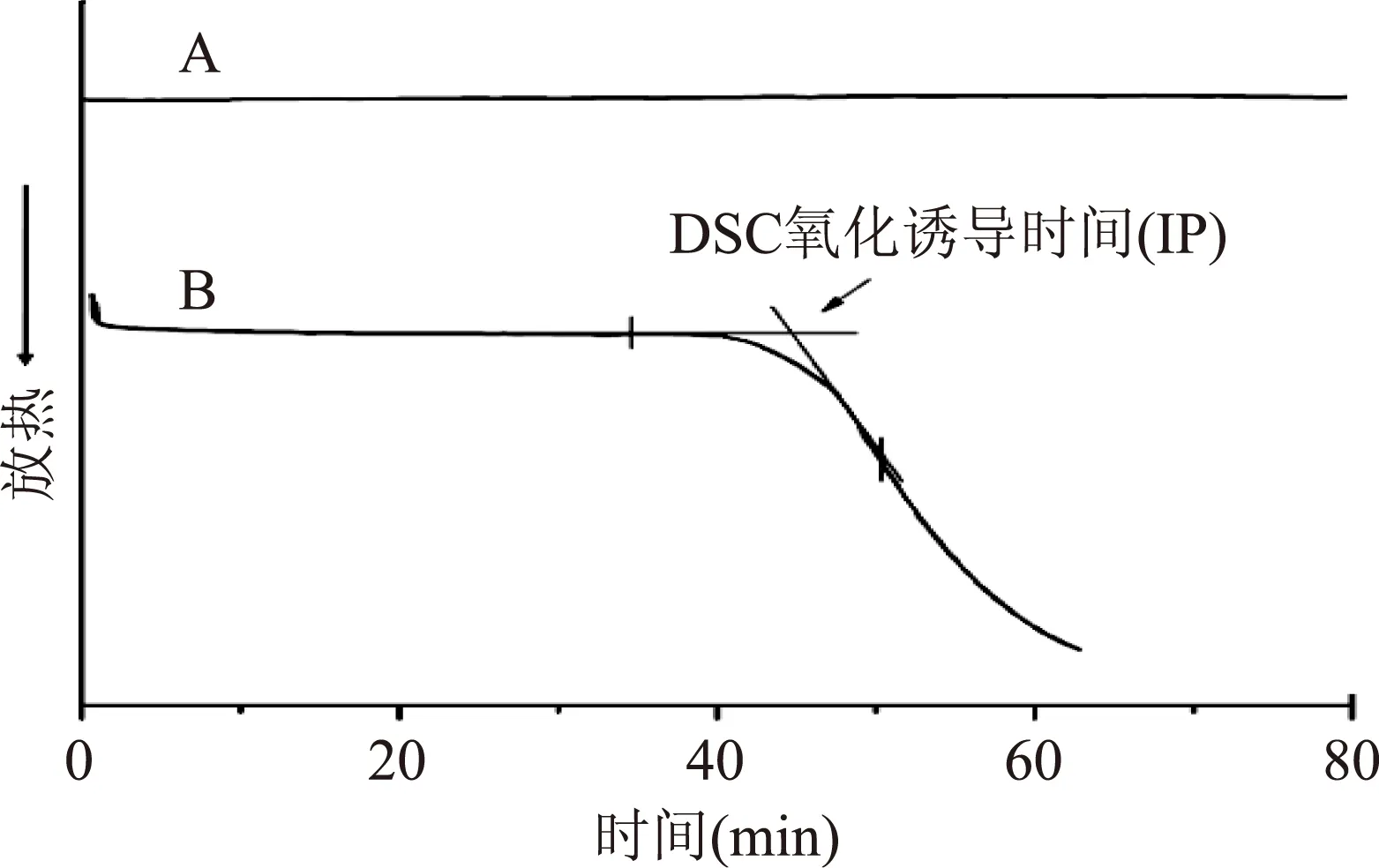
图2 溶剂法葵花油在130 ℃下的氧化放热曲线Fig.2 Differential scanning calorimetry oxidation curve of solvent extracted sunflower oil注:A:在氮气环境中(纯度为99.9%); B:在氧气环境中(纯度为99.8%)。
Tan[32]和Arain[25]等人研究发现,在评价油脂的氧化稳定性时,与传统的Rancimat 法相比,等温DSC不仅能准确地监测油脂的氧化稳定性,而且具有设备简单、耗时简短等优点。等温DSC法测定溶剂法葵花油在130 ℃时的氧化放热曲线见图2。由图2可知,在氮气环境中(图2A),没有放热峰,意即葵花油在氮气气氛中没有发生氧化反应;在氧气环境中(图2B),外推法得到的氧化诱导时间(IP)可以用来评价葵花油的氧化稳定性。等温DSC法分别测定在 110、120、130、140 ℃下葵花油的氧化诱导时间(IP),其结果见表3。由表3可知,不同方法提取葵花油的氧化稳定性存在较大差异(p<0.05),并且随着温度的升高,其氧化诱导时间(IP)显著缩短。三种葵花油的氧化稳定性大小依次为:溶剂法>水酶法>冷榨法,这可能与三种方法所提取的葵花油中抗氧化物质的含量与组分的不同有关。研究发现,油脂的脂肪酸组成、生育酚、酚类物质和非酚类物质(磷脂、甾醇和β-胡萝卜素等)的含量影响油脂的氧化稳定性[21]。由表2可以看出,三种葵花油的生育酚、总酚和邻苯二酚含量,溶剂法>水酶法>冷榨法,这与三种葵花油的氧化稳定性结果一致。
对三种葵花油的氧化诱导时间(IP)与测定温度进行回归分析,发现溶剂法葵花油氧化诱导时间(IP)与温度的方程为y=-4.681x+664.7,R2=0.9286;水酶法葵花油氧化诱导时间(IP)与温度的方程为y=-4.681x+664.7,R2=0.9286;冷榨法葵花油氧化诱导时间(IP)与温度的方程为 y=-3.7584x+529.63,R2=0.9507。
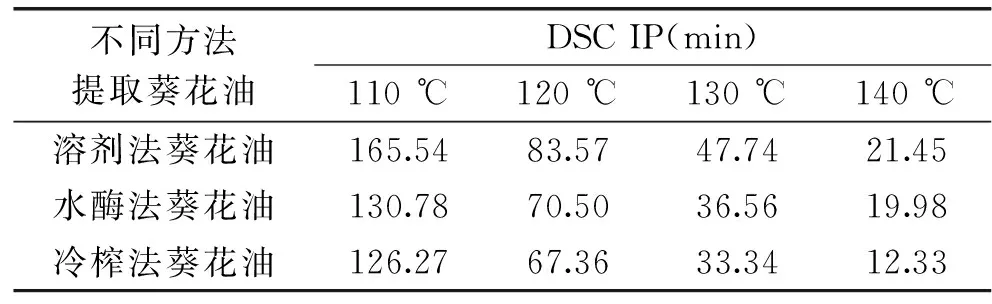
表3 不同提取方法葵花油DSC氧化诱导时间(IP)Table 3 Differential scanning calorimetry(DSC) oxidative induction period(IP)of sunflower oils from different extraction methods
3 结论
提取方法对葵花油的理化性质、抗氧化活性和氧化稳定性具有显著影响。其中,冷榨法葵花油表现出较优的产品特性,但是溶剂法提取葵花油的油脂得率、抗氧化活性物质的含量(总酚、邻苯二酚、总生育酚)最高,并且具有最强抗氧化活性,表明有机溶剂对抗氧活性物质具有较强的提取能力。不同方法提取葵花油的氧化稳定性,溶剂法最高,水酶法次之,冷榨法最低,并且三种葵花油的氧化诱导时间(IP)与温度呈现良好的线性关系。
[1]Upadhyay R,Mishra H N. Predictive modeling for shelf life estimation of sunflower oil blended with oleoresin rosemary(Rosmarinus officinalis L.)and ascorbyl palmitate at low and high temperatures[J]. LWT-Food Science and Technology,2015,60(1):42-49.
[2]胡淑珍,王振,李树君,等. 浸出制油技术研究进展[J]. 中国粮油学报,2009(11):153-157.
[3]张元生,张欢,马丽娜,等. 正戊烷浸出大豆油的工艺研究[J]. 粮油加工(电子版),2014(7):36-40.
[4]姜宁,曹继友,杨德田. 食用油脂中残留溶剂油的测定及对人体的危害性分析[J]. 中国初级卫生保健,1997,11(12):38.
[5]周伯川,刘世鹏. 先进科学的溶剂法浸出食用植物油精炼后可放心食用——对 “汽油浸炼食用大豆油大揭秘” 系列文章的几点看法[J]. 中国油脂,2002,27(1):4-6.
[6]dos Santos C R,Passarelli M M,de Souza Nascimento E. Evaluation of 2,5-hexanedione in urine of workers exposed to n-hexane in Brazilian shoe factories[J]. Journal of Chromatography B,2002,778(1):237-244.
[7]肖仁显,陈中海,陈秋平,等. 冷榨法、超临界CO2萃取法和有机溶剂浸出法提取山核桃油比较[J]. 食品科学,2012,(20):51-55.
[8]de Moura J M L N,Campbell K,Mahfuz A,et al. Enzyme-assisted aqueous extraction of oil and protein from soybeans and cream de-emulsification[J]. Journal of the American Oil Chemists’ Society,2008,85(10):985-995.
[9]Sineiro J,Domínguez H,Nunez M J,et al. Optimization of the enzymatic treatment during aqueous oil extraction from sunflower seeds[J]. Food Chemistry,1998,61(4):467-474.
[10]Latif S,Anwar F. Effect of aqueous enzymatic processes on sunflower oil quality[J]. Journal of the American Oil Chemists’ Society,2009,86(4):393-400.
[11]Dominguez H,Nunez M J,Lema J M. Oil extractability from enzymatically treated soybean and sunflower:range of operational variables[J]. Food Chemistry,1993,46(3):277-284.
[12]GB/T 22460—2008,动植物油脂罗维朋色泽的测定[S].
[13]American Oil Chemists’ Society(AOCS). Official Methods and Recommended practices of the American Oil Chemists’ Society,Cd-63,USA,2009.
[14]American Oil Chemists’ Society(AOCS). Official Methods and Recommended practices of the American Oil Chemists’ Society,Cd 8b-90,USA,2009.
[15]American Oil Chemists’ Society(AOCS). Official Methods and Recommended practices of the American Oil Chemists’ Society,Cd 18-90,USA,2011.
[16]IUPAC(1979). Standard methods for the analysis of oils and fats and derivatives Toronto,Canada:Pergamon Press.
[17]American Oil Chemists’ Society(AOCS). Official Methods and Recommended practices of the American Oil Chemists’ Society,Ca 19-86,USA,2009.
[18]Malheiro R,Sousa A,Casal S,et al. Cultivar effect on the phenolic composition and antioxidant potential of stoned table olives[J]. Food and Chemical Toxicology,2011,49(2):450-457.
[19]Li Y,Zhang Y,Sui X,et al. Ultrasound-assisted aqueous enzymatic extraction of oil from perilla(Perilla frutescens L.)seeds[J]. CyTA-Journal of Food,2014,12(1):16-21.
[20]Singleton V L,Rossi J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American journal of Enology and Viticulture,1965,16(3):144-158.
[21]Arranz S,Cert R,Pérez-Jiménez J,et al. Comparison between free radical scavenging capacity and oxidative stability of nut oils[J]. Food Chemistry,2008,110(4):985-990.
[22]Siger A,Nogala-Kalucka M,Lampart-Szczapa E. The content and antioxidant activity of phenolic compounds in cold-pressed plant oils[J]. Journal of Food Lipids,2008,15(2):137-149.
[23]Miraliakbari H,Shahidi F. Antioxidant activity of minor components of tree nut oils[J]. Food Chemistry,2008,111(2):421-427.
[24]van den Berg R,Haenen G R M M,van den Berg H,et al. Applicability of an improved Trolox equivalent antioxidant capacity(TEAC)assay for evaluation of antioxidant capacity measurements of mixtures[J]. Food Chemistry,1999,66(4):511-517.
[25]Arain S,Sherazi S T H,Bhanger M I,et al. Oxidative stability assessment of Bauhinia purpurea seed oil in comparison to two conventional vegetable oils by differential scanning calorimetry and Rancimat methods[J]. Thermochimica Acta,2009,484(1):1-3.
[26]Gharibzahedi S M T,Mousavi S M,Hamedi M,et al. Evaluation of physicochemical properties and antioxidant activities of Persian walnut oil obtained by several extraction methods[J]. Industrial Crops and Products,2013,45:133-140.
[27]杨辉,赵曼丽,范亚苇,等. 不同提取方法所得茶油的品质比较[J]. 食品工业科技,2012,33(11):267-269.
[28]Moreau R A,Johnston D B,Powell M J,et al. A comparison of commercial enzymes for the aqueous enzymatic extraction of corn oil from corn germ[J]. Journal of the American Oil Chemists’ Society,2004,81(11):1071-1075.
[29]吴海波,江连洲,程建军,等. 粗酶水解全脂豆粉提取油脂和蛋白[J]. 农业工程学报,2011,27(4):376-382.
[30]成文虎,马玉花,曹艳红,等. 新疆葵花籽油化学成分分析及抗氧化活性测定[J]. 新疆大学学报:自然科学版,2013(2):138-143.
[31]Jayaprakasha G K,Singh R P,Sakariah K K. Antioxidant activity of grape seed(Vitis vinifera)extracts on peroxidation modelsinvitro[J]. Food chemistry,2001,73(3):285-290.
[32]Tan C P,Man Y B C,Selamat J,et al. Comparative studies of oxidative stability of edible oils by differential scanning calorimetry and oxidative stability index methods[J]. Food Chemistry,2002,76(3):385-389.
Comparative research of the properties of sunflower oils obtained by three methods
QIN Jian-long1,LI Yang1,2,QI Bao-kun1,ZHANG Qiao-zhi1,SUI Xiao-nan1,JIANG Lian-zhou1,2,*,SUN Meng-qi1
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.National Research Centre of Soybean Engineering and Technology,Harbin 150030,China)
The aim of this study was to evaluate the effect of different extraction methods(aqueous enzymatic method,solvent extraction method,cold-press method)on the fatty acids,physicochemical characteristics,phenolic compounds,tocopherol content,antioxidant activities and oxidative stability of sunflower oils. Antioxidant activity of oil was measured by 1,1-diphenyl-2-picrylhydrazyl(DPPH)andβ-carotene bleaching assays and 2,2-azinobis(3-ethylbenzthiazoline sulfonate)(ABTS)radical scavenging capacity. And the differential scanning calorimetry(DSC)was applied for evaluating the oxidative stability of sunflower oils extracted by different methods. Results showed that fatty acid content was not influenced by extraction method(p<0.05). Cold-press method was found to be the best process for extracting oil with a favorable quality characteristics when compared to aqueous enzymatic method and solvent extraction method. Higher total phenolics content(TPC,0.29 mg/g),ortho-diphenol content(ODC,0.45 mmol/kg)and total tocopherol content(TTC,1090.81 mg/kg)and DPPH(IC50,3.54 mg/mL)and ABTS(TEAC,652.33 μmol/L)scavenging capacities andβ-carotene bleaching activity(C%,45.93%)were also obtained with solvent extraction method. Additionally,the effect of different extraction methods on the oxidation stability of sunflower oils was significant. The oxidative stability of solvent extracted sunflower oil was the greatest compared with those obtained other two extraction method.
sunflower oil;different extraction methods;physicochemical properties;antioxidant activities;oxidative stability
2015-06-25
覃建龙(1990-),男,硕士,研究方向:粮食、油脂及植物蛋白工程,E-mail:qjl19900607@126.com。
江连洲(1960-),男,博士,教授,研究方向:大豆蛋白、油脂及生理活性物质提取及精深加工技术研究,E-mail:jlzname@163.com。
国家自然科学基金青年科学基金项目(31301501);国家科技支撑计划课题(2014BAD22B00)。
TS225.6
A
1002-0306(2016)05-0120-06
10.13386/j.issn1002-0306.2016.05.015

