基于NMR纳米探针的生物传感器用于快速检测沙门氏菌
申 静,孟 雪,那美玲,徐晓丽,张錦胜
(南昌大学,江西南昌 330047)
基于NMR纳米探针的生物传感器用于快速检测沙门氏菌
申静,孟雪,那美玲,徐晓丽,张錦胜*
(南昌大学,江西南昌 330047)
通过将沙门氏菌单抗与羧基磁珠偶联制备免疫磁珠,并以此为NMR分子探针,以免疫磁珠为生物传感器,特异性地捕获并检测出样品中的致病菌,从而建立一种更快的检测沙门氏菌的方法。实验将得到的不同样品溶液放入核磁共振仪中检测自旋-自旋弛豫时间(T2)值,考察不同条件对T2值的影响。通过实验发现,免疫磁珠的使用量,缓冲溶液的选择,捕获时间的长短都会对样品T2值产生影响。通过优化实验,分别绘制出不同条件下T2值的曲线变化,并得出最佳捕获条件。在捕获缓冲溶液为磷酸盐缓冲溶液PBS(0.01 mol/L,pH7.4),免疫磁珠使用量为50 μg,混匀捕获时间为1.5 h的条件下,核磁共振仪测得的样品T2值曲线最佳。其检测线性范围为104~107CFU/mL。本研究为沙门氏菌的检测提供了新的方法和途径,缩短了检测时间和工序,并且为低场核磁共振技术研究应用开辟了广阔的空间。
免疫磁珠,沙门氏菌,核磁共振技术,快速检测
沙门氏菌(salmonella)是一类广泛分布于自然界的一种重要的人畜共患、革兰氏阴性病原菌。各类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。沙门氏菌具有致死率高的特征,为四大食源性致病菌之一,在各类食品标准中该致病菌都不得检出。目前对于沙门氏菌的检测方法主要有传统检测方法国标法[1],酶联免疫分析法(ELISA),荧光免疫分析法(FIA),免疫磁珠分离技术(IMS),核酸探针技术,聚合酶链式反应(PCR)等[2]。上述这些方法都具有各自的优缺点,但都少不了对检测样品的预处理,需要对检测菌进行增菌处理等,这些处理步骤耗时长,总操作步骤至少需要12 h。
核磁共振技术(Nuclear Magnetic Resonance,NMR)诞生于20世纪40年代。研究表明,不同组织之间、正常组织和病变组织之间水质子的弛豫时间信号存在差异。通过判别弛豫时间之间的差异,从而达到判断和鉴别。医学上研究表明,肿瘤及邻近的水肿区,由于肿瘤细胞的生长造成组织中结合水释放、游离水增加。自由水的分子较小,因而运动频率要比氢质子的共振频率高得多,这使得它有很长的T2值信号[3],因而在磁共振信号上表现出长T2信号,这也是磁共振疾病早期诊断的理论基础。在核磁共振成像的超顺磁造影剂中,因为纳米Fe3O4具有顺磁和超顺磁特性,能够显著影响磁场的净磁化矢量,因而改变组织的弛豫时间值。其Fe3O4磁性纳米粒子表面可连接生化活性功能基团,通过包被修饰特异性抗体使纳米磁珠成为免疫磁珠,用于免疫磁分离。磁分离被成功地用于研究副溶血弧菌[4-6],癌胚抗原[7],血吸虫[8],氯霉素[9],鼠疫杆菌[10],大肠杆菌O157∶H7[11-12],结核杆菌[13],志贺菌[14]等。
本研究结合NMR技术和生物传感器-免疫磁珠的优点,尝试建立一种基于磁性氧化铁纳米生物传感器的食源性致病菌的NMR快速检测方法,其特征是用Fe3O4纳米免疫磁珠对其致病菌特征性免疫捕获,再利用Fe3O4材料的超顺磁特性,从核磁共振弛豫信号参数变化的角度,对比空白样品的弛豫时间值变化,从而检测出样品中的有害致病菌。
1 材料与方法
1.1材料与仪器
沙门氏菌(菌株编号:ATCC9270,Salmonella)由南昌大学食品科学与技术国家重点实验室提供;沙门氏菌单克隆抗体(编号:2C11-F3)由南昌大学食品科学与技术国家重点实验室提供;羧基修饰磁珠(PM3-020)上海奥润微纳米材料科技有限公司;1-乙基-(3-二甲氨基丙基)碳酰二亚胺盐盐酸(EDC·HCl)上海晶纯生化科技股份有限公司;N-羟基硫代琥珀酰亚胺(NHSS)上海晶纯生化科技股份有限公司;牛血清蛋白(BSA)北京索莱宝科技有限公司;一水吗啉乙磺酸(MES)北京索莱宝科技有限公司等其他试剂。
磁力架无锡中德伯尔生物技术有限公司;1.5TCUTE NMR小型核磁共振仪宁波健信机械有限公司;核磁共振分析仪上海纽迈电子科技有限公司。
1.2实验方法
1.2.1羧基修饰磁珠分析检测在温度为25 ℃时,将终浓度为2 mg/mL的羧基磁珠在PBS缓冲液放置,运用激光粒度仪对羧基磁珠PM3-020进行粒径分析。
1.2.2免疫磁珠的制备活化:称取磁珠(奥润 10 mg/mL,180 nm,羧基表面摩尔密度150 nmol/L)1 mg,0.01 mol/L MES(0.01 mol/L,pH6.0)洗涤三次,重悬。加入NHSS 0.325 mg(与磁珠表面羧基密度摩尔比为10∶1),DEC·HCl 0.29 mg(与磁珠表面羧基密度摩尔比为10∶1),置于混匀仪上保持磁珠悬浮,室温活化1 h。偶联:磁力架回收磁珠,1 mL 0.01 mol/L PBS(0.01 mol/L,pH7.4)洗涤三次后,磁珠重悬于PBS中,加入160 μg单克隆抗体(抗体/磁珠=80 μg/mg),置于混匀仪上37 ℃偶联2 h。封闭:偶联后,产物加入终浓度1% BSA室温封闭45 min。保存:磁力架回收磁珠,PBS洗涤三次,1 mL PBS重悬免疫磁珠至终浓度为1 mg/mL,4 ℃冰箱保存备用。
1.2.3免疫磁珠的最佳捕获条件优化
1.2.3.1捕获缓冲液分别用以下四种缓冲液:0.01 mol/L磷酸盐缓冲液(PBS,pH7.4)、0.01 mol/L磷酸盐吐温缓冲液(PBST,pH7.4,0.05% Tween-20)、0.01 mol/L一水吗啉乙磺酸溶液(MES,pH6.0)、0.04 mol/L硼酸盐溶液(BS,pH9.0)构成反应体系,用无菌缓冲溶液梯度稀释菌液,稀释101、102、103、104、105、106倍。各取1 mL菌体不同稀释液分别加入到1~6号2 mL离心管中,7号加入无菌溶液,不添加稀释菌液作为对照组。1~7号离心管中分别加入沙门氏菌单克隆抗体制备的免疫磁珠0.1 mg。每种缓冲液设置3个平行样。反应溶液置于混匀仪上37 ℃,孵育1.5 h,转速为12 r/min。最后,将捕获后的溶液取300 μL加入到核磁共振管,进行核磁共振测定T2值,每个样品测3次。
1.2.3.2捕获时间分别用以上四种不同的无菌缓冲溶液梯度稀释菌液6次。各取1 mL菌体不同稀释液分别加入到1~6号2 mL离心管中,7号加入无菌溶液,不添加稀释菌液作为对照组。1~7号离心管中分别加入沙门氏菌单克隆抗体制备的免疫磁珠0.1 mg。每种缓冲液设置3个平行样。反应溶液置于混匀仪上37 ℃,分别孵育0.5、1.0、1.5、2.0 h,转速为12 r/min。最后,将捕获后的溶液取300 μL加入到核磁共振管,进行核磁共振测定T2值,每个样品测3次。
1.2.3.3免疫磁珠使用量分别用以上四种不同的无菌缓冲溶液梯度稀释菌液6次。各取1 mL菌体稀释液加入到30个2 mL离心管,7个离心管为一组(其中1~6为菌体稀释样品,7号为无菌空白对照),共5组。1~5组离心管中分别加入沙门氏菌单克隆抗体制备的免疫磁珠25、40、50、60、100 μg。每个样品设置3个平行样。反应溶液置于混匀仪上37 ℃,孵育1.5 h,转速为12 r/min。最后,将捕获后的溶液取300 μL加入到核磁共振管,进行核磁共振测定T2值,每个样品测3次。
1.2.4沙门氏菌的微生物计数取用无菌溶液稀释106~107倍的含有沙门氏菌的溶液100 μL,LB琼脂平板计数检测,每个样品重复检测三次,所有的平板培养温度为(37±1) ℃,时间为18~24 h。通过平板计数法计算菌液的浓度,选择菌落数在20~200范围内的进行计数。
1.2.5NMR检测捕获后的免疫磁珠溶液取300 μL加入到核磁共振管中,选择合适的SE序列设定其参数,测定样品的弛豫时间(T2)。在实验中,测定免疫磁珠捕获不同浓度的菌液时发现,免疫磁珠与沙门氏菌进行免疫反应后,其磁珠上修饰的单抗被菌体封闭,无法与离心管进行物理吸附,只能残留在溶液中。所以当样品中的目的菌越多,就会有越多的免疫磁珠与之进行免疫反应,封闭的免疫磁珠越多,残留在溶液中的免疫磁珠越多,NMR测定的T2值越小,反之,目的菌越少,封闭的免疫磁珠越少,残留在溶液中的免疫磁珠越少,NMR测定的T2值越大。
2 结果与讨论
本研究的主要原理是设想将这NMR造影剂技术和免疫磁分离方面的研究结合起来,研究一种基于磁性氧化铁纳米生物传感器针对食源性致病菌的NMR快速检测方法,其特征是利用Fe3O4具有顺磁和超顺磁特性,对于共振仪器非常敏感,相对于其他分子而言,微量的Fe3O4能够大幅降低无菌的去离子水的自旋-自旋弛豫时间(T2),而无菌的缓冲溶液在一定的均匀场强下,T2是固定的。因而将待测样品与无菌的缓冲液对照组进行对照,在核磁共振信号上显示T2的下降幅度较大。通过对比从核磁共振弛豫信号参数变化的角度,检测出样品中的有害致病菌。
2.1羧基修饰磁珠分析检测
运用激光粒度仪对羧基磁珠PM3-020进行粒径分析。图1表明,在温度为25 ℃时,终浓度为2 mg/mL的羧基磁珠在PBS缓冲液下,其羧基磁珠的平均粒径为170.5 nm,分散指数(PDI)为0.061。实验数据表明,羧基磁珠PM3-020在PBS缓冲液中的分散性较好,并且其粒径分布比较均匀。
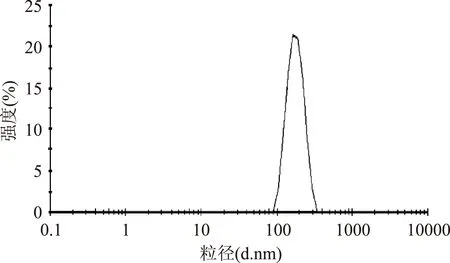
图1 羧基磁珠PM3-020的粒径分析Fig.1 Size distribution of carboxyl magnetic nanospheres (PM3-020)by intensity
2.2免疫磁珠的最佳捕获条件优化
2.2.1最佳捕获缓冲液不同缓冲溶液的捕获实验结果如图2所示。结果表明,除PBST以外的其他缓冲溶液中,等量免疫磁珠和样品,经过1.5 h的捕获混匀后,其T2值与样品中菌浓度呈现明显的曲线关系。随菌浓度越高,其T2值越小,反之菌浓度越低,其T2值越大,且T2最大值与无菌对照组的T2值持平,说明在此方法检测的最小浓度为104~105CFU/mL。在PBST缓冲溶液中,其T2值为平稳直线,并没有很大的波动,可能由于PBST是在PBS溶液中加入了0.05%Tween-20,而Tween-20为表面活性剂,导致剩余抗体与离心管壁难以实现物理吸附。从图2可以看出,PBS缓冲溶液下的T2值,相邻浓度之间的梯度差异性好,且曲线平滑。因此最佳的捕获缓冲溶液为PBS缓冲溶液(0.01 mol/L,pH7.4)。
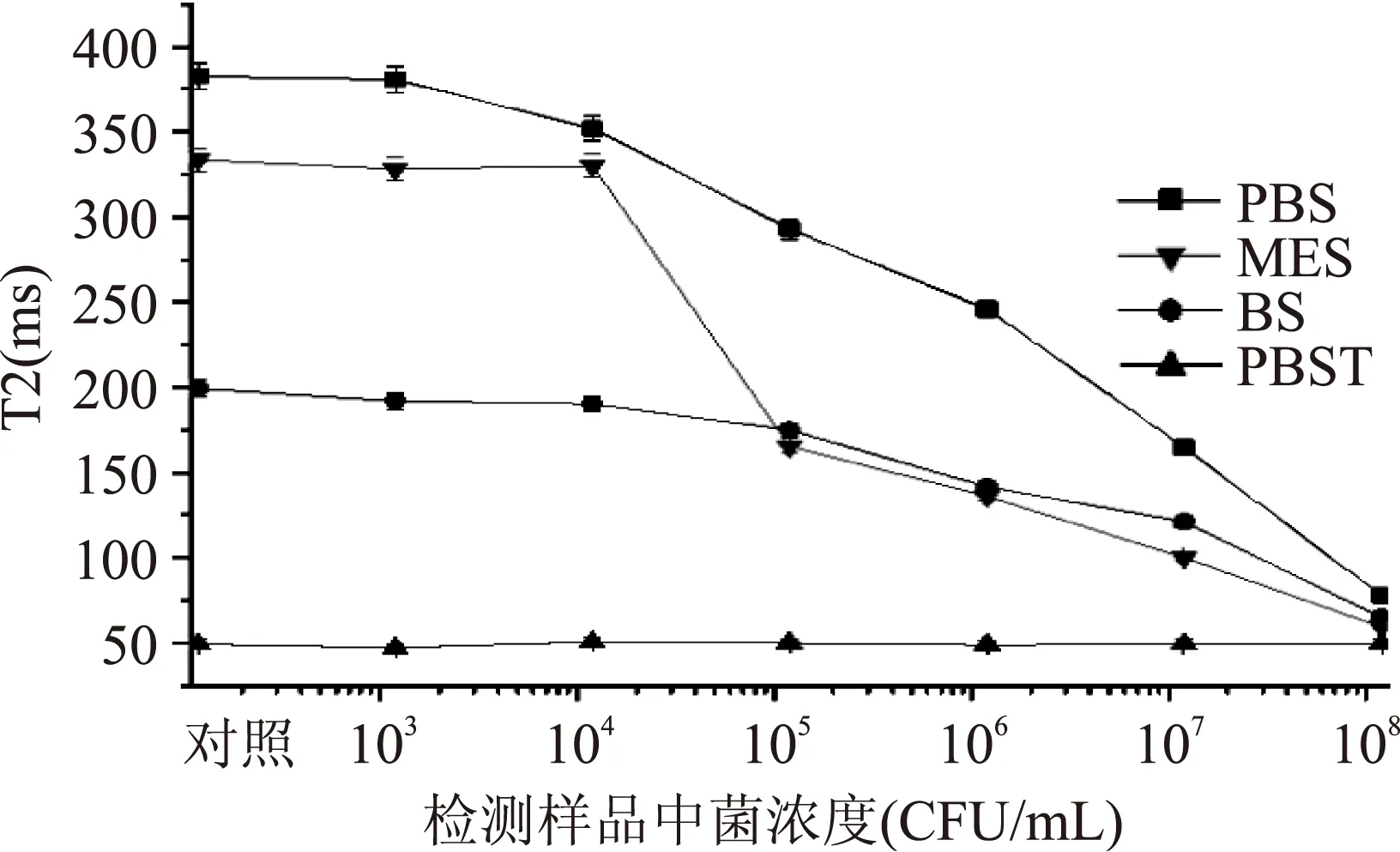
图2 不同的缓冲液对T2值的影响Fig.2 Effect of buffer solution on T2
2.2.2最佳捕获时间不同捕获时间的捕获溶液在NMR下,检测得到的T2结果如图3。捕获时间在0.5~1.0 h时,其T2值趋向平稳,没有波动趋势。在达到1.5 h后,T2值明显梯度增大,菌浓度越小,其值增长越大。样品溶液中菌浓度越大,其溶液T2值越大。当捕获时间为2.0 h后,其增长幅度最大。但是样品中菌浓度较低时的T2值已经达到400 ms以上,在检测过程中T2值越大,检测误差越大。因此选择1.5 h作为免疫磁珠与样品的捕获时间。
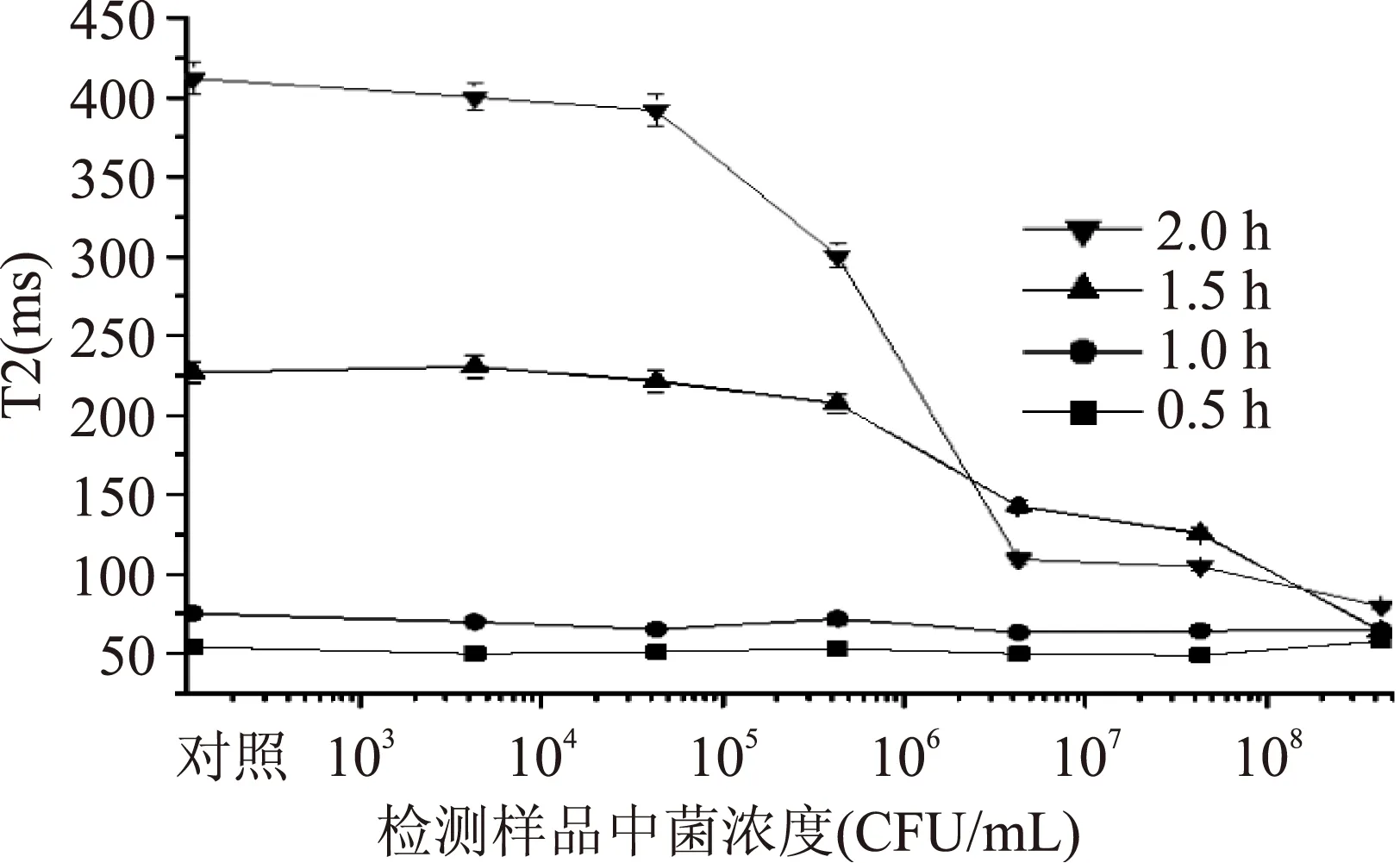
图3 不同捕获时间对T2值的影响Fig.3 Effect of capture time on T2
2.2.3最佳免疫磁珠使用量将不同量的免疫磁珠分别与浓度梯度样品反应,其T2值如图4。当免疫磁珠量为100 μg时,其T2值在60 ms上下浮动,呈平缓趋势。而25~60 μg时,其T2与菌浓度有着明显的曲线关系。考虑T2值大于400 ms时,会增大其系统误差,所以最佳的免疫磁珠使用量为50 μg。
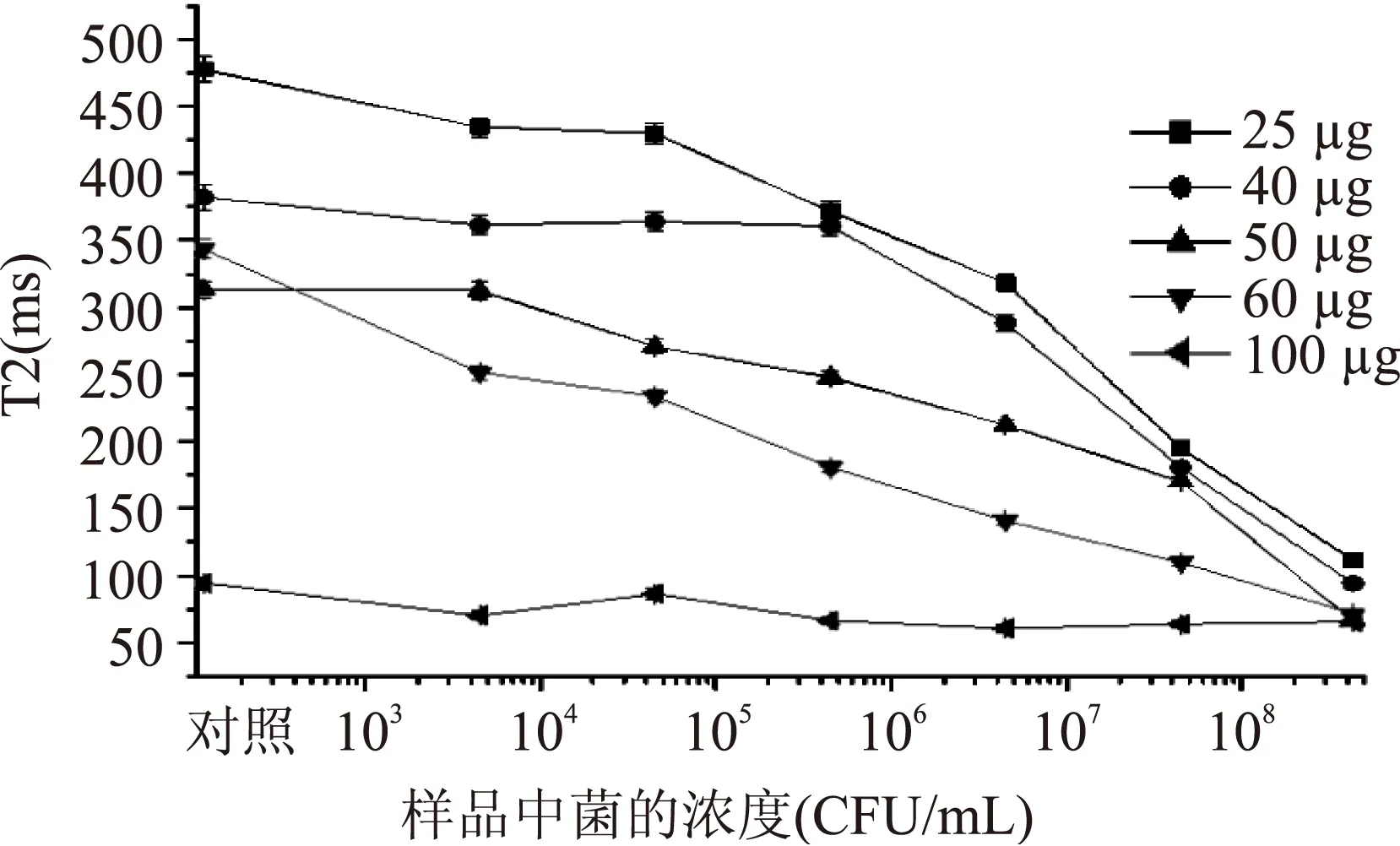
图4 不同免疫磁珠使用量对T2值的影响Fig.4 Effect of immunomagnetic beads usage on T2
3 结论
本研究通过将微生物技术与核磁共振技术相结合,以沙门氏菌为模型,建立一种全新的基于Fe3O4纳米粒子的食源性致病菌NMR快速检测方法。利用Fe3O4的顺磁特性和超顺磁特性对核磁共振的弛豫时间参数的影响,与无菌对照组比较,检测出食品样本中是否含有目标致病菌,并在一定范围定量检测目标菌。本次研究表明,通过不断优化实验反应条件,最终使得核磁共振检测T2值与目标菌的浓度呈现明显,光滑的曲线关系。研究得出:在PBS缓冲液(0.01 mol/L,pH7.4)中,免疫磁珠与抗体特异性结合能力最强。同时,免疫磁珠捕获时间达到1.5 h时,T2值与目标菌的浓度曲线关系明显。当免疫磁珠使用量为50 μg时,T2值与菌浓度的曲线关系最为明显。
通过该方法,在实验用于检测的时间只有10 min。整个准备实验也不超过2 h。与其他的检测方法的检测所需时间12 h相比,此方法提高了食品样本中有害致病菌的快速检测时间,可作为大批待检样品的快速筛选,为致病菌的快速检测提供了新的途径。
[1]GB 4789.4-2010,食品安全国家标准食品微生物学检验[S]:沙门氏菌检验.中华人民共和国国家标准.
[2]孙园园,赵鹏,刘骏,等. 沙门氏菌检测方法研究进展[J]. 中国畜牧兽医,2011,38(1):218-221.
[3]赵喜平.核磁共振成像[M].北京:科学出版社,2004年,72-73.
[4]Morteza Mahmoudi,Shilpa Sant,Ben Wang,et al. Tapas Sen Superparamagnetic iron oxide nanoparticles(SPIONs):Development,surface modification and applications in chemotherapy[J]. Advanced Drug Delivery Reviews,2011,63(1-2):24-46.
[5]S Datta,M E Janes,J G Simonson. Immunomagnetic Separation and Coagglutination of Vibrio parahaemolyticus with Anti-Flagellar Protein Monoclonal Antibody[J]. clinical and vaccine immunology,2008,Oct:1541-1546.
[6]苏晨曦,孙晓红,卢瑛,等. 副溶血性弧菌免疫磁珠的制备及其应用.[J]食品工业科技,2012,33(17):313-316.
[7]Jing-Yuan Hou,Tian-Cai Liu,Guan-Feng Lin,et al. Development of an immunomagnetic bead-based time-resolved fluorescence immunoassay for rapid determination of levels of carcinoembryonic antigen in human serum[J].Analytica Chimica Acta,2012,734(13):93-98.
[8]Jia-hui Lei,Fei Guan,Hong Xu,et al. Application of an immunomagnetic bead ELISA based on IgY for detection of circulating antigen in urine of mice infected with Schistosoma japonicum[J].Veterinary Parasitology,2012,187(1-2):196-202.
[9]Jing Xu,Weiwei Yin,Yuanyang Zhang,et al. Rimo Xi Establishment of magnetic beads-based enzyme immunoassay for detection of chloramphenicol in milk[J].Food Chemistry,2012,134(4):2526-2531.
[10]Cecilia SM Lucero Estrada,Lidia del Carmen Velázquez,Gabriela Isabel Favier,et al. Detection of Yersinia spp in meat products by enrichment culture,immunomagnetic separation and nested PCR[J]. Food Microbiology,2012,30(1):157-163.
[11]Luxin Wang,Chung-Shieh Wu,Xudong Fan,et al. Detection of Escherichia coli O157∶H7 and Salmonella in ground beef by a bead-free quantum dot-facilitated isolation method[J]. International Journal of Food Microbiology,2012,156(1):83-87.
[12]李梦,韩国成,刘又年.用于分离大肠杆菌O157∶H7的免疫磁珠的制备与表征[J].应用化工,2012,6:1044-1047.
[13]Satoshi Mitarai,Ryouji Karinaga,Hiroyuki Yamada,et al . a novel bead-based specimen concentration method for the culturing of Mycobacterium tuberculosis[J].Journal of Microbiological Methods,2012,90(3):152-155.
[14]盛跃颖,陈洪友,张曦,等.免疫磁珠捕获法检测志贺菌的模拟研究[J].检验医学,2012,27(3):167-169.
[15]徐金亭,李志清,向军检,等.单增李斯特菌免疫磁珠的制备研究[J]. 食品工业科技,2012,33(5):323-327.
Biological sensors based on nano magnetic beads applied in rapid detection ofsalmonella
SHEN Jing,MENG Xue,NA Mei-ling,XU Xiao-li,ZHANG Jing-sheng*
(Nanchang University,Nan Chang 330047,China)
By couplingsalmonellamonoclonal antibody with carboxyl magnetic beads,immunomagnetic beads were produced,which were used as NMR molecular probes and biological sensors,pathogenic bacteria specially captured and detected in the samples so as to create a more rapid method to detectsalmonella. Different sample solutions were put into the nuclear magnetic resonance apparatus to detect the spin relaxation time(T2)and examine the influence of different conditions to the value of T2. The experiment found that the sample value of T2 was influenced by the volume of immunomagnetic beads,the choice of buffer solution and the time of capturing. Through optimization experiment,curve variations T2 under different conditions were drawn with a result of ideal capturing conditions. Under the conditions that the capturing buffer solution was phosphate buffer solution(PBS)(0.01 mol/L,pH7.4),the volume of immunomagnetic beads was 50 μg and the blending capturing time was 1.5 h,the curve of the sample value of T2 was perfect,detection linear range being 104~107CFU/mL. A new method and approach was provided by this research,which was helpful to shorten the detection time and process and opened an immense space for the study of low field nuclear magnetic resonance.
immunomagnetic beads;salmonella;nuclear magnetic resonance;rapid detection
2015-03-12
申静(1989-),男,硕士研究生,研究方向:食品加工与安全,E-mail:student1124sj@163.com。
张锦胜(1971-),男,博士,副教授,研究方向:食品加工与安全,E-mail:zjsmcl@163.com。
江西省科技支撑计划项目(20151BBG70049)。
TS201.3
A
1002-0306(2016)05-0187-04
10.13386/j.issn1002-0306.2016.05.028

