代谢组学在发酵食品有毒代谢产物分析中的研究进展
缪璐欢,杜静芳,白凤翎,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
代谢组学在发酵食品有毒代谢产物分析中的研究进展
缪璐欢,杜静芳,白凤翎*,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
食品发酵过程中可形成一些有毒代谢产物,对发酵食品产生了一定的安全隐患。代谢组学作为一门新兴技术,可对生物代谢过程中产生的小分子代谢产物实现实时分析与监测。应用气相色谱-质谱联用、离子色谱、反相高效液相色谱、高效液相色谱结合串联质谱、液相色谱-电喷雾电离飞行时间质谱等代谢组学技术分析酒饮料、葡萄酒、奶酪、香肠、酱油等食品中的有毒代谢产物,可实时监测食品发酵过程中的氨基甲酸乙酯、生物胺和亚硝酸盐的形成与变化状况,为提高发酵食品的安全控制水平和推动代谢组学在发酵食品领域的应用提供借鉴与参考。
代谢组学,发酵食品,有毒代谢物,分析
代谢组学(Metabolomics)在“组学”领域是一门新兴学科,仿效基因组学、转录组学和蛋白组学的研究思想,对机体、组织、细胞等代谢过程形成的分子量低于1500 ku或1000 ku的小分子代谢产物进行同步检测和定性分析[1-2]。代谢产物包括内源性和外源性小分子物质,主要有肽类、氨基酸、核酸、简单糖类、有机酸、维生素、多酚和生物碱等,这些产物更加直接地展现机体的代谢过程[3]。
代谢组学研究流程包括样品制备、数据采集和数据分析及解释,通过现代各种高新技术对代谢物进行分离、检测和定性定量分析,将收集的信息整合在一起。代谢轮廓分析(靶向代谢组学)和代谢指纹分析(非靶向代谢组学)是应用于代谢组学的两种互补分析方法,前者通常验证事先提出的假设,研究与特定代谢途径相关的代谢物的变化,后者对样品进行整体性定性分析,根据图谱差异对代谢产物进行快速鉴别和分类[4-6]。
代谢组学已广泛应用于微生物学[7]、植物生理学[8]、医学[9]、药物学[10]、动物学[11]等研究领域。在发酵食品领域,代谢组学主要对发酵过程的物质变化进行监控和对风味物质进行分析等。Kang等应用超高效液相色谱-高分辨飞行时间质谱(ultra performance liquid chromatography-high resolution time of flight mass spectrometer,UPLC-TOFMS)技术,对韩国豆酱发酵过程进行监控,通过偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)获得了豆酱发酵过程中与产品成熟相关的22种标志性代谢产物[12]。Lee等[13]通过核磁共振(nuclear magnetic resonance,NMR)技术研究不同国家绿茶发酵过程中的风味物质变化情况,发现风味物质形成与环境因素息息相关,为发酵茶的生产提供重要的参考信息。
传统发酵食品因特定微生物发酵而具有独特的风味、口感和较高的营养价值,深受各国人们的青睐。由于发酵基质成分复杂,参与的微生物类群和代谢途径多样,发酵食品中富含各种各样的代谢产物,这些产物中也可能是对人类有毒有害的代谢物质。随着发酵食品产业的快速发展,发酵食品安全问题的研究越来越受到人们的重视。目前,对发酵食品中有毒代谢产物只停留在对产品检验的阶段,尚不能实现对发酵过程的实时监控。代谢组学的引入必将对发酵食品的安全控制产生深远的影响。
本文从代谢组学的角度出发,对传统发酵食品中有毒代谢产物如氨基甲酸乙酯、生物胺和亚硝酸盐的分析检测应用研究进行综述,为保障发酵食品安全提供借鉴与参考。
1 代谢组学研究方法及其在发酵食品中的应用1.1 样品的采集和制备
样品的采集与制备是代谢组学研究的基础,需经过严格的实验设计,以达到代谢组学所要求的分析精度。样本采集要有足够的数量且需具有代表性,有效减少样品个体差异对结果的影响[14]。根据研究对象、目的和分析技术不同,样品的制备过程明显不同。对于非靶向代谢组学分析,需最大程度地获取代谢产物的数量,要求样品预处理方法具有普适性与无偏性。而对于靶向代谢组学分析,对代谢物提取效率和选择性的要求会进一步提高[15]。
传统发酵食品中各种微生物共栖生长,赋予食品复杂而完整的酶系,为避免酶活性残留或氧化还原过程降解代谢产物或产生新的代谢产物,因此,样品制备后通常对不同发酵时期的样品进行淬灭处理,采用-80 ℃低温、液氮等方式保存备用[16]。针对提取效率低的问题,一般选择不同比例的水和有机溶剂(如甲醇、己烷等)进行提取。Lee等采用异丙醇、乙腈和水(3∶2∶2)的混合物对冷冻干燥的发酵豆瓣酱样品进行提取,分析发酵过程中的初级代谢产物变化,取得了较好的效果[17]。
1.2检测技术
经采集和制备的样品,通过合适的方法分析其中的代谢产物。因代谢产物组成复杂、含量差异和样品制备过程的偏差等问题,目前尚无一种能够提取和检测所有代谢产物的分析方法。核磁共振(NMR)和质谱(mass spectrometry,MS)是代谢组学广泛应用的主要分析技术之一[18]。
1.2.1核磁共振(NMR)NMR是代谢组学研究的主要分析技术,其优势在于样品不需要繁琐的前处理,能够对样品实现非破坏性、无偏向的检测,具有良好的重现性和客观性,还具有高通量和较低成本的优势[19-20]。核磁共振谱包括氢谱(1H-NMR)、碳谱(13C-NMR)、氮谱(15N-NMR)和磷谱(31P-NMR),其中以1H-NMR 应用最为广泛。Papotti等以1H-NMR技术为基础,结合多变量分析,在意大利香醋和传统香醋的特征描述和质量控制的研究中取得良好的效果[21]。Jeong等研究韩国泡菜在自然发酵过程中的细菌菌相和代谢产物之间的关系,利用1H-NMR技术分析表明游离糖、丙三醇和乙醇可作为发酵时间和质量控制的指示物[22]。
1.2.2质谱分析法(MS)与NMR技术相比,MS具有较高的灵敏度和特异性,可实现对代谢物的定性和定量分析[23]。通常MS和气相色谱(gas chromatogram,GC)或液相色谱(liquid chromatogram,LC)技术联用分析各种小分子代谢产物[24]。针对非靶向代谢组学分析,样品先通过GC和LC处理后,再进入MS进行分析[25]。气相色谱-质谱联用(GC-MS)因具有较高的分离能力和良好的稳定性应用于代谢组学研究,一般用于分析氨基酸、游离脂肪酸和有机酸等初级代谢产物[26]。液相色谱-质谱联用(LC-MS)适合分析大量的次级代谢产物,包括生物碱、黄酮类、皂苷类、酚酸类和多胺类等[27]。Park等[28]应用GC-MS技术对传统发酵豆制品的不同发酵阶段进行靶向代谢组学分析,结果表明大多数氨基酸在早期发酵时期含量较低,到发酵后期有所升高,脂肪酸含量在整个发酵过程中保持升高的趋势,除了酒石酸外,其他有机酸含量一直呈现降低趋势。Fraser等[29]首次采用LC-MS和GC-MS联合技术对奶酪发酵过程中的水溶性和挥发性代谢产物进行非靶向代谢指纹分析,共鉴定出包括研究较少的维生素、尿酸、肌酸、L-肉碱等45种小分子代谢物。
1.2.3数据分析代谢组学的数据分析包括原始数据预处理和统计分析方法。原始数据预处理需要对原始数据进行滤噪、归一化、标度化、色谱峰对齐和数据转换等步骤,保留与组分相关的信息,消除多余干扰因素的影响,使其能够进行后期的数据分析[30]。多元统计方法是代谢组学数据分析的重要手段,主要分为非监督和监督方法,非监督方法包括主成分分析(principal component analysis,PCA)、自组织图(self-organizing map,SOM)和聚类分析(cluster analysis,CA)等。监督法包括最小二乘法(partial least squares,PLS)、显著性分析(discriminant analysis,DA)、偏最小二乘法-判别分析(PLS-DA)等[31]。Piras等[32]采用主成分分析法(PCA)处理NMR分析意大利奶酪代谢组学的研究数据,由成熟时间和发酵剂的类型对奶酪进行分类。
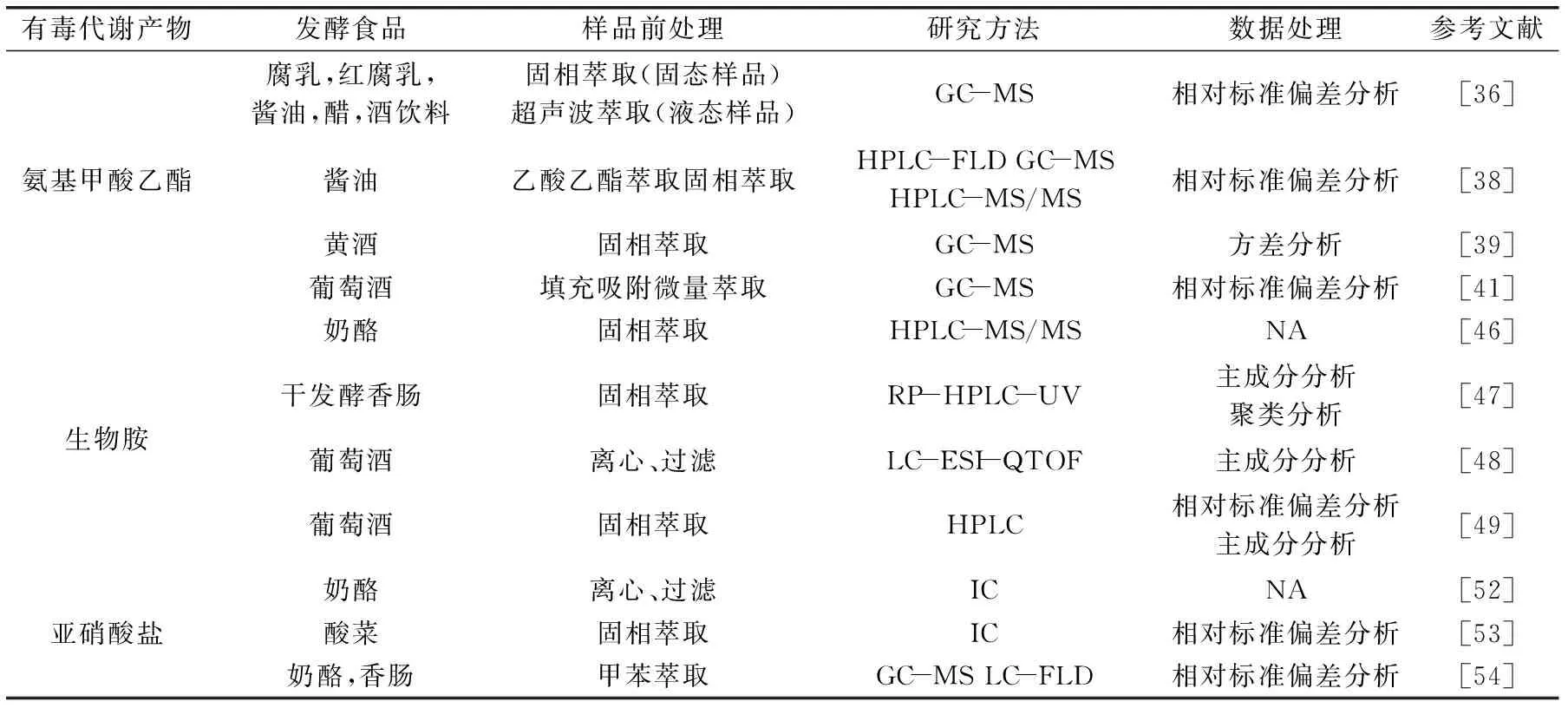
表1 代谢组学在发酵食品有毒代谢物分析中的应用Table 1 Application of metabolomics on analysis of toxic metabolite in fermented food
注:NA表示文献中未报道。
2 代谢组学在传统发酵食品有毒代谢产物的分析
总体看来,大多数以传统的天然发酵工艺为主,发酵食品工业化程度不高,发酵工艺中微生物菌群复杂且发酵过程难以控制,导致发酵食品存在一定的安全性问题。如酒饮料发酵过程可能是形成氨基甲酸乙酯的主要来源,其次是谷物类和豆类发酵食品。发酵蔬菜在腌渍过程中易在微生物的作用下将硝酸盐还原为亚硝酸盐。发酵肉制品易受微生物的污染形成生物胺[33]。
国内外有关代谢组学在发酵食品安全中的应用研究尚不多见。表1是近些年代谢组学在发酵食品中有毒代谢产物分析的研究概况,主要针对发酵食品中氨基甲酸乙酯、生物胺和亚硝酸盐分析检测中样品前处理、研究方法、数据处理等。
2.1氨基甲酸乙酯(Ethyl Carbamate,EC)
EC属于多位点致癌物,具有一定的神经毒性、强烈的肺毒性和较强的致癌性,国际癌症研究机构正式将EC划列为2A类致癌物(人类可能致癌物)[34]。在食品发酵过程中EC可由尿素、氰化物、瓜氨酸、氨甲酰磷酸盐等前体物质与乙醇反应形成,主要存在于酸奶、奶酪、酱油及酒饮料等发酵食品中[35]。Wu等利用GC-MS技术对中国发酵食品和酒饮料中的EC含量进行检测,发现酒饮料中EC含量在2.0~515.0 μg/kg范围内,发酵红腐乳中EC含量最高,达到182 μg/kg[36]。2002年,联合国粮农组织制定了EC的国际标准,规定食品中EC含量不得超过20 μg/L[37]。因此,检测发酵食品中EC对食品安全以及人体健康具有重要意义。
EC在发酵食品中属痕量物质,需要灵敏度较高的检测仪器才能检测,应用较多的是GC-MS。Park等采用高效液相色谱结合串联质谱(HPLC-MS/MS)测定韩国酿造酱油中的EC,在0.1~20.0 μg/L浓度范围内具有良好的线性关系。与GC-MS方法对比,HPLC-MS/MS 法具有更低的检测限和更好的重复性[38]。Wu等利用GC-MS技术分析了浙江黄酒在发酵和贮藏过程中EC含量的变化,结果发现发酵过程中EC含量增加缓慢,经过煎酒后EC含量迅速增加,冷却至室温过程中快速冷却比自然冷却的EC含量要少,高温和长期储存能够使EC含量增加。通过对煎酒条件如温度、时间、冷却过程等进行优化,可能减低其EC含量[39]。
发酵食品营养丰富,基质复杂多样,很容易对检测结果造成干扰。因此,在采用仪器分析方法检测EC的含量之前,通常需要对发酵食品进行预处理。Lim等[40]优化样品前处理条件,应用GC-MS代谢组学方法分析泡菜、发酵豆瓣酱、发酵鱼制品、酸奶、面包、醋和奶酪中的EC含量,优化后最低检测浓度为10 ng/mL,回收率为76.9%~118.1%。Leça J M等通过不同吸附材料的微萃取技术提取葡萄酒中的EC,结合GC-MS检测发现C8和二氯甲烷是提取葡萄酒中EC的最佳吸附剂和溶剂[41]。
2.2生物胺(Biogenic Amine,BA)
BA是一类碱性含氮化合物,主要来源于发酵过程中微生物的降解作用。微生物产生的蛋白酶可将原料中蛋白质分解形成氨基酸,进一步脱羧后形成BA,其中乳酸菌的作用最为突出[42]。发酵食品中的BA与原料质量、发酵过程控制以及酿造贮藏过程中受微生物污染的程度密切相关。BA的形成需要三个条件:(1)发酵基质中游离氨基酸或蛋白质的含量;(2)产生氨基酸脱羧酶的微生物;(3)发酵基质促进微生物生长的条件[43]。BA虽是动植物和多数微生物体内的正常代谢成分,若含量过高会产生毒性作用,危害生物体正常代谢[44]。
发酵食品中的BA包括芳香胺(酪胺、苯乙胺、多巴胺等)、脂肪胺(腐胺、精胺、亚精胺等)和杂环胺(组胺、色胺等)[45]。Gianotti等利用HPLC-MS/MS技术对奶酪中的BA进行测定,结果显示在中期成熟阶段酪胺和色胺浓度相对较高。由于成熟和贮藏过程防止了微生物的污染,腐胺、亚精胺、精胺浓度相对较低[46]。De等为评估干发酵香肠的安全性,对101种样品进行检测,利用基于反相高效液相色谱(reversed-phase high-performance liquid chromatography,RP-HPLC)检测干发酵香肠中的BA。通过主成分分析和聚类分析,仅在一种产品中发现腐胺和尸胺的含量达到了中毒的水平[47]。Arbulu等探讨了酿造葡萄酒中代谢物的种类,以液相色谱-电喷雾电离飞行时间质谱技术(LC-ESI-TOFMS)为基础,利用非靶向代谢组学对葡萄酒中的非挥发性代谢产物进行鉴定,通过主成分分析共鉴定出411种不同的代谢产物,其中BA质量分数为4.0%[48]。
BA含量也可作为评价葡萄酒品质的指标之一,组胺、酪胺、尸胺是葡萄酒中最具代表性的胺类。Martuscelli等利用HPLC方法对葡萄酒中的BA进行监测,确立了影响三种葡萄酒品质的标记物对葡萄酒的品质进行风险评估,为葡萄酒酿造过程安全控制奠定了基础[49]。
2.3硝酸盐和亚硝酸盐
传统发酵食品中亚硝酸盐来源于原料中的硝酸盐,特别是蔬菜中硝酸盐含量较高,平均含量达1500 mg/kg。在发酵过程中,分泌硝酸盐还原酶的微生物可将硝酸盐还原为亚硝酸盐,亚硝酸盐可与仲胺类物质生成强致癌的亚硝胺[50]。我国国标GB 2762-2012规定蔬菜及其制品、腌渍蔬菜中由环境污染带入的、非有意加入的亚硝酸盐允许的限量不得超过20 mg/kg[51]。
Iammarino等[52]采用离子色谱法(ion chromatography,IC)对180种奶酪中的硝酸盐和亚硝酸盐含量进行检测,所有样品中均未检测出亚硝酸盐,但在21种样品中检测出硝酸盐,其中未成熟干酪中硝酸盐含量最高,达到58.6 mg/kg。刘广福等[53]采用离子色谱法(IC)对酸菜发酵过程中不同时间采集的样品进行分析,比较接种发酵和自然发酵酸菜的亚硝酸盐含量,发现自然发酵法生产的酸菜发酵初期亚硝酸盐含量较高,峰值出现在第7 d,含量为20.84 mg/kg,并提出应将生产周期控制在30 d以上。Akyüz等[54]分别用GC-MS和液相色谱-荧光检测器(liquid chromatography-fluorescence detector,LC-FLD)技术检测土耳其奶酪和发酵香肠中的硝酸盐和亚硝酸盐,发酵香肠中硝酸盐和亚硝酸盐浓度分别达到647.0 mg/kg和17.8 mg/kg。
3 结论与展望
本文主要介绍了应用代谢组学研究方法对一些发酵食品中的氨基甲酸乙酯、生物胺和亚硝酸盐等有毒代谢物研究的最新进展。通过优化发酵和酿造条件,可实现对发酵食品中氨基甲酸乙酯、生物胺和亚硝酸盐等有害物质的在线监测,达到消除和控制有毒代谢物的目的。因此,可以看出代谢组学在食品发酵领域取得的研究优势。
代谢组学作为一门新兴学科和实时监控的技术手段,虽然在生物学及其相关领域得到广泛应用,但针对发酵食品中有毒代谢物研究处于起步阶段。由于发酵食品中代谢产物的来源和形成的复杂性,因此,代谢组学在食品科学领域的发展趋势一方面迫切需要代谢组学分析技术具有更高的灵敏度、精确度和时效性,另一方面是将代谢组学与基因组学、转录组学和蛋白质组学相结合,探究微生物与食品品质和安全的内在联系。随着前处理手段的不断完善,分离和检测技术水平的不断提高,将为促进传统食品发酵工业的全面技术改造,提高食品安全性起到较大的推动作用。代谢组学必将对提高食品发酵过程中的品质形成和安全性控制等诸多技术问题产生革命性的影响。
[1]Putri S P,Nakayama Y,Matsuda F,et al. Current metabolomics:practical applications[J]. Journal of Bioscience and Bioengineering,2013,115(6):579-589.
[2]Trujillo E,Davis C,Milner J. Nutrigenomics,proteomics,metabolomics,and the practice of dietetics[J]. Journal of the American Dietetic Association,2006,106(3):403-413.
[3]Wishart D S. Metabolomics:applications to food science and nutrition research[J]. Trends in Food Science &Technology,2008,19(9):482-493.
[4]Castro-Puyana M,Herrero M. Metabolomics approaches based on mass spectrometry for food safety,quality and trace ability[J]. TrAC Trends in Analytical Chemistry,2013,52:74-87.
[5]Oldiges M,Lütz S,Pflug S,et al. Metabolomics:current state and evolving methodologies and tools[J]. Applied Microbiology and Biotechnology,2007,76(3):495-511.
[6]Fiehn O. Combining genomics,metabolome analysis,and biochemical modelling to understand metabolic networks[J]. Comparative and Functional Genomics,2001,2(3):155-168.
[7]孙茂成,李艾黎,霍贵成,等. 乳酸菌代谢组学研究进展[J]. 微生物学通报,2012,39(10):1499-1505.
[8]Li Z Y,Zhi H J,Zhang F S,et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis[J]. Journal of Pharmaceutical and Biomedical Analysis,2013,75(5):158-164.
[9]Longini M,Giglio S,Perrone S,et al. Proton nuclear magnetic resonance spectroscopy of urine samples in preterm asphyctic newborn:a metabolomic approach[J]. Clinica Chimica Acta,2015,444(15):250-256.
[10]Pace R,Martinelli E M,Sardone N,et al. Metabolomic evaluation of ginsenosides distribution in Panax genus(Panax ginseng and Panax quinquefolius)using multivariate statistical analysis[J]. Fitoterapia,2015,101:80-81.
[11]González-Domínguez R,García-Barrera T,Vitorica J,et al. Deciphering metabolic abnormalities associated with alzheimer’s disease in the APP/PS1 mouse model using integrated metabolomic approaches[J]. Biochimie,2015,110:119-128.
[12]Kang H J,Yang H J,Kim M J,et al. Metabolomic analysis of meju during fermentation by ultra performance liquid chromatography-quadrupole-time of flight mass spectrometry(UPLC-Q-TOF MS)[J]. Food Chemistry,2011,127(3):1056-1064.
[13]Lee J E,Lee B J,Chung J O,et al. Metabolomic unveiling of a diverse range of green tea(Camellia sinensis)metabolites dependent on geography[J]. Food Chemistry,2015,174(1):452-459.
[14]Lopez-Sanchez P,Vos R C H D,Jonker H H,et al. Comprehensive metabolomics to evaluate the impact of industrial processing on the phytochemical composition of vegetable purees[J]. Food Chemistry,2015,168:348-355.
[15]Raterink R J,Lindenburg P W,Vreeken R J,et al. Recent developments in sample-pretreatment techniques for mass spectrometry-based metabolomics[J]. TrAC Trends in Analytical Chemistry,2014,61:157-167.
[16]Lee S H,Jung J Y,Jeon C O. Effects of temperature on microbial succession and metabolite change during saeujeot fermentation[J]. Food Microbiology,2014,38:16-25.
[17]Lee S Y,Lee S,Lee S,et al. Primary and secondary metabolite profiling of doenjang,a fermented soybean paste during industrial processing[J]. Food Chemistry,2014,165(15):157-166.
[18]Xu Y J,Wang C,Ho W E,et al. Recent developments and applications of metabolomics in microbiological investigations[J]. TrAC Trends in Analytical Chemistry,2014,56:37-48.
[19]Marcone M F,Wang S,Albabish W,et al. Diverse food-based applications of nuclear magnetic resonance(NMR)technology[J]. Food Research International,2013,51(2):729-747.
[20]Kim H K,Choi Y H,Verpoorte R. NMR-based metabolomic analysis of plants[J]. Nature Protocols,2010,5(3):536-549.
[21]Papotti G,Bertelli D,Graziosi R,et al. Traditional balsamic vinegar and balsamic vinegar of Modena analyzed by nuclear magnetic resonance spectroscopy coupled with multivariate data analysis[J]. LWT-Food Science and Technology,2015,60(2):1017-1024.
[22]Jeong S H,Jung J Y,Lee S H,et al. Microbial succession and metabolite changes during fermentation of dongchimi,traditional Korean watery kimchi[J]. International Journal of Food Microbiology,2013,164(1):46-53.
[23]Antignac J P,Courant F,Pinel G,et al. Mass spectrometry-based metabolomics applied to the chemical safety of food[J]. TrAC Trends in Analytical Chemistry,2011,30(2):292-301.
[24]Gu Q,David F,Lynen F,et al. Evaluation of automated sample preparation,retention time locked gas chromatography-mass spectrometry and data analysis methods for the metabolomic study of Arabidopsis species[J]. Journal of Chromatography A,2011,1218(21):3247-3254.
[25]Cox D G,Oh J,Keasling A,et al. The utility of metabolomics in natural product and biomarker characterization[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,2014,1840(12):3460-3474.
[26]Issaq H J,Van Q N,Waybright T J,et al. Analytical and statistical approaches to metabolomics research[J]. Journal of Separation Science,2009,32(13):2183-2199.
[27]Ruben T,Kris M,Dieter D,et al. Joint GC-MS and LC-MS platforms for comprehensive plant metabolomics:repeatability and sample pre-treatment[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2009,877(29):3572-3580.
[28]Park M K,Cho I H,Lee S,et al. Metabolite profiling of Cheonggukjang,a fermented soybean paste,during fermentation by gas chromatography-mass spectrometry and principal component analysis[J]. Food Chemistry,2010,122(4):1313-1319.
[29]Boucher C L,Courant F,Jeanson S,et al. First mass spectrometry metabolic fingerprinting of bacterial metabolism in a model cheese[J]. Food Chemistry,2013,141(2):1032-1040.
[30]Ellis D I,Brewster V L,Dunn W B,et al. Fingerprinting food:current technologies for the detection of food adulteration and contamination[J]. Chemical Society Reviews,2012,41(17):5706-5727.
[31]Mozzi F,Ortiz M E,Bleckwedel J,et al. Metabolomics as a tool for the comprehensive understanding of fermented and functional foods with lactic acid bacteria[J]. Food Research International,2013,54(1):1152-1161.
[32]Piras C,Marincola F C,Savorani F,et al. A NMR metabolomics study of the ripening process of the Fiore Sardo cheese produced with autochthonous adjunct cultures[J]. Food Chemistry,2013,141(3):2137-2147.
[33]成黎. 传统发酵食品营养保健功能与质量安全评价[J]. 食品科学,2012,33(1):280-284.
[34]LARC. Alcoholic beverage consumption and ethyl carbamate(urethane)[M]. Geneva:WHO,2007.
[35]Júnior J C B,Mendonça R C S,Pereira J A M,et al. Ethyl-carbamate determination by gas chromatography-mass spectrometry at different stages of production of a traditional Brazilian spirit[J]. Food Chemistry,2011,129(4):1383-1387.
[36]Wu P,Pan X,Wang L,et al. A survey of ethyl carbamate in fermented foods and beverages from Zhejiang,China[J]. Food Control,2012,23(1):286-288.
[37]Weber J V,Sharypov V I. Ethyl carbamate in foods and beverages:a review[J]. Environmental Chemistry Letters,2009,7(3):233-247.
[38]Park S K,Kim C T,Lee J W,et al. Analysis of ethyl carbamate in Korean soy sauce using high-performance liquid chromatography with fluorescence detection or tandem mass spectrometry and gas chromatography with mass spectrometry[J]. Food Control,2007,18(8):975-982.
[39]Wu P,Cai C,Shen X,et al. Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine[J]. Food Chemistry,2014,152(1):108-112.
[40]Lim H S,Lee K G. Development and validation of analytical methods for ethyl carbamate in various fermented foods[J]. Food Chemistry,2011,126(3):1373-1379.
[41]Leça J M,Pereira V,Pereira A C,et al. Rapid and sensitive methodology for determination of ethyl carbamate in fortified wines using microextraction by packed sorbent and gas chromatography with mass spectrometric detection[J]. Analytica Chimica Acta,2014,811(6):29-35.
[42]Chin-Chen M L,Carda-Broch S,Peris-Vicente J,et al. Evaluation of biogenic amines in fish sauce by derivatization with 3,5-dinitrobenzoyl chloride and micellar liquid chromatography[J]. Journal of Food Composition and Analysis,2013,29(1):32-36.
[43]Shalaby A R. Significance of biogenic amines to food safety and human health[J]. Food Research International,1996,29(7):675-690.
[44]Shukla S,Park H K,Lee J S,et al. Reduction of biogenic amines and aflatoxins in Doenjang samples fermented with various Meju as starter cultures[J]. Food Control,2014,42(2):181-187.
[45]Ruiz-Capillas C,Jiménez-Colmenero F. Biogenic amines in meat and meat products[J]. Critical Reviews in Food Science and Nutrition,2005,44(7-8):489-599.
[46]Gianotti V,Chiuminatto U,Mazzucco E,et al. A new hydrophilic interaction liquid chromatography tandem mass spectrometry method for the simultaneous determination of seven biogenic amines in cheese[J]. Journal of Chromatography A,2008,1185(2):296-300.
[47]Mey E D,Klerck K D,Maere H D,et al. The occurrence of N-nitrosamines,residual nitrite and biogenic amines in commercial dry fermented sausages and evaluation of their occasional relation[J]. Meat Science,2014,96(2):821-828.
[48]Arbulu M,Sampedro M C,Gómez-Caballero A,et al. Untargeted metabolomic analysis using liquid chromatography quadrupole time-of-flight mass spectrometry for non-volatile profiling of wines[J]. Analytica Chimica Acta,2015,858(9):32-41.
[49]Martuscelli M,Arfelli G,Manetta A C,et al. Biogenic amines content as a measure of the quality of wines of Abruzzo(Italy)[J].Food Chemistry,2013,140(3):590-597.
[50]Wang Y,Li F,Zhuang H,et al. Effects of plant polyphenols and a-tocopherol on lipid oxidation,residual nitrites,biogenic amines,and N-nitrosamines formation during ripening and storage of dry-cured bacon[J]. LWT-Food Science and Technology,2014,60(1):199-206.
[51]GB 2762-2012,食品中污染物限量[S]. 北京:中国标准出版社,2012.
[52]Iammarino M,Taranto A D,Cristino M. Endogenous levels of nitrites and nitrates in wide consumption foodstuffs:Results of five years of official controls and monitoring[J]. Food Chemistry,2013,140(4):763-771.
[53]刘广福,王硕,朱兴旺,等. 接种发酵和自然发酵酸菜的亚硝酸盐含量对比分析[J]. 中国酿造,2013,32(7):74-76.
[54]Akyüz M,Ata. Determination of low level nitrite and nitrate in biological,food and environmental samples by gas chromatography-mass spectrometry and liquid chromatography with fluorescence detection[J]. Talanta,2009,79(3):900-904.
Progress of toxic metabolite analysis in fermented food by metabolomics
MIAO Lu-huan,DU Jing-fang,BAI Feng-ling*,LI Jian-rong
(College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province;National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou 121013,China)
Some toxic metabolites were produced during the process of food fermentation,which caused safety problems to fermented food. As a new technology,metabolomics can analyze and monitor small molecule metabolites of biological metabolism in real time. Technologies of gas chromatogram-mass spectrometry(GC-MS),ion chromatography(IC),reversed-phase high performance liquid chromatography(RP-HPLC),HPLC-MS/MS and liquid chromatography-high resolution time of flight mass spectrometer(LC-ESI-TOFMS)were used to analyze toxic metabolites in food such as alcoholic beverage,wine,cheese,sausage,soybean sauce. The formation and changes of ethyl carbamate,biogenic amine and nitrite were analyzed at different fermentation period. It can provide references for increasing the safety of fermented food and promoting application in the field of fermented food.
metabolomics;fermented food;toxic metabolites;analysis
2015-06-05
缪璐欢(1991-),女,硕士研究生,研究方向:食品质量与安全控制,E-mail:maioluhuan2013@163.com。
白凤翎(1964-),男,博士,教授,研究方向:食品质量与安全控制和食品微生物学,E-mail:baifling@163.com。
“十二五”国家科技支撑计划课题(2012BAD29B06);辽宁省高等学校创新团队课题(LT2014024)。
TS201
A
1002-0306(2016)05-0388-06
10.13386/j.issn1002-0306.2016.05.071

