乳杆菌产抑菌活性物质与酵母菌DNA相互作用研究
陈忠军,刘 静
(内蒙古农业大学,食品科学与工程学院,内蒙古呼和浩特 010018)
乳杆菌产抑菌活性物质与酵母菌DNA相互作用研究
陈忠军,刘静
(内蒙古农业大学,食品科学与工程学院,内蒙古呼和浩特 010018)
本研究以具有抑酵母活性的乳杆菌ALAC-3和ALAC-4为研究对象,以白假丝酵母为指示菌,通过紫外光谱和荧光光谱法研究了乳杆菌所产抑菌活性物质与酵母菌DNA的相互作用机制。结果表明:酵母菌DNA与乳杆菌所产抑菌活性物质反应后,其紫外吸收值减小,产生了减色效应;随着作用时间的延长,紫外吸收值增加,呈现增色效应。加入抑菌物质后,酵母菌DNA荧光强度降低。抑菌物质与EB-DNA复合体系反应后荧光强度降低,EB与抑菌物质-DNA复合体系反应后荧光强度增加,说明溶液体系存在抑菌物质-DNA与EB-DNA两个复合体系竞争。
乳杆菌,抑酵母菌物质,DNA,紫外光谱法,荧光光谱法
酵母菌在很早以前就被广泛应用于酿酒、食品、医药工业等。然而某些酵母菌可引起人和植物的病害[1],还有一些能够引起食品的腐败变质。乳杆菌不仅能抑制多种细菌的生长,也能产生抗真菌化合物,对真菌起到抑制作用[2-4]。目前对具抑细菌活性乳杆菌的研究工作已经有很大进展[5],但对于具抑真菌能力乳杆菌的研究还比较新,且主要集中在抑菌物质与真菌细胞膜作用方面。到目前为止,乳杆菌是否与真菌的染色体DNA发生作用尚不清楚[6]。因此,对具有抑酵母菌作用的乳杆菌进行深入研究,揭示其抑菌作用机理具有重大的理论意义,为天然食品防腐剂的开发及其利用奠定基础。
1 材料与方法
1.1材料与仪器
乳杆菌从内蒙古传统发酵食品中筛选出的2株乳杆菌ALAC-3、ALAC-4;指示菌白假丝酵母(Candidaalbicans)标准菌株,编号为32819,来自中国工业微生物菌种保藏管理中心。
MRS培养基蛋白胨10 g/L、牛肉浸膏10 g/L、酵母提取粉5 g/L、柠檬酸氢二铵2 g/L、无水乙酸钠5 g/L、磷酸氢二钾2 g/L、Tween 80 mL/L、硫酸镁0.58 g/L、硫酸锰0.25 g/L、葡萄糖20 g/L,调节pH至6.5,121 ℃、20 min灭菌[7-8];YEPD培养基酵母提取粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,调节pH至6.0,115 ℃、20 min灭菌[6-8];0.1 mol/L Tris-HCl(pH7.4)称取固体Tris 1.211 g于烧杯中,加入80 mL超纯水,充分搅拌溶解。用浓HCl调节pH至7.4,然后定容至100 mL,高温高压灭菌后,室温保存备用;溴化乙锭(10 mg/mL)。
SW-CJ-2FD型垂直净化工作台苏州博莱尔净化设备有限公司;LDZX-75KBS型立式压力蒸汽灭菌器上海申安医疗器械厂;DPX-9002B-1/2型电热恒温培养箱上海福玛实验设备有限公司;KDC-140HR型高速冷冻离心机安徽中科中佳科学仪器有限公司;IKA®RV 10 digital型旋转蒸发仪广州仪科实验室技术有限公司;T6型新世纪紫外可见分光光度计北京普析通用仪器有限责任公司;岛津RF5301荧光分光光度计杭州英斯特科技有限公司。
1.2实验方法
1.2.1乳杆菌抑菌物质的制备活化三代的乳杆菌扩培至MRS液体培养基中(37 ℃,24 h),将所得发酵液离心(4000 r/min,10 min),取上清液。再用旋转蒸发仪对上清液进行浓缩至25倍,得到浓缩液留下备用。在浓缩液中加入适量的饱和硫酸铵溶液,放入4 ℃冰箱中放置过夜,取出后冷冻离心(4 ℃,8000 r/min,20 min),弃去上清液可得蛋白质沉淀粗提物。粗提物经初步纯化后[15],得到蛋白质化合物作为抑菌物质,用灭菌蒸馏水配制成不同质量浓度的抑菌物质溶液,质量浓度分别为3×10-3、6×10-3、9×10-3g/mL,放入4 ℃冰箱中保存备用[5]。
1.2.2酵母菌DNA的提取采用玻璃珠法[9]提取酵母菌DNA。
1.2.3紫外光谱法检测抑菌物质与DNA的相互作用在0.1 mol/L Tris-HCl缓冲液(pH7.4)介质中,将40 μL浓度为398.0 ng/μL的DNA与不同浓度的抑菌物质水溶液于30 ℃恒温培养箱中避光反应3、6、12、24 h后,分别测其λ为220~320 nm范围的紫外吸收光谱。
1.2.4抑菌物质与DNA结合的荧光光谱分别取各浓度的抑菌物质40 μL,与40 μL DNA溶液置于EP管中混合均匀,在0.1 mol/L Tris-HCl缓冲液(pH7.4)介质中测定荧光激发波长λex=310 nm,荧光发射波长λem为330~600 nm范围的荧光光谱。
1.2.5抑菌物质对复合体系EB-DNA相互作用的荧光光谱EB溶液的配制:将浓度为10 mg/mL的EB 10 μL用超纯水稀释至2.5 mL,其最终浓度为79.8 μmol/L,置于棕色瓶中,4 ℃避光保存备用。分别取40 μL EB溶液和40 μL DNA溶液,置于EP管中混合均匀,于30 ℃恒温培养箱中避光放置30 min,然后分别加入各浓度的抑菌物质40 μL,混合均匀,在30 ℃避光放置30 min。测定各反应体系荧光激发波长λex=310 nm,荧光发射波长λem为330~550 nm范围的荧光光谱。
1.2.6EB对复合体系抑菌物质-DNA相互作用的荧光光谱分别取40 μL浓度为3×10-3g/mL的抑菌物质溶液和40 μL DNA溶液4份,置于EP管中混合均匀,于30 ℃恒温培养箱中避光放置30 min,然后分别加入不同浓度的EB再次混匀,使得各反应体系中的EB浓度分别为0、19.95、39.90、79.80 μmol/L。测定各反应体系荧光激发波长λex=310 nm,荧光发射波长λem为330~550 nm范围的荧光光谱。
2 结果与讨论
2.1紫外光谱法检测抑菌物质与DNA的相互作用
2.1.1不同浓度抑菌物质与DNA相互作用的紫外光谱将提取得到的白假丝酵母DNA与不同浓度的抑菌物质于30 ℃避光反应后,测定其紫外吸收光谱,结果见图1、图2。
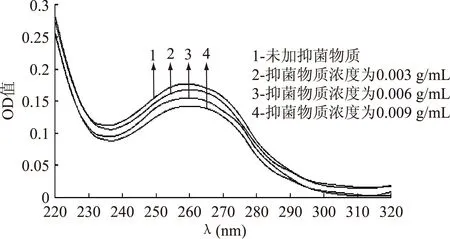
图1 ALAC-3产抑菌物质与DNA相互作用的紫外光谱Fig.1 UV absorption spectra of the interaction between DNA and different concentrations of antiyeast substance produced by ALAC-3
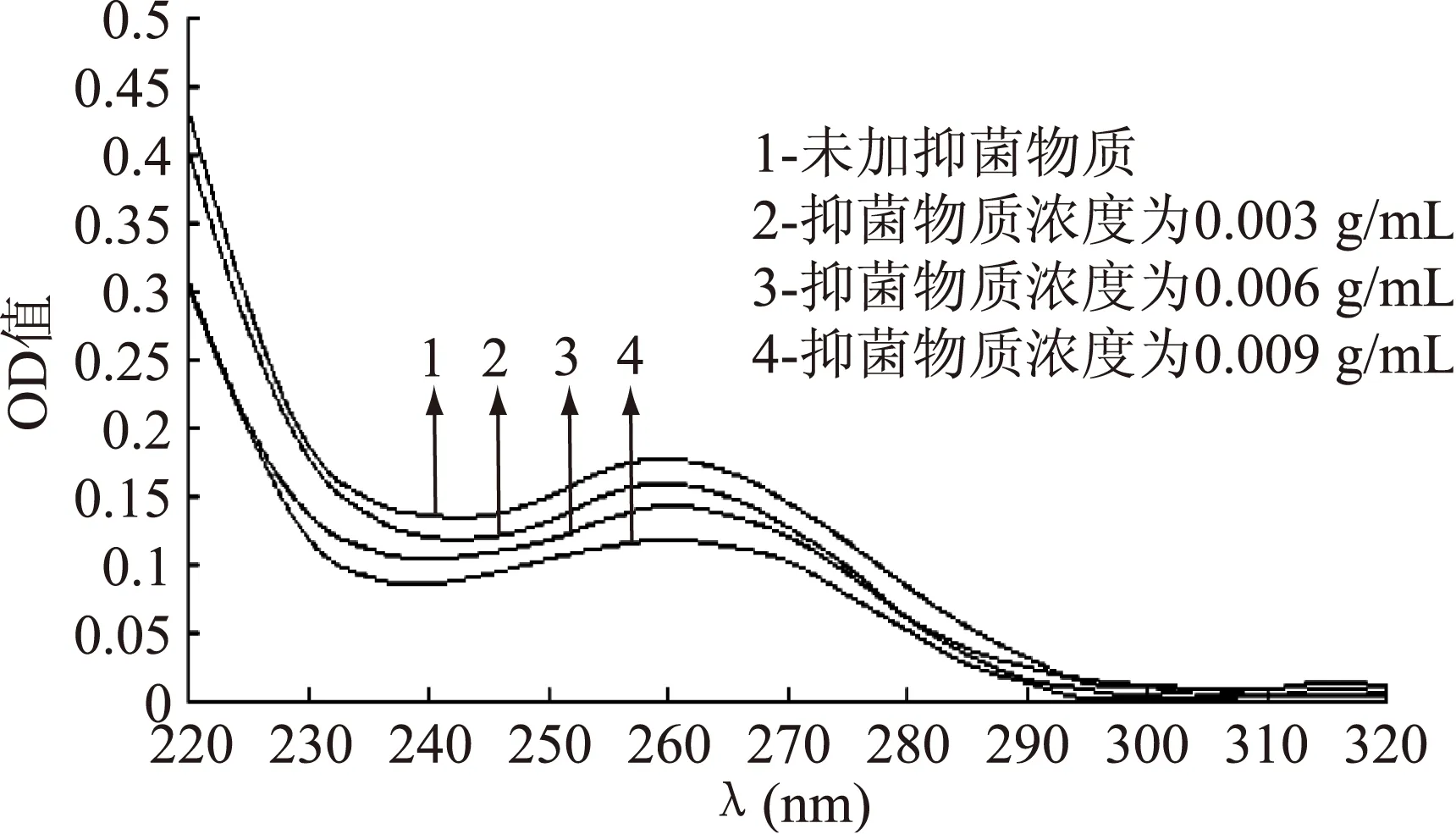
图2 ALAC-4产抑菌物质与DNA相互作用的紫外光谱Fig.2 UV absorption spectra of the interaction between DNA and different concentrations of antiyeast substance produced by ALAC-4
从图1和图2可以看出,抑菌物质的加入使酵母DNA紫外吸收光谱发生了一定变化。最大吸收峰有红移的趋势,未加入抑菌物质时,ALAC-3的最大吸收峰在259 nm处,当抑菌物质浓度为0.009 g/mL时,其最大吸收峰由259 nm移到了261 nm。ALAC-4在未加抑菌物质时,最大吸收峰在258 nm处,当抑菌物质浓度为0.009 g/mL时,其最大吸收峰由258 nm移到了260 nm。且随着抑菌物质浓度的增加,紫外吸收值明显降低,产生了减色效应。而且ALAC-4紫外吸收值降低的程度高于ALAC-3,说明ALAC-4所产抑菌物质对酵母菌DNA的影响大于ALAC-3。
这可能是由于抑菌物质与DNA表面的磷酸基团作用,导致DNA主链电荷密度降低,DNA双链绕性增大,结构趋于拢缩,从而构象发生变化,它的一部分发色团内陷,因此呈现减色效应[6]。
2.1.2抑菌物质与DNA相互作用不同时间的紫外光谱将白假丝酵母DNA与浓度为3×10﹣3g/mL的抑菌物质于30 ℃避光反应后,测定其紫外吸收光谱,结果见图3、图4。
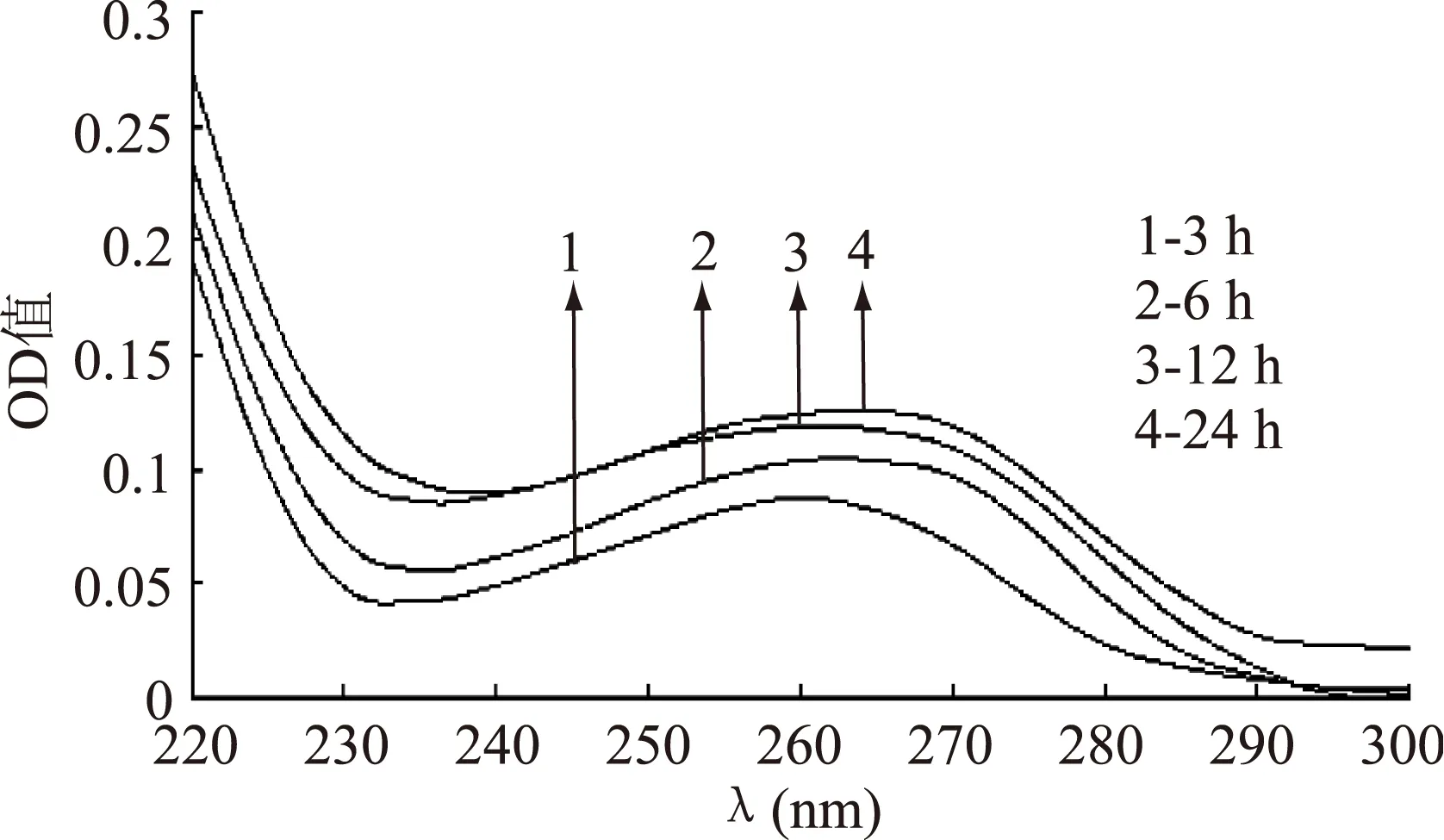
图3 ALAC-3产抑菌物质 与DNA相互作用不同时间的紫外光谱Fig.3 UV absorption spectra of the interaction between DNA and antiyeast substance produced by ALAC-3 at different time
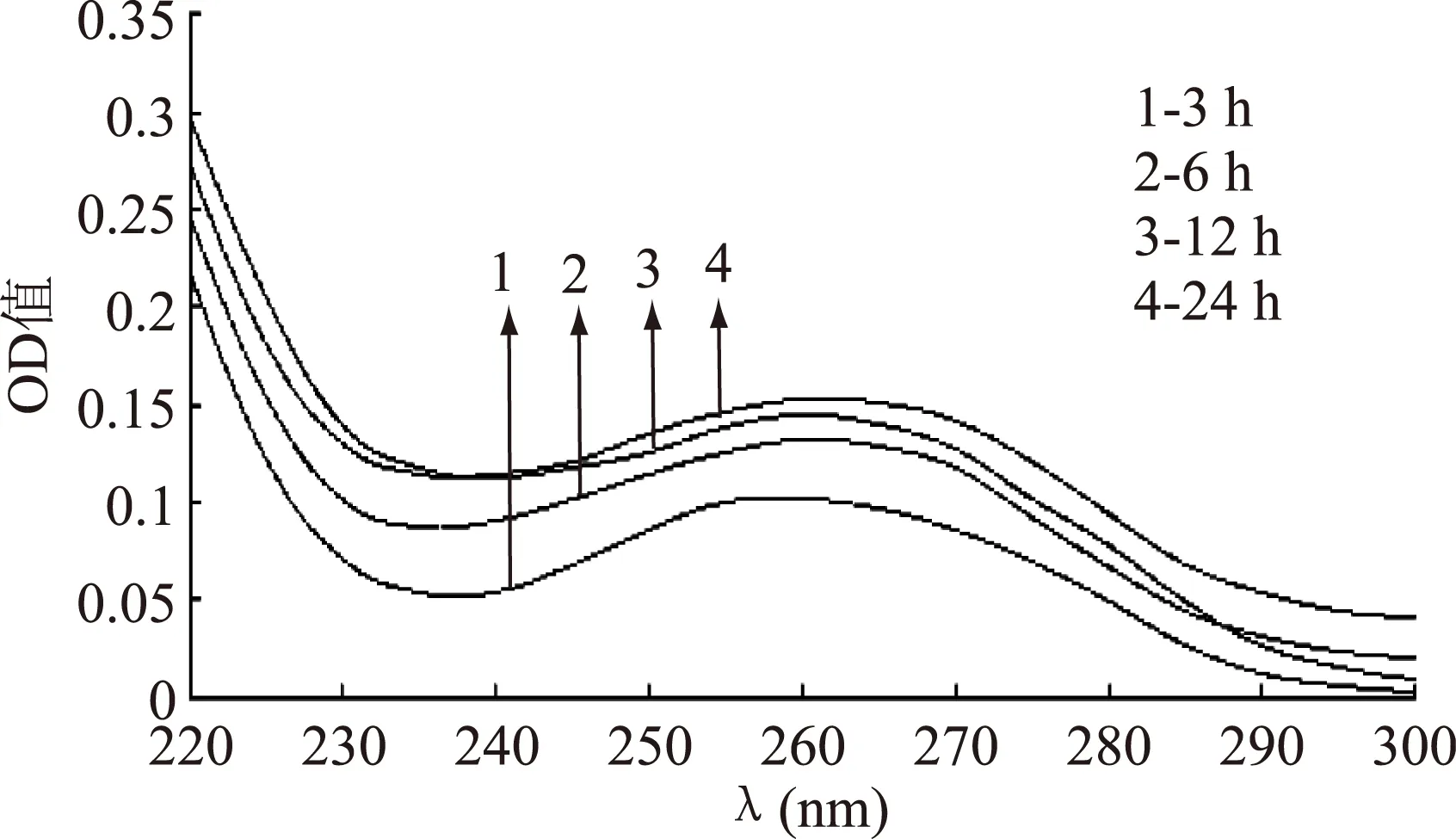
图4 ALAC-4产抑菌物质 与DNA相互作用不同时间的紫外光谱Fig.4 UV absorption spectra of the interaction between DNA and antiyeast substance produced by ALAC-4 at different time
由图3和图4可以看出,随着作用时间的延长,紫外吸收值有逐渐升高的趋势,产生了增色效应。图3的最大吸收峰由265 nm移到了261 nm,图4的最大吸收峰由260 nm移到了257 nm。
这可能是由于抑菌物质和DNA作用时间延长,抑菌物质不仅与DNA表面的磷酸基团发生了作用,而且抑菌物质可能部分结构嵌入DNA分子沟槽中,使DNA收缩的构象趋于松散,所以又发生增色效应[10]。
2.2抑菌物质与DNA结合的荧光光谱
按照1.2.4方法测定抑菌物质与DNA结合的荧光光谱,结果见图5、图6。
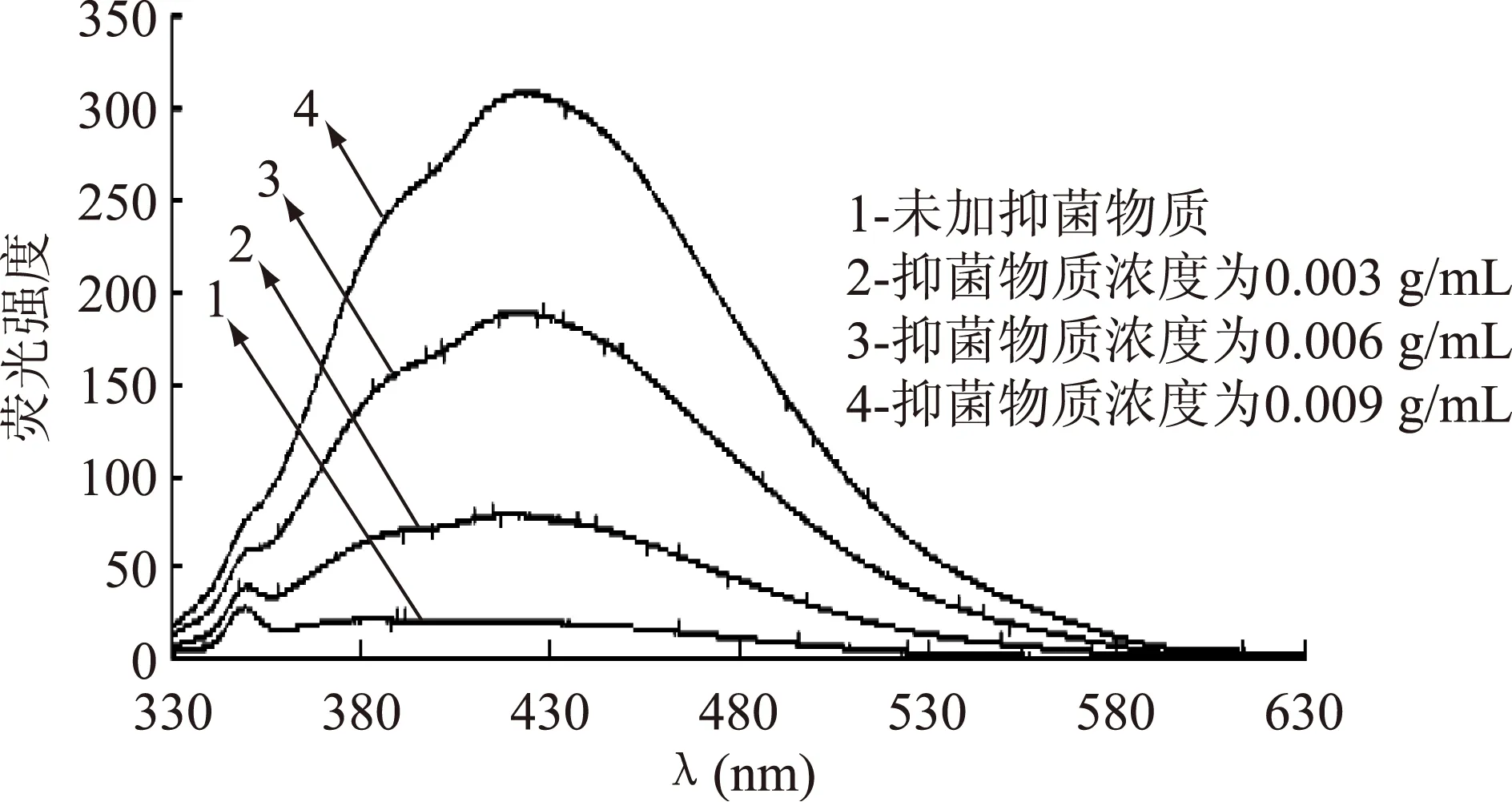
图5 ALAC-3产抑菌物质与DNA相互作用的荧光光谱Fig.5 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-3
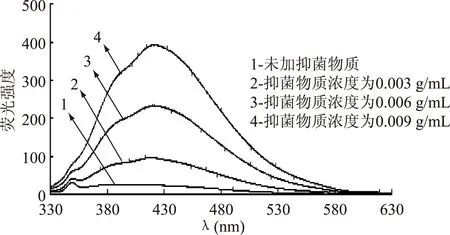
图6 ALAC-4产抑菌物质与DNA相互作用的荧光光谱Fig.6 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-4
从图中可以看出,ALAC-3和ALAC-4在未加抑菌物质的荧光光谱中,其最高荧光强度均为349 nm,且在扫描范围内荧光强度呈现微弱的下降趋势。加入抑菌物质后,随着抑菌物质浓度的增加,荧光强度逐渐增强,各浓度的荧光光谱形状相似且ALAC-3和ALAC-4的最高荧光强度分别在424 nm和423 nm处。ALAC-4荧光强度增加的程度高于ALAC-3,说明ALAC-4所产抑菌物质对酵母菌DNA的作用大于ALAC-3。
抑菌物质与DNA的结合主要有嵌入、沟槽结合和静电作用[11-13]。嵌入可以导致荧光强度增强,当DNA与抑菌物质相互作用后,最高峰处的荧光强度明显增强,说明抑菌物质与DNA发生了较强的结合作用。可能由于抑菌物质中的氨基酸残基嵌入DNA双螺旋链中与碱基对之间形成堆积效应或处于DNA作用面的疏水环境中,导致DNA荧光强度增强[9]。这与之前紫外光谱法的检测结果相一致。
2.3抑菌物质对复合体系EB-DNA相互作用的荧光光谱
EB是一种灵敏度高、选择性好的荧光探针,在水溶液中本身的荧光很弱,当它通过以较高的亲合力、嵌入的方式与双链DNA结合时,其荧光强度大幅度增强[14]。实验测定了荧光激发波长为310 nm,荧光发射波长为330~550 nm范围的荧光光谱,从而观察抑菌物质对EB-DNA复合体系荧光强度的影响。结果见图7、图8。
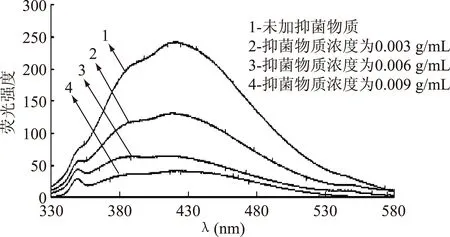
图7 ALAC-3产抑菌物质 对复合体系EB-DNA相互作用的荧光光谱Fig.7 Fluorescence spectra of the interaction between EB-DNA and antiyeast substance produced by ALAC-3
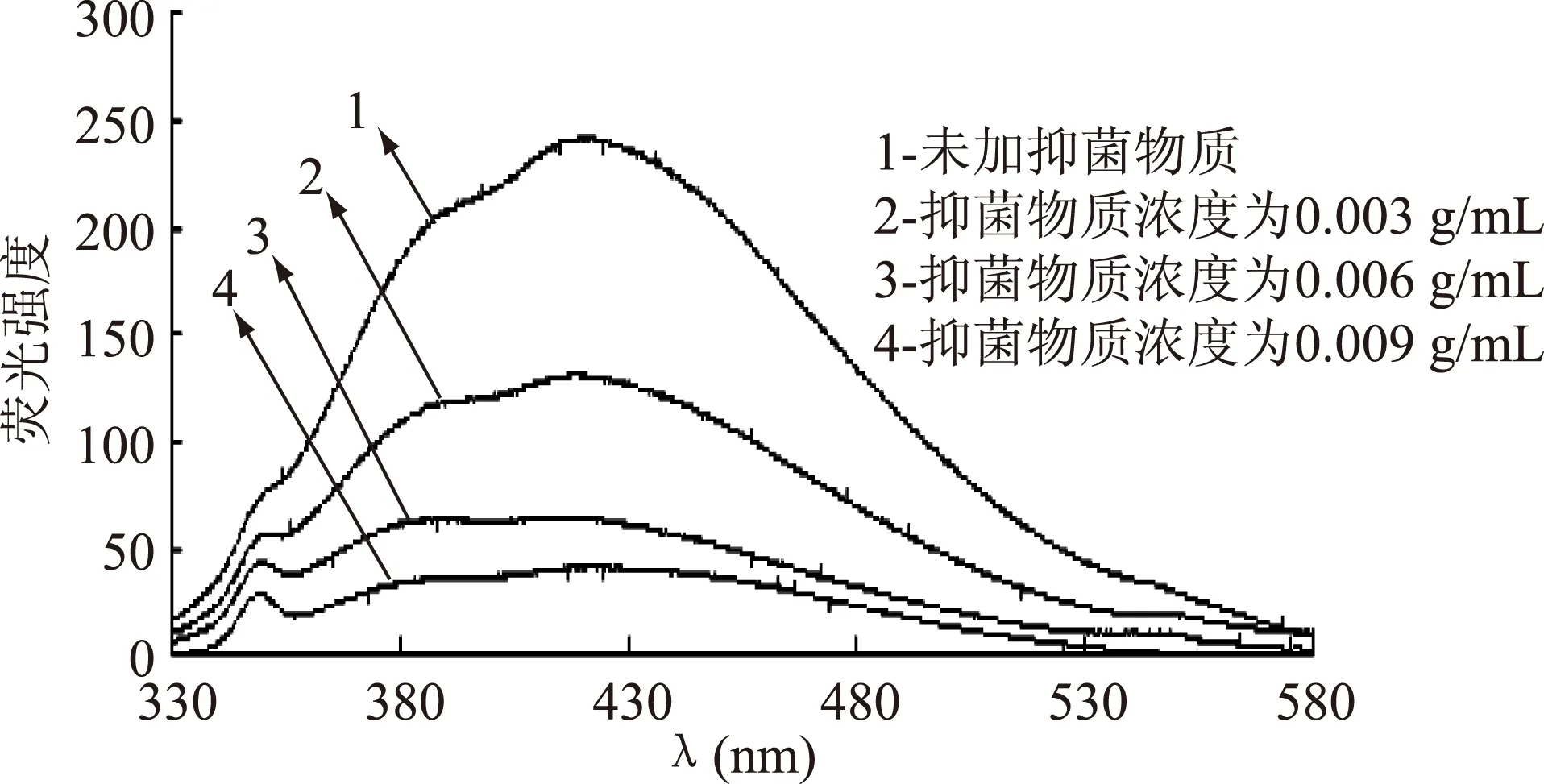
图8 ALAC-4产抑菌物质 对复合体系EB-DNA相互作用的荧光光谱Fig.8 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-4
由图7和图8可以看出,ALAC-3和ALAC-4的EB-DNA体系的荧光特征峰分别为425 nm和426 nm。在荧光特征峰处,随着抑菌物质浓度的增加,荧光强度明显降低且ALAC-4降低的幅度大于ALAC-3,说明ALAC-4所产抑菌物质取代EB进而与DNA结合的能力强于ALAC-3。
EB与DNA的结合的可能方式主要有:与带负电荷的DNA骨架磷酸基团之间的静电作用以及与DNA沟槽的嵌入作用。因此可以通过测定EB-DNA体系的荧光光谱来观察荧光强度的变化,进而确定抑菌物质与DNA的结合方式[6]。这表明加入的抑菌物质与EB竞争结合DNA,抑菌物质取代了EB-DNA体系中的EB,从而使荧光强度降低[6]。这充分说明抑菌物质与酵母菌DNA发生了嵌入结合。
2.4EB对复合体系抑菌物质-DNA相互作用的荧光光谱
用不同浓度的EB与抑菌物质-DNA复合体系反应,从而研究了荧光光谱的变化。结果见图9、图10。
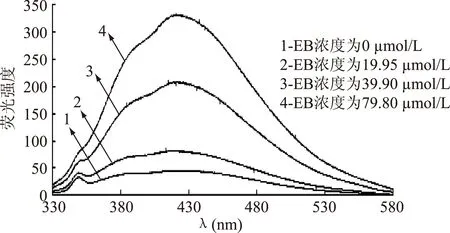
图9 ALAC-3 EB对复合体系抑菌物质-DNA 相互作用的荧光光谱Fig.9 Fluorescence spectra of the interaction between EB and ALAC-3 antiyeast substance-DNA
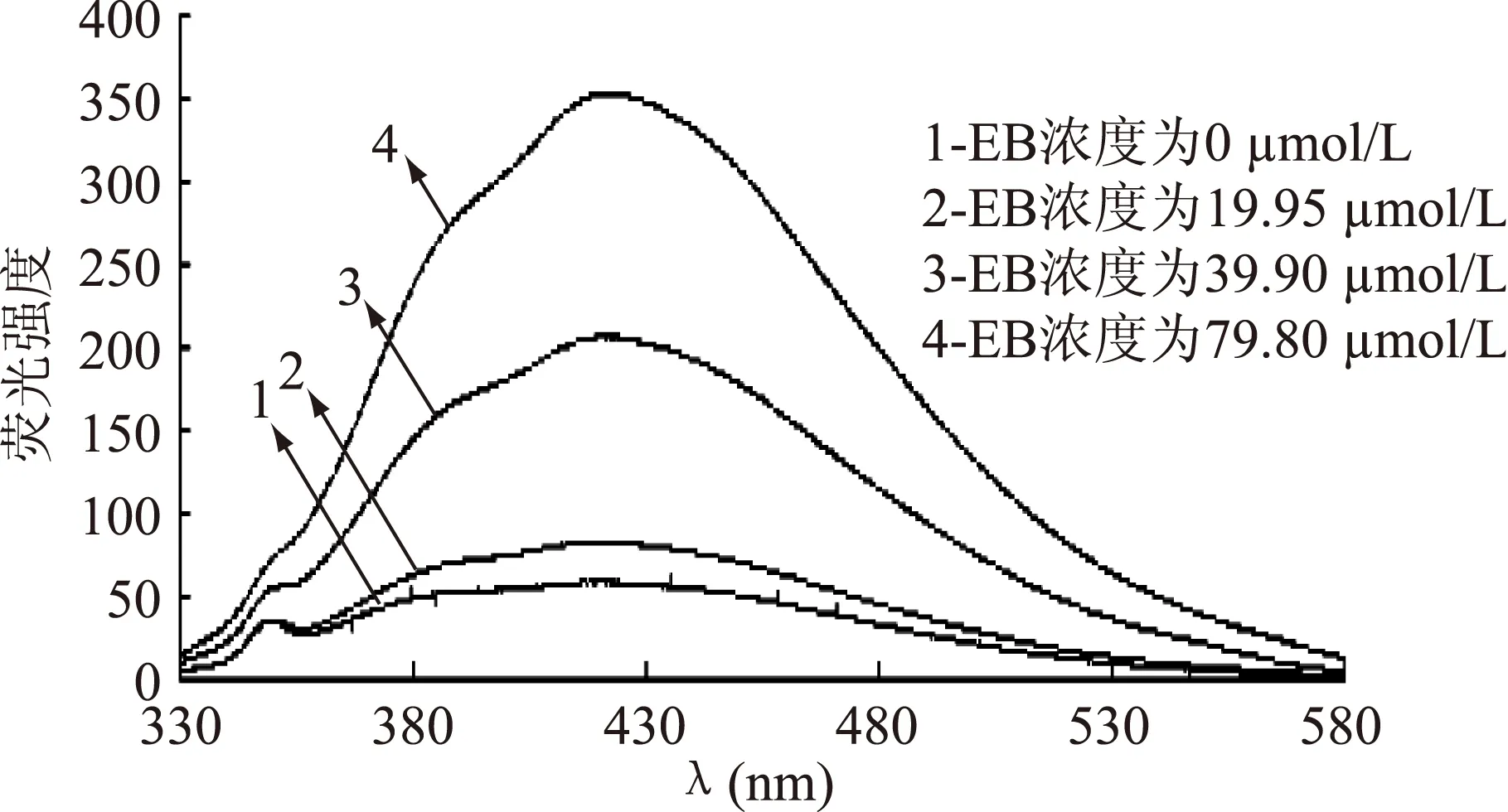
图10 ALAC-4 EB对复合体系抑菌物质-DNA 相互作用的荧光光谱Fig.10 Fluorescence spectra of the interaction between EB and ALAC-4 antiyeast substance-DNA
从图9和图10中可以看到,随着EB浓度的增大,抑菌物质-DNA复合体系的特征荧光峰逐渐升高,这表明EB逐渐取代了抑菌物质,形成了EB-DNA的复合体系,从而使荧光峰升高。结果说明了溶液体系存在抑菌物质-DNA与EB-DNA两个复合体系竞争。
3 结论
本研究通过紫外光谱和荧光光谱法研究了乳杆菌所产抑菌活性物质与酵母菌DNA的相互作用机制,结果显示乳杆菌所产抑菌物质可与酵母菌DNA发生相互作用。酵母菌DNA与乳杆菌所产抑菌活性物质反应后,其紫外吸收值减小,产生了减色效应;随着作用时间的延长,紫外吸收值增加,呈现增色效应,说明抑菌物质与酵母菌DNA表面的磷酸基团通过静电作用相结合,使DNA的空间构象发生变化,再进一步与DNA双螺旋链的沟槽结合。抑菌物质与酵母菌DNA反应,其荧光强度降低,说明抑菌物质与酵母菌DNA之间存在嵌入作用。抑菌物质与EB-DNA复合体系反应,其荧光强度降低,说明抑菌物质取代EB与酵母菌DNA结合。EB与抑菌物质-DNA复合体系反应,其荧光强度增加,说明溶液体系存在抑菌物质-DNA与EB-DNA两个复合体系竞争。通过紫外光谱和荧光光谱显示,ALAC-4对酵母菌DNA的作用大于ALAC-3。
[1]何国庆,贾英民,丁立孝.食品微生物学[M].北京:中国农业大学出版社,2010:38-43.
[2]Gulahmadov S G,Abdullaeva N F,Guseinova N F,et al.Isolation and characterization of bacterioCin-like inhibitory Substances from lactic acid bacteria isolated from azerbaijan Cheeses[J].Applied Biochemistry and Microbiology,2009,45:266-271.
[3]宋宏霞,曾名勇,刘尊英,等.抗菌肽的生物活性及其作用机理[J].食品工业科技,2006,27(9):185-188.
[4]郭本恒. 益生菌[M].北京:化学工业出版社,2004:5-120.
[5]陈忠军,李海瑄,高鹤尘.乳杆菌产生的抑菌活性物质对酵母细胞膜通透性的影响[J].中国乳品工业,2015,43(2):28-31.
[6]宫霞,施用晖,乐国伟.抗菌活性肽与细菌染色体DNA的相互作用机理[J].自然科学进展,2004,14(5):509-513.
[7]沈萍,范秀容,李广武.微生物学实验(第三版)[M].北京:高等教育出版社,1999:214-222.
[8]RE布坎南,N E吉本斯,等.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984.
[9]戈海泽,郭刚,张瑞,等.玻璃珠法提取基因组DNA[J].天津医科大学学报,2006,12(2):313-314.
[10]翟培,韩晋辉,侯丽霞,等.家蝇抗菌肽的抑菌动力学研究及其机理初探[J].中国生物工程杂志,2006,26(11):33-39.
[11]Erkkila KE,Odom DT,Barton JK Recognition and reaction of metallointercalators with DNA[J]. Chem Rev,1999,99(9):2777-2796.
[12]Zhang LZ,Tang GQ.The binding properties of photosensitizer methylene blue to herring sperm DNA:a spectroscopic study[J]. J Photochem Photobiol B,2004,74(2-3):119-125.
[13]Dong C,Wei YX,Wei YL. Study on the interaction between methylene violet and calf thymus DNA by molecular spectroscopy[J]. J Photochem Photobiol A,2005,174(1):15-22.
[14]S. Kashanian S,Askari F,Ahmadi K,et al. Tarighat,DNA Cell Biol,2008,27:581.
[15]陈忠军,高鹤尘,李海瑄.乳杆菌代谢产生抑菌物质的特性研究[J].中国乳品工业,2015,43(3):11-14.
Study on unteraction mechanism of antiyeast substance produced by lactobacillus and the yeast DNA
CHEN Zhong-jun,LIU Jing
(Inner Mongolia Agricultural University,College of food science and Engineering,Hohhot 010018,China)
Two strains of lactobacillus ALAC-3 and ALAC-4 being of strong antiyeast ability were studied. TakingCandidaalbicansas the indicator strain,the interaction of antiyeast substance produced by lactobacillus and yeast DNA was investigated by ultraviolet spectrometry and fluorescence spectrometry. The results showed that the ultraviolet absorption value was decreased significantly and hypochromism were observed after adding anti-bacterial substances. With the extension of time,the ultraviolet absorption value was increased and hyperchromism were observed. The fluorescence intensity was decreased after adding anti-bacterial substances. When anti-bacterial substances and EB-DNA was reacted with each other,the fluorescence intensity was decreased significantly. And the fluorescence intensity was increased after EB and anti-bacterial-DNA was reacted. It indicated that there was the competition of anti-bacterial-DNA and EB-DNA in the solution system.
Lactobacillus;antiyeast substance;DNA;UV spectrometry;fluorescence spectrometry
2015-08-31
陈忠军(1971-),女,博士,教授,从事食品微生物及发酵工程的研究,E-mail:nmndchen@126.com。
国家自然科学基金(31260390)。
TS201.3
A
1002-0306(2016)05-0159-05
10.13386/j.issn1002-0306.2016.05.022

