枸杞多糖对精神分裂症模型大鼠海马中G luR1表达及认知功能的影响
陈宇薇,赵晓华,黄鹏
[1.广州医科大学附属脑科医院(广州市惠爱医院)精神科,广东 广州 510370;2.南方医科大学中医药学院,广东 广州 510515]
论著
枸杞多糖对精神分裂症模型大鼠海马中G luR1表达及认知功能的影响
陈宇薇1,赵晓华2,黄鹏1
[1.广州医科大学附属脑科医院(广州市惠爱医院)精神科,广东 广州 510370;2.南方医科大学中医药学院,广东 广州 510515]
目的探讨枸杞多糖(LBP)对精神分裂症模型(Sz)大鼠海马中G luR 1表达及认知功能影响。 方法选取36只健康SD大鼠,随机分3组,每组12只,分别为正常对照组、模型组及药物干预组(Sz+LBP)。Sz及Sz+LBP腹腔注射地卓西平马来酸盐0.6mg/(kg·d),连续注射14 d制造精神分裂症模型,Sz+LBP同时灌胃枸杞多糖100mg/(kg·d)。正常对照组在相应时段注射等剂量的正常生理盐水。造模成功后,分别评估各组大鼠的行为学改变,进行M orris水迷宫,比较3组大鼠的定位航行和空间探索时间以及采用免疫荧光染色、W estern blot法测定海马中GluR 1蛋白的表达。结果Sz的运动量、共济失调、刻板行为评分以及海马中GluR 1均高于正常对照组(P<0.01),Sz+LBP的运动量、共济失调及刻板行为评分均低于Sz,明显抑制精神分裂症大鼠海马中GluR1的表达(P<0.01)。结论枸杞多糖对精神分裂症模型大鼠海马具有保护作用,其机制与海马中GluR 1表达来改善其认知功能相关。
枸杞多糖;精神分裂症;海马;GluR 1;认知功能。
精神分裂症是一种严重危害人群健康且认知缺陷发生率非常高的重性精神病之一[1-2]。精神分裂症给患者和社会带来了严重的困扰,其原因是对其病因和发病机制的研究尚未明确。对于精神分裂症的假说众说纷纭,其中精神分裂症谷氨酸(Glutamate,Glu)功能紊乱假说最为流行,认为精神分裂症患者N-甲基 -D-天冬氨酸(N-Methyl-D-aspartic acid,NMDA)受体缺陷诱导的Glu系统功能紊乱是精神分裂症的主要病理机制。并且研究发现给予动物NMDA受体竞争性拮抗剂或非竞争性拮抗剂,均可引起与精神分裂症(Schizophrenia,Sz)类似的异常行为[3-4]。枸杞多糖(lycium barbarrum polysaccharides,LBP)从枸杞子中提取出来的,是中药枸杞子的重要活性成分。研究发现LBP具有调节免疫、抗氧化以及延缓衰老等多种功效,尤其是对神经系统具有非常重要的保护功能[5]。本研究旨在通过建立地卓西平马来酸盐(Dizocilpine,MK-801)诱导的精神分裂症模型,探讨枸杞多糖对海马的保护作用及可能机制,为临床预防和治疗精神分裂症提供实验依据。
1 材料与方法
1.1动物
选取鼠龄为8周(体重220~240 g)的健康雄性SD大鼠36只,由南方医科大学动物实验中心提供。动物饲养室温为(20±2)℃,湿度为43%~45%,常规的自由摄食饮水,将动物适应性喂养1周后开始进行实验。
1.2药品与试剂
枸杞多糖购自广州广修堂医药科技有限公司,含量≥30%,MK-801购于美国Sigma公司,兔抗大鼠Anti-谷氨酸受体1(glutamate receptor 1,GluR1)抗体购自英国Abcam公司,山羊抗兔二抗购自美国Santa Cruz生物技术公司。
1.3实验动物分组及模型的建立
健康雄性SD大鼠随机分为正常对照组、模型组(Sz)和药物干预组(Sz+LBP),每组各12只。模型组(Sz)和药物干预组(Sz+LBP)腹腔注射MK-801 0.6mg/(kg·d)[6]连续注射14 d;同时药物干预组灌胃给予枸杞多糖100mg/(kg·d)正常组以等容量生理盐水同时注射。
1.4运动量的评价
饲养14 d后,监测给药以后各组大鼠60min内的运动量的差异。具体方法:将各组大鼠放入监测室里透明的塑料盒内(规则35 cm×35 cm×25 cm),适应环境30min后注射给药(MK-801)。每只大鼠每5min的运动情况将自动记录保存在计算机上。
1.5评估刻板行为和共济失调程度
参考SAMS-DODD[7]的刻板行为评分标准,采用的是5级评分,进行盲法评分,取其平均分,然后进行统计。评分越高,说明精神分裂症症状越重。参考HOFFMAN[8]的共济失调评分标准,共济失调本研究用4级评分,每10min评分1次。进行盲法评分,取其平均分,然后进行统计。进行盲法评分,取其平均分,然后进行统计。评分越高,说明精神分裂症症状越重。
1.6Morris水迷宫实验
在(30±2)℃水池内各组大鼠自停药后第l天实施水迷宫实验,由计算机监视系统同步记录各组大鼠的运动轨迹。①定位航行实验:造模后一共测试3 d,每天测试6次大鼠寻找平台的学习能力的检测。每天上午8︰00~12︰00对各组大鼠进行训练和测试,具体方法:将平的站台放在水池的中央,随机从4个象限标记好的入水点将大鼠面向池壁慢慢地放入水中,电脑软件将记录大鼠搜索站台轨迹,从大鼠入水游泳直到找到并爬上平台所游过的距离。记录在平台象限内的游泳时间,共4次,取平均值。②空间探索实验:撤走池内平台,将大鼠从原入水点面向池壁放入池中。计算机将记录大鼠在60 s内穿越平台区域的次数和在平台象限内的游泳时间用于测试大鼠的空间记忆能力,共4次,取平均值。
1.7蛋白免疫印迹法(Western blot)检测
实验通过Western blot实验方法对海马不同区域组织的GluR1表达量进行比较。大鼠在末次游泳实验后30min迅速断头处死,取出脑组织。游离右侧海马,放置-80℃冰箱保存,具体方法:①4℃将海马区切片,裂解分离CA1区组织,然后经匀浆液离心,提取CA1区总蛋白,接着离心总蛋白,最后超声波裂解,从裂解液中分离提取生物化蛋白;②组织匀浆后提取蛋白成分变性,蛋白样品通过聚丙烯酰胺凝胶(积层胶浓度6%,分离胶浓度10%)电泳2 h,将分离的蛋白转移到聚偏氟乙烯膜上(湿转300ma,1.5 h或110 V,1 h);③转膜后,将膜置于3%牛血清白蛋白溶液中孵育;④加一抗Anti-GluR1抗体(1∶1 000),孵育(4℃,过夜),TBST洗一抗;⑤加二抗HRP抗体(1∶1 000)孵育(室温,40min),TBST洗二抗,发光。采用NIH ImageJ软件进行图像分析。采用软件Imagine分析图像灰度,检测各组样品中海马CA1区突触膜上GluR1的表达量,后续统计。
1.8免疫荧光染色
心脏灌流法采集脑组织标本。切片的厚度为18μm,贴于挂胶的载玻片,置于-80℃冰箱备用。实验前,将切片置于室温放置1 h,具体方法:①0.01 mol/L磷酸缓冲盐溶液(phosphate buffer saline,PBS)溶液冲洗3次,每次3min;②0.2%Triton-X100 37℃孵育30min,PBS冲洗;③加一抗(1∶100),4℃冰箱过夜;④PBS冲洗,加入荧光标记的二抗(1∶100),放入37℃恒温箱温育1 h,PBS冲洗。滴加荧光封片剂,封片。荧光显微镜进行观察拍摄,利用图像分析系统进行分析。
1.9统计学方法
用SPSS 22.0统计软件进行数据处理,计量数据用均数±标准差()表示,3组间差异比较首先采用方差分析,在有意义的基础之上,两组间差异比较采用两样本均数的t检验,P<0.05为差异有统计学意义。
2 结果
2.1运动量的评价
将正常对照组,模型组,药物干预组大鼠60min内运动量进行分析。结果显示:3个比较组行方差分析,可见差异有统计学意义;行两两比较发现模型组均高于对照组,LBP组大鼠低于模型组。见表1。
2.2刻板行为和共济失调评估
结果显示:刻板行为和共济失调评分差异均有统计学意义,模型组高于正常对照组。共济失调程度呈现同样的趋势。见表2、表3。
2.3海马G luR1的表达
如图1所示,正常对照组海马GluR1的表达量为0.453,模型组为0.782,药物干预组为0.569。
表1 各组大鼠运动量的评价 ()
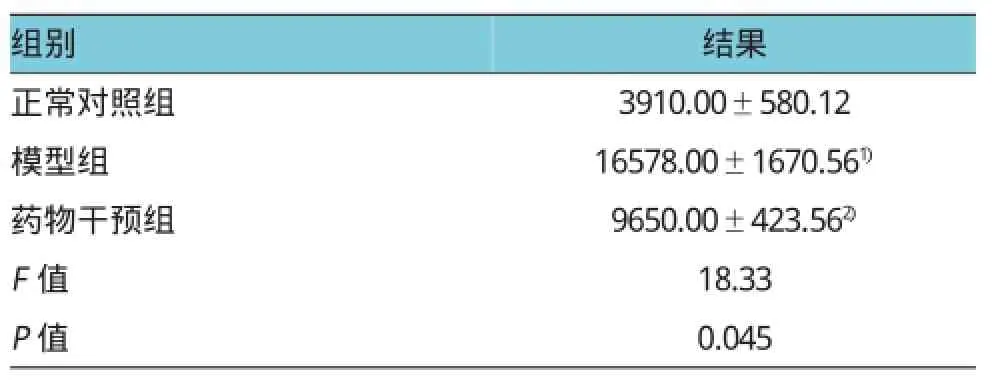
表1 各组大鼠运动量的评价 ()
注:1)与正常对照组比较,差异有统计学意义(t=-57.204,P=0.032);2)给药之后,与模型组比较症状有所改善,差异有统计学意义(t=30.454,P=0.025)
?
表2 大鼠刻板行为的变化(n=36,分,)
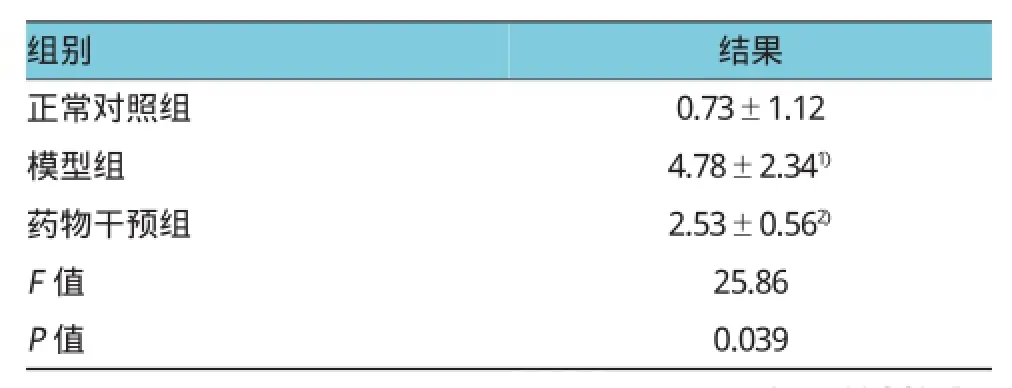
表2 大鼠刻板行为的变化(n=36,分,)
注:1)与正常对照组比较,差异有统计学意义(t=-11.361,P=0.047);2)给药之后,与模型组比较症状有所改善,差异有统计学意义(t=7.055,P=0.032)
结果正常对照组 0.73±1.12模型组 4.78±2.341)药物干预组 2.53±0.562)F值 25.86 P值 0.039组别
表3 大鼠共济失调的变化(n=18,分,)

表3 大鼠共济失调的变化(n=18,分,)
注:1)与正常对照组比较,差异有统计学意义(t=-10.129,P=0.021);2)给药之后,与模型组比较症状有所改善,差异有统计学意义(t=3.201,P=0.008)
结果正常对照组 0.43±0.13模型组 2.03±0.781)药物干预组 1.23±0.522)F值 36.79 P值 0.028组别

图1 海马GluR1的表达
2.4海马G luR1阳性神经元的表达
正常对照组海马GluR阳性神经元的表达量为19.000,模型组为43.000,药物干预组为35.000。见图2。
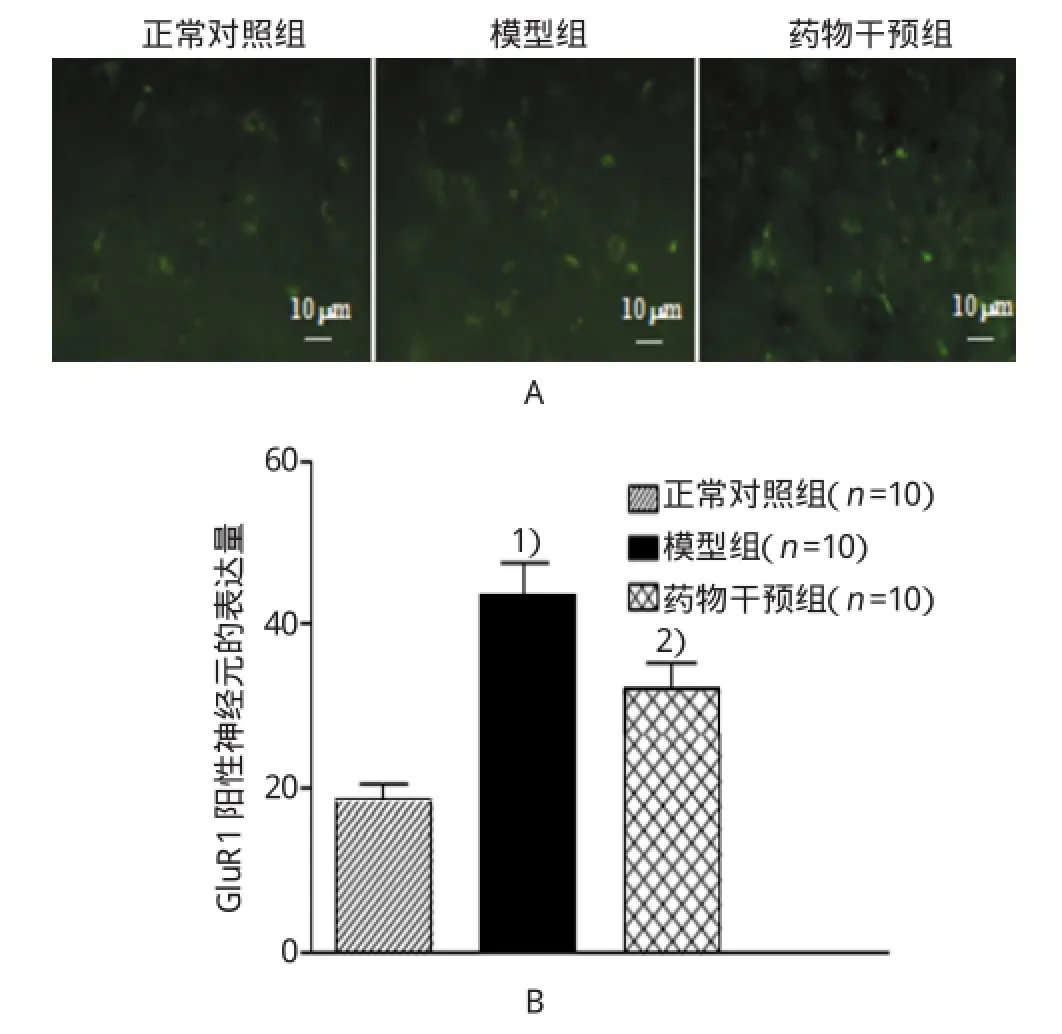
图2 海马G luR阳性神经元的表达
3 讨论
精神分裂症是一种较常见的精神疾病,涉及思维、情感和行为等多方面的障碍,以精神活动与环境不胁凋为特征[9-10]。临床研究发现在精神分裂症患者中认知缺陷的发生率高,约85%患者出现认知功能方面的障碍[11]。临床上使用的药物在治疗过程中易出现不良反应和镇静、体位性低血压与植物神经紊乱的不良反应。因此,探索寻找疗效好、副作用小的抗精神分裂症的中草药非常迫切,目前我国国内尚未有人具体探讨中药治疗精神分裂症的基础实验研究。因此,对于建立合理的动物模型,选取合理的药物干预并对其发病机制进行系统深入的研究非常有意义。本文利用dizocilpine(MK-801)是高亲和力的NMDA受体非竞争性拮抗剂,制备精神分裂症模型,探讨精神分裂症对认知功能的影响。
本研究连续14 d给大鼠腹腔注射MK-801,监测各组大鼠的运动量的变化和精神状态,结果发现对照组大鼠行为活动均正常,而模型组大鼠均出现持续、无目的、迅速的追尾运动。枸杞多糖干预组大鼠活动明显有所改善(表1、表2)。此结果与ANDINE等[12]给药诱发大鼠精神分裂症发生后的行为学改变一致。此外,模型组大鼠还出现拟精神分裂症症状如:向一边倾斜、走路不稳、反复跌倒、重复抬头、摇头或旋转、尖叫等。笔者对各组大鼠的异常行进行评估,结果发现模型组大鼠的共济失调与刻板行为评分均高于正常对照组,此结果与YAMAGUCHI[13]相关研究结果一致。证明MK-801诱导产生类似精神分裂症的模型非常成功。枸杞多糖干预后,上述症状均有所改善。说明枸杞多糖对精神分裂症有一定的治疗作用。
中枢神经系统的谷氨酸受体包括α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid,AMPA)受体和NMDA受体。其中AMPA受体的数量决定了突出后神经元兴奋的程度,是中枢神经系统影响突触传递的主要决定因素.它在突触后膜区和突触后膜外区存在的数量比的稳定性,并在学习与记忆功能中发挥重要作用,对于大脑信息的储存是具有非常重要的意义[14-15]。GluR1是AMPA受体最主要的受体,因此研究其在精神分裂症模型中的机制尤为重要。本研究发现精神分裂症模型大鼠海马区GluR1的表达量较正常组明显增加,枸杞多糖干预后,精神分裂症大鼠海马区及CA1区突触膜蛋白中GluR1的表达量降低。因此认为LBP对认知的保护作用可能与CA1区突触膜上GluR1表达量的较少有关。
综上所述,本次实验主要通过选取枸杞多糖为干预药物,建立合理的精神分裂症大鼠模型,探讨枸杞多糖对精神分裂症认知功能的影响及其作用机制,为精神分裂症的临床药物治疗提供了实验数据,并对精神分裂症治疗提供了新靶点。即枸杞多糖能够保护精神分裂症大鼠的认知功能,其具体机制可能与GluR1在海马区总蛋白及海马CA1区突触膜蛋白中的表达量有关。
[1]AL U STIZA I,RADUA J,ALBAJES-EIZAGIRRE A,et al. Meta-analysis of functional neuroimaging and cognitive control studies in schizophrenia:preliminary elucidation of a core dysfunctional timing network[J].Front Psychol,2016,17(7):192.
[2]ROSSLER W,SALIZE H J,OS J V,et al.Size of burden of schizophrenia and psychiatric disorders[J].Eur.Neuropsychopharmacol,2005,(15):399-409.
[3]WOO T U,CROWELL A L.Targeting synapses and myelin in the prevention of schizophrenia[J].Schizophr Res,2005,73(2/3): 193-207.
[4]WU H,WANG X,GAO Y,et al.NMDA receptor antagonism by repetitive MK801 administration induces schizophrenia-like structural changes in the rat brain as revealed by voxel-based morphometry and diffusion tensor imaging[J].Neuroscience,2016, 322:221-233.
[5]LAM C S,TIPOE G L,SO K F,et al.Neuroprotective mechanism of Lycium barbarum polysaccharides against hippocampal-dependent spatial memory deficits in a rat model of obstructive sleep apnea[J].PLoS One,2015,10(2):DOI:10.1371/journal.pone.0117990.
[6]LINS B R,PHILLIPS A G,HOWLAND J G.Effects of D-and L-govadine on the disruption of touchscreen object-location paired associates learning in rats by acute MK-801 treatment[J]. Psychopharmacology(Berl),2015,232(23):4371-4382.
[7]SAMS-DODD F.MK-801 and phencyclidine induced neurotoxicity do not cause enduring behaviours resembling the positive and negative symptoms of schizophrenia in the rat[J].Basic Clin Pharmacol Toxicol,2004,95(5):241-246.
[8]HOFFMAN D C.Typical and atypical neumleptics antagonize. MK-801-induced locomotion and stereotypy in rats[J].J Neural Transm Gen Sect,1992,89(1/2):1-10.
[9]NGUYEN A,FROBERT L,MCCLUSKEY I,et al.Development of the positive emotions program for schizophrenia:An intervention to improve pleasure and motivation in schizophrenia[J].Front Psychiatry,2016,7(4):911-913.
[10]POPOLO R,DIMAGGIO G,LUTHER L,et al.Theory of mind in schizophrenia:associations with clinical and cognitive insight controlling for levels of psychopathology[J].J Nerv Ment Dis, 2016,204(3):240-243.
[11]DAMILOU A,APOSTOLAKIS S,THRAPSANIOTI E,et al. Shared and distinct oculomotor function deficits in schizophrenia and obsessive compulsive disorder[J].Psychophysiology,2016,53 (6):796-805.
[12]ANDINÉP,WIDERMARK N,AXELSSON R,et al.Characterization of MK-801-induced behavior as a putative rat model of psychosis[J].J Pharmacol Exp Ther,1999,290(3):1393-1408.
[13]YAMAGUEHI M,SUZUKI T,SEKI T,et al.Decreased cell proliferation in the dentate gyms of rats after repeated administration of cocaine[J].Synapse,2005,58(2):63-71.
[14]MAHER B J,MACKINNON R L,BAI J,et al.Activation of postsynaptic Ca(2+)stores modulates glutamate receptor cycling in hippocampal neurons[J].J Neurophysiol,2005,93(1):178-188.
[15]MEYER G,VAROQUEAUX F,NEEB A,et al.The complexity of PDZ domain-mediated interactions at glutamatergic synapses: a case study on neuroligin[J].Neuropharmacology,2004,47(5): 724-733.
(张西倩编辑)
Effect of Lycium barbarrum polysaccharides on hippocam pal GluR1 and cognitive function of schizophrenia rats
Yu-wei Chen1,Xiao-hua Zhao2,Peng Huang1
[1.Department of Psychiatry,the Affiliated Brain Hospital of Guangzhou Medical University,(Guangzhou Huiai Hospital),Guangzhou,Guangdong 510370,China;2.Traditional Chinese Medical College of Southern Medical University,Guangzhou,Guangdong 510515,China]
Objective To exp lore the effect of Lycium barbarrum polysaccharides(LBP)on receptor 1 of glutamic acid(GluR1)in hippocampus and cognitive function of schizophrenia rats.Methods Thirty-six SD rats were randomly divided into 3 groups with 12 in each group:normal group,model group and LBP group.Model group and LBP group were given MK801(0.6mg/kg·d)with sinistro-intraperitoneal injection to set the schizophrenia model.At the same time,LBP group was administered intragatrically with 100 mg/kg·d LBP.The control group was injected with 0.9%saline(NS)in the corresponding period.The behavioral changes of each ratwere separately assessed with Morris experiment,and the navigation and time space exploration were compared between the three groups.Using immunofluorescence and Western blot,the GluR1 protein expression in hippocampus was determined.Results The model group had higher amount of exercise,ataxia,stereotyped behavior score and GluR1 expression in hippocampus than the control group(P<0.01).LBP group had significantly lower amount of exercise,ataxia,stereotyped behavior score and GluR1 expression in hippocampus than the model group(P<0.01).ConclusionsLBP plays a protective role for schizophrenia,its mechanism may be due to down-regulation of GluR1 expression in the hippocampus of schizophrenia rats.
Lycium barbarrum polysaccharide;schizophrenia;hippocampus;glutamate receptor 1;cognitive function
R 749
A
10.3969/j.issn.1005-8982.2016.14.004
1005-8982(2016)14-0017-05
2016-03-27

