雌激素受体α、雌激素受体β、激活蛋白1、血管内皮生长因子在大鼠子宫内膜异位症模型中的表达及意义*
李鹏程,刘玉玲,党群,刘慧丽,王冬亮,汤福想,郭沛沛,刘学友
(1.郑州大学第二附属医院 妇产科,河南 郑州 450014;2.河南省人民医院,河南 郑州 450003)
论著
雌激素受体α、雌激素受体β、激活蛋白1、血管内皮生长因子在大鼠子宫内膜异位症模型中的表达及意义*
李鹏程1,刘玉玲1,党群2,刘慧丽2,王冬亮1,汤福想1,郭沛沛1,刘学友1
(1.郑州大学第二附属医院 妇产科,河南 郑州 450014;2.河南省人民医院,河南 郑州 450003)
目的探讨雌激素受体α(ERα)、雌激素受体β(ERβ)、激活蛋白1(AP-1)、血管内皮生长因子(VEGF)在大鼠子宫内膜异位症(EM s)模型中的表达及意义。方法采用皮下种植法建立大鼠EM s模型,选取建模成功的28只大鼠为模型组(n=28),观察大鼠EMs模型在位内膜及异位病灶的组织病理学改变,并通过免疫组织化学法检测对照组子宫内膜、模型组在位子宫内膜和异位病灶ERα、ERβ、AP-1、VEGF的表达情况。结果①大鼠EM s模型在位内膜及异位病灶腺体、间质血管明显增加;②大鼠EMs模型的异位病灶与对照组子宫内膜间ERα阳性率比较,差异无统计学意义(P=0.107),而其在位内膜中的表达较对照组比较,差异有统计学意义(P<0.01)。ERβ、AP-1(c-jun)蛋白、VEGF在模型组在位内膜及异位病灶中阳性率与对照组比较,差异有统计学意义(P<0.01),但其在位内膜及异位病灶中的表达比较,差异无统计学意义。结论大鼠EM s模型在位内膜中ERα和ERβ均高表达,异位病灶中则仅表现为ERβ高表达,同时上调c-jun,VEGF的表达,ERβ可能在EM s的发生发展中起到较ERα更为重要的作用。
子宫内膜异位症;动物模型;雌激素受体亚型;激活蛋白1
子宫内膜异位症(Endometriosis,EMs)是一种雌激素依赖性疾病,严重影响育龄期妇女的生活质量及生育能力。关于其发病机制,SAMPSON最先提出经血逆流学说,而后郎景和院士提出“在位内膜决定论”[1]认为EMs的在位子宫内膜与非子宫内膜异位症存在本质上的不同。其分子生物学行为可能源于雌激素暴露,作用于雌激素受体(estrogen receptor,ER),启动对应的信号通路,多条信号通路相互作用的结果促进了逆流的子宫内膜在宫腔以外生长。激活蛋白1(activator protein 1,AP-1)是一种重要的核转录调控因子,参与细胞增殖、分化和凋亡等多种生理过程,雌激素与ER结合后,依赖ER转导通路,调节转录因子(如AP-1、NF-кB)的活性,进而调控相应细胞因子的表达,促进EMs的形成和发展。大量研究证据显示,血管内皮生长因子(vascular endothelial growth factor,VEGF)在EMs的发生发展中有重要作用,但与有关信号传导途径的研究结果尚不明确。本研究通过建立大鼠EMs模型,应用免疫组织化学检测正常大鼠子宫内膜、大鼠EMs模型异位病灶及在位子宫内膜中ERα,ERβ,AP-1(c-jun蛋白)、VEGF的表达,探讨雌激素受体亚型、AP-1、VEGF在大鼠EMs模型中的表达特点及意义。
1 材料与方法
1.1材料来源
河南省动物实验中心购买的清洁健康雌性未孕的SD大鼠60只。鼠龄60~90 d,体重220~250 g,实验的各研究组大鼠的鼠龄、质量之间均无明显差异。兔抗大鼠ER α、ER β、c-jun、VEGF多克隆抗体,免疫组织化学试剂盒购自北京博奥森生物技术有限公司。
1.2方法
1.2.1构建大鼠EM s模型观察大鼠的正常发情周期,选取连续观察2个正常发情周期的大鼠进行建模。建模前1天均肌注苯甲酸雌二醇0.2mg/(kg· d),使大鼠处于发情期,皮下移植法建立子宫内膜异位症的动物模型[2]。具体方法:供体大鼠称重,10%水合氯醛(0.3ml/100 g)腹腔麻醉,固定,常规腹部备皮,消毒铺巾,取尿道口上方大概10mm处行约3 cm的垂直正中纵切口开腹进入腹腔,在膀胱下可见子宫呈“Y”形,近端在离宫角约10mm处结扎,远端在离卵巢约20mm处结扎,切除子宫,放入磷酸盐缓冲液中洗涤,切开管形子宫,剥除浆膜层、肌层,将剥除的子宫内膜剪为5mm×5mm大小的片段;采用皮下种植法将子宫内膜片段植入受体大鼠的腹肌和皮下筋膜之间,使内膜面紧贴腹肌进行皮下建模术,同时取部分内膜组织送病理检查以确认为大鼠子宫内膜组织,最后关腹。术后3 d常规进行硫酸庆大霉素0.1ml肌肉注射预防感染。术后常规喂养3周,进行2次开腹,观察移植子宫内膜(异位病灶)的生长情况。构建模型成功的标准:病理组织学证明为大鼠子宫内膜组织,移植物呈囊性生长增大,囊壁有新鲜血管形成、少许结缔组织,囊泡内有清亮或黄色液体。
1.2.2实验分组及标本处理随机选取同一批次10只正常雌性大鼠作为对照组(喂养条件与术后实验组相同),选取建模成功的大鼠28只(2只为无效造模)作为实验组,在消毒、无菌条件下取模型组大鼠异位病灶组织、在位子宫内膜及对照组子宫内膜,分别固定于4%多聚甲醛,石蜡包埋,将蜡块连续切片,厚4μm,部分常规苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,部分用免疫组织化学法检测ER α,ER β,AP-1(c-jun蛋白)、VEGF的表达情况。
1.2.3免疫组织化学检测及结果判定采用免疫组织化学链霉亲和素 -生物素复合物(strept avidin-biotin complex,SABC)法,本实验中用磷酸缓冲盐溶液代替一抗,呈阴性,严格按照试剂盒操作说明进行,脱蜡、灭活内源性酶、封闭,一抗、二抗反应后二氨基联苯胺显色并脱水后镶埋,充分干燥后采用半定量标准判定免疫组织化学的阳性结果:每个石蜡标本取4张切片,每张切片镜下随机取5个(×400)视野,综合染色强度及细胞核中阳性细胞的百分比进行判定,抗体效应物为棕褐色或棕黄色。阳性细胞染色深度评分标准:淡黄色1分,棕黄色2分,棕褐色3分;阳性细胞所占比例评分标准:1%~10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分;两者乘积≥3分为阳性,各组所有视野的平均分作为最终的评定标准,计算各组的阳性率。
1.3统计学方法
采用SPSS 20.0统计软件进行数据分析,计数资料用百分比或率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1大鼠EMs组织病理学特征
大鼠EMs模型异位病灶呈囊性生长增大,囊壁有新鲜血管形成、少许结缔组织,囊泡内有清亮或黄色液体。组织病理学可见异位子宫内膜腺体生长良好,分散排列,囊腔可见炎症细胞,间质富含血管,固有腺体较多,呈扩张状改变。腺体数目较在位内膜少。见图1。(异位病灶镜下见较多脂肪组织因皮下建模的缘故)。
2.2对照组、模型组在位子宫内膜及异位病灶中ER α、ER β、c-jun、VEGF蛋白的表达
免疫组织化学结果显示ER α、ER β、c-jun、VEGF在大鼠子宫腺上皮细胞、腔上皮细胞及间质细胞内均有表达,其中以腺上皮细胞表达显著,阳性表达呈棕色颗粒。整体来说ER α比ER β表现出更明显的阳性率,均表现为棕褐色或棕黄色颗粒。ER α在模型组在位子宫内膜中的表达及ER β、c-jun、VEGF在在位子宫内膜和异位病灶中的表达均较对照组明显增强(P<0.01),但ER α在异位病灶中的表达与对照组比较,差异无统计学意义(P> 0.05),各因子在模型组异位病灶及在位子宫内膜间比较,差异无统计学意义(P>0.05)。见图2~5和表1~4。

图1 建模成功的大鼠子宫内膜异位病灶及在位内膜的组织病理学特征(HE×100)

图2 ER α在各研究组中的表达(SABC×400)
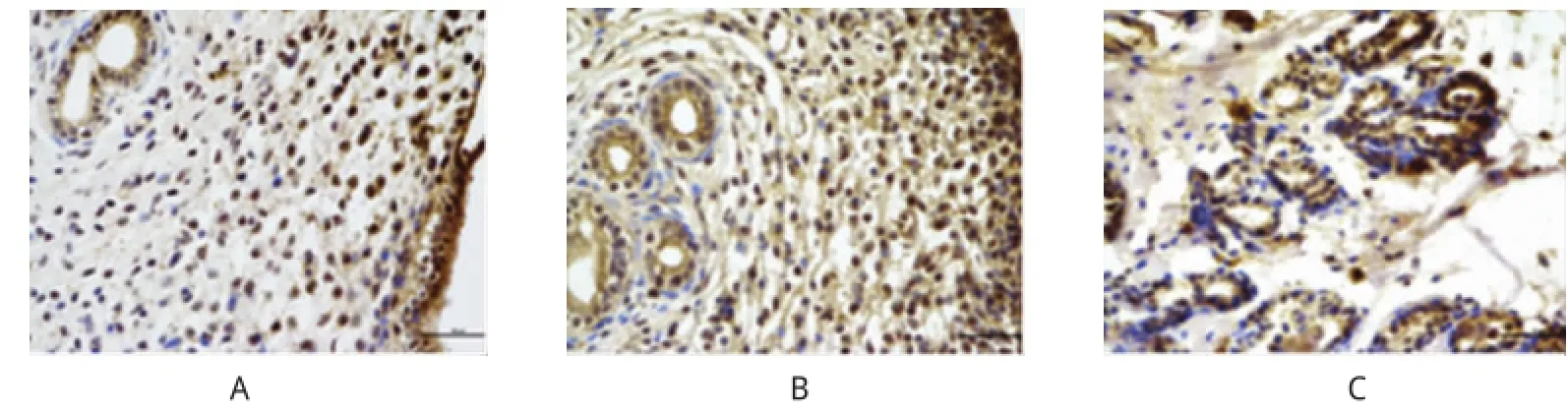
图3 ER β在各研究组中的表达(SABC×400)

图4 c-jun在各研究组中的表达(SABC×400)

图5 VEGF在各研究组中的表达(SABC×400)

表1 ER α蛋白在两组大鼠子宫内膜中的表达情况
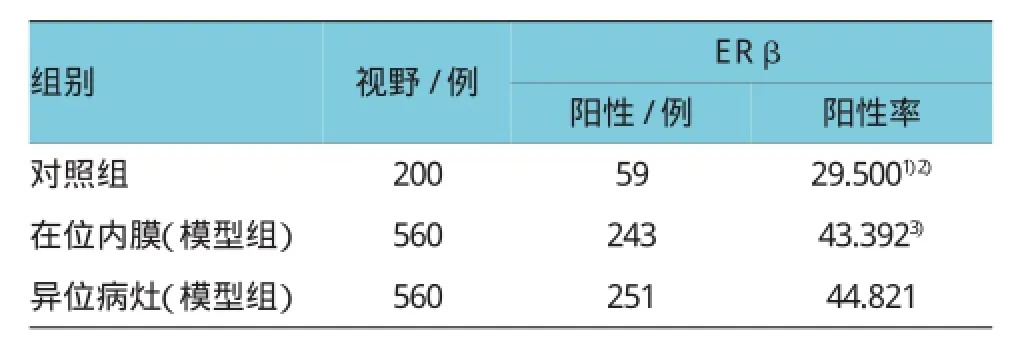
表2 ER β蛋白在两组大鼠子宫内膜中的表达情况

表3 c-jun蛋白在两组大鼠子宫内膜中的表达情况
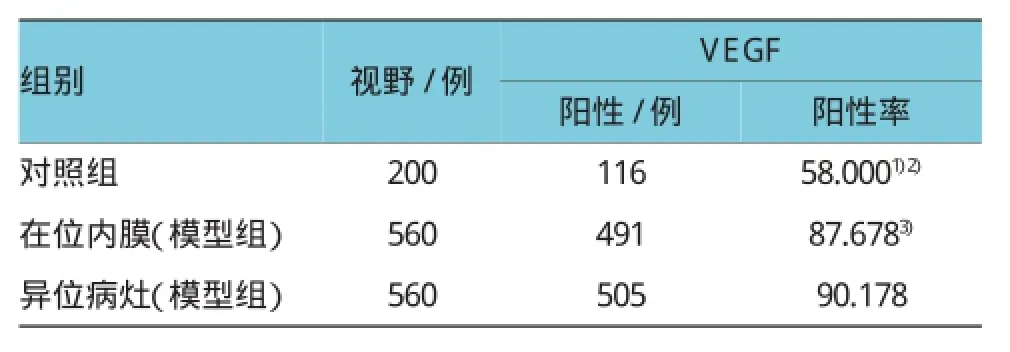
表4 VEGF蛋白在两组大鼠子宫内膜中的表达情况
3 讨论
3.1ER α、ER β与EMs的相关性
EMs是一种雌激素依赖性疾病,雌激素与ER结合促进了异位内膜的侵袭、生长,且造成子宫内膜细胞特殊的生物学性质,郎景和院士提出“在位内膜决定论”[1],认为EMs的在位子宫内膜具有更强的侵袭、黏附、血管形成特性,与正常子宫内膜有明显差异,可随经血逆流入腹腔并极易种植生长,引起EMs的发生发展。
随着ERβ的发现,证明雌激素是通过ER α、ER β发挥调节作用[3],本研究中模型组在位内膜中ERα、ERβ的表达均较对照组显著,异位病灶中ERα的表达未表现出差异,ERβ的表达模型组较对照组显著,验证了“在位内膜决定论”。模型组异位病灶ERβ的表达显著,ER α/ER β比值降低,这与HUDELIST等[4]研究结果一致,异位病灶中ERβ的表达明显增强,ERα的表达相对较弱。有报道ERα在卵巢子宫内膜异位症的在位内膜中表达显著,认为其是卵巢子宫内膜异位症形成和发展的关键[5],而另有报道异位病灶中ERα的周期性改变不明显,甚至消失,ERβ的改变在异位病灶中起主要作用[6-7],本研究证实,在正常子宫内膜、EMs在位子宫内膜及异位病灶中ERα的表达较ERβ强,但只有EMs在位内膜与对照组的比较中ERα的表达差异有统计学意义,其余未显示差异有统计学意义,而ERβ在EMs的异位病灶和在位内膜中表达明显增强,据此推测,ERα是EMs发生的重要前提条件,ERβ决定EMs发生的结局,在位内膜ERα、ERβ的显著表达、异位病灶ERα/ERβ比值的下降,这种表达模式的改变,是促进EMs发生、发展的重要条件,ERβ在EMs的发生、发展中可能起到较ERα更为重要的作用,但是ERα、ERβ间是否存在相互作用以及其复杂的作用机制需要更深入的研究。
3.2ERα、ERβ与AP-1、VEGF的相互作用关系
雌激素作用于ER,通过ER信号转导通路对AP-1进行激活、调控。ER信号转导通路有两种:①基因转录效应;②非基因转录效应:雌激素与ER结合后,主要依赖丝裂原激活蛋白激酶信号传导途径,调节相关转录因子(NF-кB、AP-1等)的表达。高雌激素环境、ER的亚型、组织细胞的类型对AP-1的表达起着重要的作用,与EMs的发生发展关系密切[8]。VEGF在EMs中过表达,促进血管生成、异位内膜细胞增殖,促进子宫内膜细胞黏附、侵袭、血管形成。雌激素作用于ER,VEGF的表达明显增强[9],同时发现其启动子内包含AP-1的结合位点[10],AP-1被激活后,作用于VEGF的转录位点,增强VEGF的表达。本实验中在位内膜ERα、ERβ的显著表达、异位病灶ERα/ERβ比值的下降,AP-1的异常激活,VEGF的显著上调,提示雌激素可能主要作用于ERβ,激活、调控AP-1,上调VEGF,促进EMs的发生、发展。但具体哪一种雌激素作用通路对AP-1进行调控,上调VEGF,需要进一步研究证实。另外ERβ、c-jun、VEGF在大鼠EMs模型的在位内膜和异位病灶子宫内膜的无差异表达,也更证实“在位内膜决定论”的观点。
综上所述:EMs的发病机制尚在研究中,存在颇多争议,雌激素受体表达模式的改变是EMs形成的一个重要方面。目前第3代雌激素受体调节剂巴多昔芬作为治疗EMs的新药逐渐进入人们的视野[2],对ERα、ERβ及其作用通路及ERα、ERβ间复杂的作用机制进行研究,将为EMs的发病机制及临床靶向治疗提供理论依据。
[1]郎景和.子宫内膜异位症发病的“在位内膜决定论”.中华医学会.第八次全国妇产科学学术会议论文汇编[C].中华医学会,2004:2.
[2]吕会娟,刘玉玲,党群,等.巴多昔芬对大鼠子宫内膜异位症的作用及机制[J].中华妇产科杂志,2015(4):291-295.
[3]KUIPER GG,ENMARK E,PELTO-HUIKKO M,et al.Cloning of a novel receptor expressed in rat prostate and ovary[J].Proc Natl Acad Sci USA,1996,93(12):5925-5930.
[4]HUDELIST G,KECKSTEIN J,CZERWENKA K,et al.Estrogen receptor beta and matrix metalloproteinase 1 are coexpressed in uterine endometrium and endometriotic lesions of patients with endometriosis[J].Fertil Steril,2005,84(2):1249-1256.
[5]MATSUZAKI S,FUKAYA T,UEHARA S,et al.Characterization of messenger RNA expression of estrogen receptor-alpha and-beta in patients with ovarian endometriosis[J].Fertil Steril,2000, 73(6):1219-1225.
[6]FUJIMOTO J,HIROSE R,SAKAGUCHI H,et al.Expression of oestrogen receptor-alpha and-beta in ovarian endometriomata[J]. Mol Hum Reprod,1999,5(8):742-747.
[7]FAZLEABAS A T,BRUDNEY A,CHAI D,et al.Steroid receptor and aromatase expression in baboon endometriotic lesions[J]. Fertil Steril,2003,80(2):820-827.
[8]PAECH K,WEBB P,KUIPER G G,et al.Differential ligand activation of estrogen receptors ERalpha and ERbeta at AP1 sites[J]. Science,1997,277(5331):1508-1510.
[9]HYDER SM,NAWAZ Z,CHIAPPETTA C,et al.Identification of functional estrogen response elements in the gene coding for the potent angiogenic factor vascular endothelial growth factor[J]. Cancer Res,2000,60(12):3183-3190.
[10]MARCONCINI L,MARCHIO S,MORBIDELLI L,et al.c-fosinduced growth factor/vascular endothelial growth factor D induces angiogenesis in vivo and in vitro[J].Proc Natl Acad Sci USA,1999,96(17):9671-9676.
(张蕾编辑)
Expression and significance of estrogen receptors α and β,activator protein and VEGF in rat model of endometriosis*
Peng-cheng Li1,Yu-ling Liu1,Qun Dang2,Hui-li Liu2,Dong-liang Wang1,Fu-xiang Tang1,Pei-pei Guo1,Xue-you Liu1
(1.Department of Obstetrics and Gynecology,the Second Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan 450014,China;2.Department of Obstetrics and Gynecology,Henan Provincial People's Hospital,Zhengzhou,Henan 450003,China)
Objective To explore the expression and significance of estrogen receptor α(ERα),ER β,activator protein 1(AP-1)and VEGF in rat model of endometriosis(EM).M ethods Subcutaneous implantation was used to establish EM model in female rats.The rats with successful ectopic implants were served as model group(n=28),and the normal rats served as control group(n=10).The histopathological changes of ectopic implants were observed after fourweeks.The expression levels of ERα,ERβ,AP-1 and VEGF in the endometrium and endometriosis lesions were observed by immunohistochemistry in the two groups.Results There were more glands and blood vessels in the stroma of endometriosis lesions and the endometrium of the model group.There was no statistically significant difference in ER α expression level between the endometriosis lesions of the EM model and the endometrium of the control group(P=0.107),but its expression level in the endometrium of the model group was obviously increased compared with the control group(P<0.01).The expression levels of ERβ,AP-1 and VEGF inthe endometriosis lesions and endometrium of the EM model were obviously increased compared with those of the control group(P<0.01),but there was no statistically significant difference between the endometriosis lesions and endometrium of the EM model.Conclusions ER α and ER β are obviously increased in the endometrium of the EM rat model;but in the endometriosis lesions,only ER β is significantly increased.Moreover,the expressions of AP-1 and VEGF are up-regulated in the EM model.ER β may play a more important role than ER α in the occurrence of endometriosis.
endometriosis;animal model;estrogen receptor subtype;activator protein 1
R-332;R711.71
A
10.3969/j.issn.1005-8982.2016.14.002
1005-8982(2016)14-0007-05
2016-04-06
河南省卫生科技中青年创新人才工程资助项目(No:201004122)
刘玉玲,E-mail:zzlyl63@163.com

