Brahma相关基因1在脂多糖诱导的急性肝炎中的作用
刘显灼,艾芬
(湖北省武汉市中心医院 急诊科,湖北 武汉 430014)
论著
Brahma相关基因1在脂多糖诱导的急性肝炎中的作用
刘显灼,艾芬
(湖北省武汉市中心医院 急诊科,湖北 武汉 430014)
目的观察Brahma相关基因1(BRG1)在脂多糖(LPS)诱导的急性肝炎中的表达变化,并观察干预BRG1表达对炎症因子分泌的影响。方法体内实验,腹腔注射LPS(2.5mg/kg)构建小鼠肝炎模型,通过免疫组织化学及蛋白免疫印迹法(Western blot)检测BRG1的表达变化;体外实验,在人肝细胞HepG2及HepaRG培养基中加入LPS(100 ng/m l),Western blot检测BRG1的表达变化,转染BRG1质粒或特异性siRNA,通过ELISA检测白细胞介素1(IL-1)、白细胞介素6(IL-6)及肿瘤坏死因子α(TNF-α)等促炎因子的分泌。结果体内实验,腹腔注射LPS(2.5mg/kg)可以显著诱导小鼠的肝细胞坏死,肝细胞核浓聚,肝小叶组织结构破坏及ALT、AST的水平明显升高;同时LPS处理后肝细胞中的BRG1表达上升,BRG1在细胞核中浓聚。体外实验,LPS(100 ng/m l)处理后的HepG2及HepaRG细胞中BRG1的表达升高。同时BRG 1过表达可显著促进促炎因子IL-1、IL-6及TNF-α的释放,相反BRG1沉默后可显著抑制促炎因子IL-1、IL-6及TNF-α的释放。结论LPS可促进小鼠肝脏中及体外培养肝细胞的BRG1蛋白表达,干预BRG 1表达可影响细胞释放IL-1、IL-6及TNF-α的能力。
Brahma相关基因1;脂多糖;急性肝炎;促炎因子
SWI/SNF染色质重塑复合物是目前许多真核基因转录调控中的关键因素,BRG1作为SWI/SNF的催化酶,不仅广泛参与包括细胞周期调控和细胞分化在内的多种细胞活动,在胚胎发育和肿瘤抑制中也发挥着重要的作用。如AGALIOTI等人[1]的研究表明BRG1通过靶向调节特定核小体的重塑活动,介导SWI/SNF复合物参与调控炎症反应的动力学效应;BRG1可调节细胞间黏附分子的水平,促进白细胞的黏附作用[2-3];BRG1也可调控调节性T细胞(regulatory T cells,Tregs)的活性[4]。但BRG1自身在炎症发展过程中的表达及其对于促炎因子的影响并不十分清楚。细菌脂多糖(Lipopolysaccharides,LPS)作为革兰氏阴性杆菌细胞壁的主要成分,具有内毒素的作用,能够激活机体的免疫应答。本研究中,笔者在C57BL小鼠腹腔注射LPS(2.5mg/kg)构建体内的肝炎模型,在人肝细胞HepG2及HepaRG培养基中加入LPS(100 ng/m l)建立体外模型,分别检测BRG1的蛋白表达变化,并观察干预BRG1表达对细胞中促炎因子分泌的影响。
1 材料与方法
1.1材料
雌性C57BL小鼠购自武汉大学实验动物中心,动物实验受武汉市中心医院、华中科技大学附属同济医学院医学伦理委员会批准。人肝癌细胞HepG2及人永生化正常肝细胞HepaRG购自中科院上海细胞库,以含10%胎牛血清的RPMI 1640培养基常规培养于5%二氧化碳CO2,37℃培养箱中。
胎牛血清、RPMI 1640培养基购自武汉启动子生物有限公司,转染试剂Lipofectamine2000购自美国Invitrogen公司,BRG1、GAPDH抗体购自美国Santa Cruz公司,促炎因子白细胞介素1(Interleukin 1,IL-1)、白细胞介素6(Interleukin 6,IL-6)及肿瘤坏死因子(tumor necrosis factor a,TNF-a)酶联免疫吸附实验 (enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉博士德生物有限公司,BRG1质粒购自山东维真生物有限公司,并经测序检测,BRG1特异性siRNA(序列为5'-GGACCUGAAUGA GGAGGAA-3')及LPS购自美国Sigma公司。
1.2实验方法
1.2.1动物模型及药物诱导将8~9周龄的C57BL雌性小鼠饲养于华中科技大学同济医学院基础医学院免疫学系动物中心,遵循12 h/12 h昼夜节律,自由进食饲料及饮水。按照小鼠体重给以腹腔注射LPS(2.5mg/kg)作为实验组,给以等量生理盐水(NS)腹腔注射作为对照组,每组8只,8 h后处死小鼠,分别取肝脏组织及血清样本行相关检测。该实验得到华中科技大学同济医学院及武汉市中心医院伦理委员会的批准。
1.2.2细胞药物处理及转染LPS以100 ng/ml的终浓度处理HepG2及HepaRG细胞,等量生理盐水作为对照组,8 h后收集细胞培养基上清及细胞行相关检测。BRG1过表达质粒及特异性siRNA按照Lipofectamine 2000试剂说明书常规转染48 h后行相关检测,以空质粒及无意乱序siRNA作为实验的阴性对照组。
1.2.3ELISA检测细胞分泌IL-1、IL-6及TNF-α将HepG2及HepaRG细胞以1×106个/孔密度接种于6孔板,按照上述方法转染质粒或siRNA,常规培养48 h后,吸取细胞培养基上清,离心去固体沉淀后按照 ELISA试剂盒检测其中的 IL-1、IL-6及TNF-α含量,并以转染空质粒及无意乱序siRNA组作为1,计算相对的蛋白含量绘图。相同实验重复3次。
1.2.4蛋白免疫印迹法(Western blot)实验收集肝脏组织并匀浆,收集LPS处理后或转染处理后的HepG2及HepaRG细胞,加入适量RIPA裂解液(每1×106个细胞加入100μl裂解液),获取细胞总蛋白液,加入SDS上样缓冲液100℃水浴解除蛋白交联。各组蛋白样品行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭1 h,然后依次孵育一抗4℃过夜及辣根过氧化物酶标记的Ⅱ抗室温1 h后化学发光法显影,检测细胞中BRG1表达情况,以GAPDH作为内参。
1.2.5免疫组织化学法收集LPS处理后的小鼠肝脏加入多聚甲醛固定、石蜡包埋、切片,并行HE染色及BRG1的免疫组织化学染色。在普通光学显微镜下观察肝细胞变化及BRG1的阳性细胞数和染色强弱。
1.3统计学方法
采用SPSS 12.0统计学软件进行数据分析,计量资料用均数±标准差()表示,组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1LPS对小鼠肝炎模型中BRG 1表达的影响
将LPS处理后及对照组的小鼠肝脏行HE染色及免疫组织化学染色,结果提示腹腔注射LPS(2.5 mg/kg)可以显著诱导小鼠肝炎发生,表现为肝细胞坏死,肝细胞核浓聚,肝小叶组织结构破坏,同时伴随ALT及AST的水平明显升高;同时观察到LPS处理后肝细胞中的BRG1表达上升,BRG1在细胞核中浓聚。同时将肝组织裂解,Western blot实验同样提示肝细胞中的BRG1的表达升高(见图1)。

图1 LPS对小鼠肝炎模型中BRG 1表达的影响
2.2LPS对体外培养肝细胞中的BRG 1表达及促炎因子释放的影响
将LPS(100 ng/m l)处理后的HepG2及HepaRG细胞及细胞培养基上清分别行Western blot实验和ELISA实验检测,结果提示LPS可显著促进细胞中BRG1的表达,并且升高细胞培养基上清中的IL-1、IL-6及TNF-α含量。IL-1:HepG2+LPS vs HepG2,(13.541±0.140)vs(1.000±0.021),P<0.05;HepaRG+LPS vs HepaRG,(10.010±0.242)vs(1.000±0.112),P<0.05。 IL-6:HepG2+LPS vs HepG2,(9.431±0.262)vs(1.000±0.051),P<0.05;HepaRG+LPS vs HepaRG,(16.321±0.502)vs(1.000±0.050),P<0.05。TNF-α:HepG2+LPS vs HepG2,(15.231±0.153)vs(1.000±0.071),P<0.05;HepaRG+LPS vs HepaRG,(7.923±0.114)vs(1.000±0.020),P<0.05(见图2和表1)。
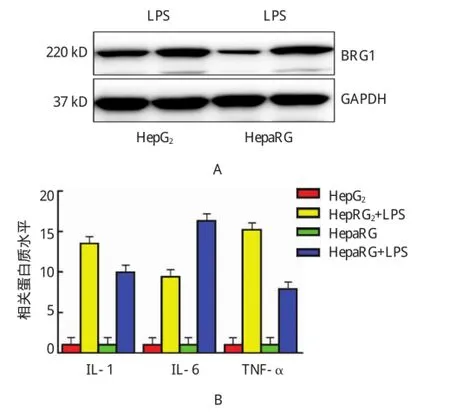
图2 LPS对体外培养肝细胞中的BRG 1表达及促炎因子释放的影响
表1 LPS对体外培养肝细胞中的BRG1表达及促炎因子释放的影响 ()

表1 LPS对体外培养肝细胞中的BRG1表达及促炎因子释放的影响 ()
组别HepaRG+LPS IL-1 1.000±0.021 13.541±0.140 1.000±0.112 10.010±0.242 IL-6 1.000±0.051 9.431±0.262 1.000±0.050 16.321±0.502 TNF-α 1.000±0.071 15.231±0.153 1.000±0.020 7.923±0.114 HepG2 HepG2+LPS HepaRG
2.3BRG 1过表达对促炎因子释放的影响
将转染BRG1过表达质粒后的HepG2及HepaRG的细胞培养基上清行ELISA实验检测,结果提示BRG1过表达可显著促进促炎因子IL-1、IL-6及TNF-α 的释放。IL-1:HepG2+BRG1 vs HepG2,(6.881±0.154)vs(1.000±0.022),P<0.05;HepaRG+BRG1 vs HepaRG,(6.313±0.211)vs(1.000±0.031),P<0.05。 IL-6:HepG2+BRG1 vs HepG2,(6.010±0.263)vs(1.000±0.020),P<0.05;HepaRG+ BRG1 vs HepaRG,(12.161±0.493)vs(1.000±0.010),P<0.05。TNF-α:HepG2+BRG1 vs HepG2,(9.134±0.122)vs(1.000±0.024),P<0.05;HepaRG+ BRG1 vs HepaRG,(7.783±0.111)vs(1.002±0.014),P<0.05(见图3和表2)。
2.4 BRG 1沉默对促炎因子释放的影响
将转染BRG1特异性siRNA后的HepG2及HepaRG的细胞培养基上清行ELISA实验检测,结果提示BRG1沉默后可显著抑制促炎因子IL-1、IL-6及 TNF-α 的释放。IL-1:HepG2+siBRG1 vs HepG2,(0.161±0.030)vs(1.000±0.020),P<0.05;HepaRG+siBRG1 vs HepaRG,(0.163±0.014)vs(1.000±0.102),P<0.05。IL-6:HepG2+siBRG1 vs HepG2,(0.200±0.011)vs(1.000±0.051),P<0.05;HepaRG+siBRG1 vs HepaRG,(0.084±0.051)vs(1.002±0.050),P<0.05;TNF-α:HepG2+siBRG1 vs HepG2,(0.113±0.024)vs(1.000±0.071),P<0.05;HepaRG+siBRG1 vs HepaRG,(0.153±0.033)vs(1.001±0.020),P<0.05(见图4和表3)。
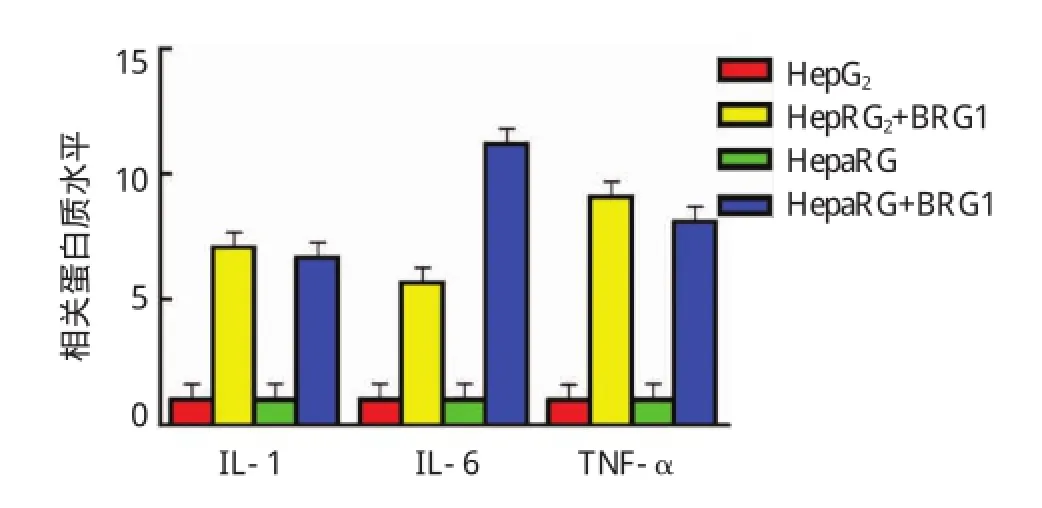
图3 BRG1过表达对促炎因子释放的影响
表2 BRG 1过表达对促炎因子释放的影响 ()
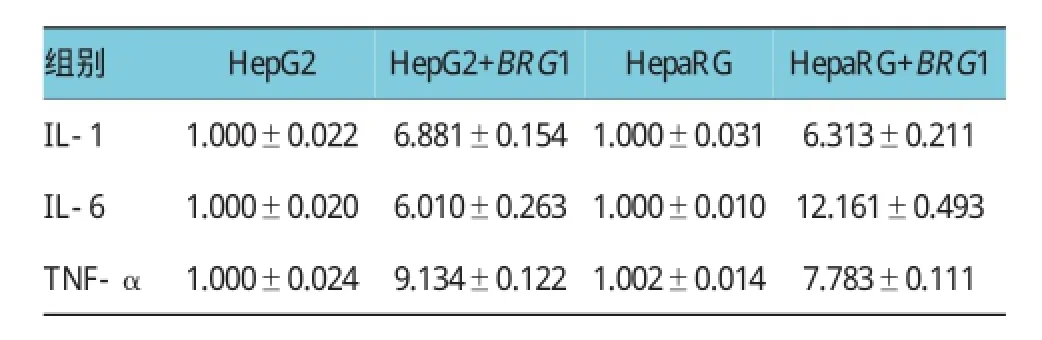
表2 BRG 1过表达对促炎因子释放的影响 ()
组别HepaRG+BRG1 IL-1 1.000±0.022 6.881±0.154 1.000±0.031 6.313±0.211 IL-6 1.000±0.020 6.010±0.263 1.000±0.010 12.161±0.493 TNF-α 1.000±0.024 9.134±0.122 1.002±0.014 7.783±0.111 HepG2 HepG2+BRG1 HepaRG
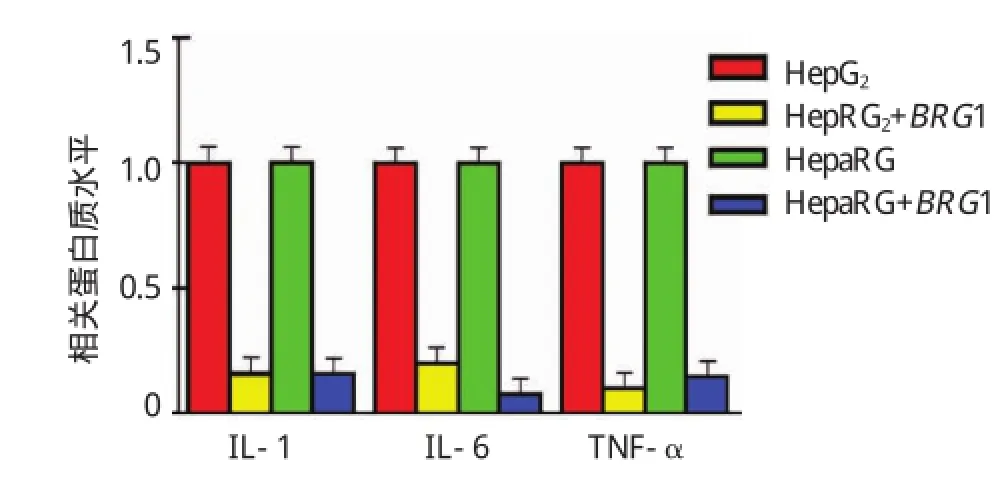
图4 BRG1沉默对促炎因子释放的影响
表3 BRG 1沉默对促炎因子释放的影响 ()
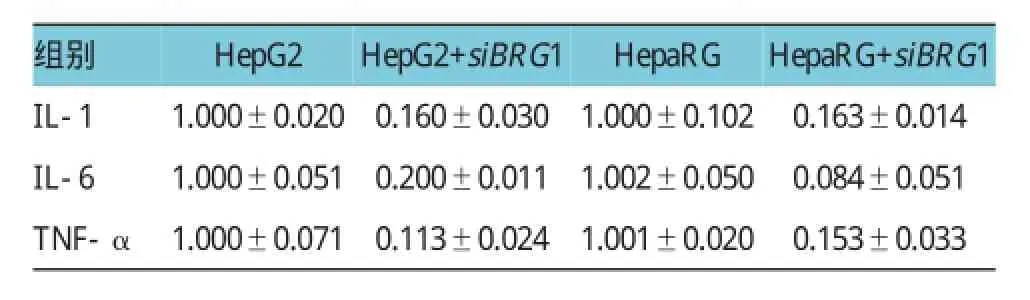
表3 BRG 1沉默对促炎因子释放的影响 ()
组别HepaRG+siBRG1 IL-1 1.000±0.020 0.160±0.030 1.000±0.102 0.163±0.014 IL-6 1.000±0.051 0.200±0.011 1.002±0.050 0.084±0.051 TNF-α 1.000±0.071 0.113±0.024 1.001±0.020 0.153±0.033 HepG2 HepG2+siBRG1 HepaRG
3 讨论
目前研究表明,炎症激活时,如在LPS刺激下,核因子κB(nuclear factor κB,NF κB)中的p65亚基可磷酸化进入细胞核,结合于炎症因子的启动子区域。而且BRG1自身也可与NFκB中的p65亚基相结合,那么是否BRG1也是通过类似的募集过程,参与炎症反应的动力学过程调控[5-6]。本研究提示LPS刺激下BRG1的表达水平在体内肝脏组织中及体外肝细胞中都有明显的升高,尤其在体内实验中发现,在LPS激活炎症的过程中,BRG1在细胞核中发生浓聚效应,有可能通过募集于促炎因子的核小体附近,重塑其染色质结构,增加细胞中IL-1、IL-6及TNF-α的释放。
BRG1是SW I/SNF复合体中的关键催化亚基,它通过对ATP水解为整个复合体供能使染色体结构发生改变,进而导致基因序列上启动子结合位点暴露、易化转移因子等转录调控蛋白的结合,从而参与调控目的基因的表达[7]。SWI/SNF催化亚基的降解,抑制其活性染色质重塑。现已有文献报导,BRG1在心肌发育、神经系统发育过程中有十分重要的作用,相关数据提示,抑制BRG1的表达将导致心肌发育以及中枢神经系发育障碍[8-10]。本研究发现,抑制细胞中BRG1的表达,能够显著下调促炎因子的分泌,而过表达BRG1相反可以促进IL-1、IL-6及TNF-α的分泌,这提示BRG1在LPS诱导的急性炎症过程中可能扮演着重要的角色。
综上所述,本研究发现,LPS诱导的小鼠急性肝炎中,BRG1的蛋白表达水平显著上升,并在细胞核中浓聚。而LPS作用于体外培养的肝细胞,也可明显促进细胞中BRG1的表达。同时肝脏细胞中过表达BRG1,可促进促炎因子IL-1、IL-6及TNF-α的释放。相对应的,BRG1沉默后可显著抑制肝细胞促炎因子IL-1、IL-6及TNF-α的释放。这提示BRG1在LPS诱导的急性炎症过程中可能扮演着重要的角色,干预其表达有望作为治疗急性炎症的潜在药物靶点。
[1]AGALIOTI T,LOMVARDAS S,PAREKH B,et al.Ordered recruitment of chromatin modifying and general transcription factors to the IFN-beta promoter[J].Cell,2000,103(4):667-678.
[2]CHEN D,FANG F,YANG Y,et al.Brahma-related gene 1 (Brg1)epigenetically regulates CAM activation during hypoxic pulmonary hypertension[J].Cardiovasc Res,2013,100(3):363-373.
[3]FANG F,CHEN D,YU L,et al.Proinflammatory stimuli engage Brahma related gene 1 and Brahma in endothelial injury[J].Circ Res,2013,113(8):986-996.
[4]CHAIYACHATI B H,JANI A,WAN Y,et al.BRG1-mediated immune tolerance:facilitation of Treg activation and partial independence of chromatin remodelling[J].EMBO J,2013,32(3): 395-408.
[5]KAWAHARA T L,MICHISHITA E,ADLER A S,et al.SIRT6 links histone H3 lysine 9 deacetylation to NF-kappa B-dependent gene expression and organismal life span[J].Cell,2009,136(1): 62-74.
[6]NATOLI G,CHIOCCA S.Nuclear ubiquitin ligases,NF-kappa B degradation,and the control of inflammation[J].Sci Signal,2008, 1(1):1.
[7]W ILSON B G,ROBERTS CW M.SWI/SNF nucleosome remodellers and cancer[J].Nature Reviews Cancer,2011,11(7):481-492.
[8]HANG C T,YANG J,HAN P,et al.Chromatin regulation by Brg1 underlies heart muscle development and disease[J].Nature, 2010,466(7302):62-67.
[9]WEIDER M,KÜSPERT M,BISCHOF M,et al.Chromatin-remodeling factor Brg1 is required for schwann cell differentiation and myelination[J].Developmental Cell,2012,23(1):193-201.
[10]LIMPERT A S,BAI S,NARAYAN M,et al.NF-B forms a complex with the chromatin remodeler BRG1to regulate schwann cell differentiation[J].Journal of Neuroscience,2013, 33(6):2388-2397.
(张蕾编辑)
Effect of BRG1 in acute hepatitis induced by lipopolysaccharides
Xian-zhuo Liu,Fen Ai
(Emergency Department,Wuhan Central Hospital,Wuhan,Hubei430014,China)
Objective To observe the expression of Brahma-related gene 1(BRG1)in acute hepatitis induced by lipopolysaccharide(LPS)and the effect of intervention of BRG1 expression on secretion of inflammatory factors. Methods For in vivo experiments,a hepatitis mouse model was constructed by intraperitoneal injection of LPS(2.5 mg/kg),then the expression of BRG1 was detected though immunohistochemical staining and Western blot.For in vitro experiments,LPS(100 ng/ml)was added in human liver cell line HepG2 and HepaRG culture media,and then,the expression of BRG1 was detected through Western blot.Meanwhile,BRG1 plasmid or specific siRNA was transfected into HepG2 and HepaRG cells,enzyme linked immunosorbent assay(ELISA)was performed to detect the IL-1,IL-6 and TNF-αsecretion.Results in vivo,intraperitoneal injection of LPS could obviously induce necrosis of hepatic cells and lobules,together with condensation of nuclei in mice.Meanwhile,the expression of BRG1 was enhanced in mouse hepatic cells after procession by LPS,and accumulated in nuclei.In vitro experiments showed the expression of BRG1 in HepG2 and HepaRG cells increased after treatment by LPS(100 ng/ml).At the same time,the overexpression of BRG1 significantly promoted the release of pro-inflammatory cytokines IL-1,IL-6 and TNF-α;the silence of BRG1 inhibited the release of IL-1,IL-6 and TNF-α.Conclusions LPS could promote the expression of BRG1 protein both in vivo and in mouse liver cell lines,and intervention of BRG1 expression mightaffect the secretion of IL-1,IL-6 and TNF-α.
Brahma-related gene 1;lipopolysaccharide;acute hepatitis;pro-inflammatory factor
R-332
A
10.3969/j.issn.1005-8982.2016.14.006
1005-8982(2016)14-0027-05
2015-12-25
艾芬,E-mail:13006191071@163.com;Tel:13006191071

