唐氏综合征细胞黏附分子在APP转基因小鼠海马中的表达变化及其意义
贾永林,张保华,付志新,贾延劼
(1.河南省开封市中心医院 神经内科,河南 开封 475000;2.郑州大学第一附属医院 神经内科,河南 郑州 450052)
论著
唐氏综合征细胞黏附分子在APP转基因小鼠海马中的表达变化及其意义
贾永林1,张保华1,付志新1,贾延劼2
(1.河南省开封市中心医院 神经内科,河南 开封 475000;2.郑州大学第一附属医院 神经内科,河南 郑州 450052)
目的观察唐氏综合征细胞黏附分子(DSCAM)在淀粉样前蛋白(APP)转基因小鼠海马中的表达变化规律,探讨其意义。方法选择月龄分别为1、3、6和12个月的APP转基因和野生型小鼠,应用免疫组织化学法对脑切片进行染色,观察DSCAM在APP转基因小鼠脑中的表达,应用蛋白免疫印迹法(Western blot)检测该蛋白在海马中表达量的变化规律,野生型小鼠做对照。结果DSCAM主要在APP转基因小鼠大脑皮层、海马的锥体细胞中表达。在两组小鼠中,DSCAM在海马中的表达水平随年龄增长而下降(P<0.05)。DSCAM在APP转基因小鼠海马中的表达量明显高于同龄野生型小鼠(P<0.05)。结论DSCAM在APP转基因小鼠海马内的过度表达可能在APP小鼠的学习和记忆能力下降中扮演重要角色。
唐氏综合征细胞黏附分子(DSCAM);APP转基因小鼠;海马;痴呆
唐氏综合征(down syndrome,DS)的显型是由21号染色体上的特殊基因控制区所决定的,即唐氏综合征关键区(down syndrome critical region,DSCR)。在唐氏综合征关键区上的基因数量的增加从而引起其产物的过度表达被认为是引起DS临床表现的原因[1-2]。在DS中的神经病理学发现包括了先天或后天发育的畸形以及和提前出现的痴呆相关的变化。前者包括了大脑皮质中颗粒细胞的减少,这很可能与aspinous星形细胞类型相关[3]。研究发现,唐氏综合征的患者从婴儿到成人发育的过程中,脑内神经元突触棘减少和神经元胞体上的异常的棘突样结构[4-5]。在唐氏综合征的患者的前额和海马皮层中也发现了与年龄相关痴呆的老年斑和神经纤维缠结,这与阿尔茨海默病中的病理改变酷似。唐氏综合征细胞黏附分子基因定位于21号染色体的q22.2~q22.3的DSCR上。该分子的序列和免疫球蛋白超家族的分子序列具有同源性[5],提示它作为一个黏附分子的功能。研究发现,唐氏综合征细胞黏附分子(down syndrome cell adhesion molecule,DSCAM)在生长发育期的多数神经系统中表达,并证实其参与了神经元的迁移、分化、增殖、生长发育、连接、维护、轴突导向、靶向作用、突触间的识别、自我回避及突触的可塑性,并最终形成正确的神经元连接和神经网络[5-8]。其广泛表达提示,DSCAM的过度表达破坏了脑的生长发育和突触的可塑性,因此可能参与了DS患者的早老性痴呆、精神发育迟滞以及周围神经缺陷。
在先前研究中笔者发现,DSCAM也在淀粉样前蛋白(amyloid precursor protein,APP)转基因小鼠大脑皮层中呈现过度表达[3]。与DSCAM过度表达相关的APP的过度表达提示两者之间可能存在相互调控作用,或者APP过度表达所致的神经病理改变导致了反应性的DSCAM过度表达,如阿尔茨海默病(alzheimer disease,AD)样斑的沉积和神经纤维缠结。APP转基因小鼠也表现出与年龄相关的海马学习和记忆缺陷,甚至先于淀粉样前体蛋白(Aβ蛋白)的大量沉积。因此,笔者进一步研究了APP转基因小鼠海马中的与年龄相关DSCAM的表达变化。
1 材料与方法
1.1实验动物
APP转基因小鼠(采用隔代回交法将转基因鼠携带的APP基因导入遗传背景清晰的近交系小鼠C57BL/6J中,建立C57BL/6J-APP同源导入近交系小鼠)由中国医学科学院中国协和医科大学实验动物研究所提供。月龄分别为1、3、6和12个月。同月龄野生型同种系小鼠做为对照组。
1.2主要试剂
DSCAM的一抗(16sc-79437)购自美国Santa Cruz公司,二抗(SP-9001)免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司,Cy3标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)(H+L A0516)购自上海市碧云天生物技术研究所,水合氯醛、多聚甲醛及其他试剂均为国产分析纯。
1.3主要方法
1.3.1样本采集用10%水合氯醛将实验用小鼠以0.3~0.4ml/100 g进行腹腔注射麻醉后,其四肢固定于解剖盘中,在剑突以下打开腹腔,穿过横膈,游离出心脏组织。从左心室插入灌流针并固定,剪开右心耳,50m l注射器从心脏灌注温生理盐水,至灌出液变清,再用4%的多聚甲醛溶液经心脏灌注至小鼠死亡,断头取出全脑,4%的多聚甲醛溶液将所有脑组织进行固定2周。
1.3.2免疫组织化学法将固定过的小鼠全脑用石蜡包埋,切成4μm厚的切片,切片脱蜡至水,90℃微波处理9min,以恢复DSCAM对抗血清DSCAM-2的抗原性。3%过氧化氢H2O2去离子水孵育10min,用以消除内源性过氧化物酶活性,用封闭用正常山羊血清阻断非特异性结合,室温孵育30min,倾去,勿洗,用抗DSCAM抗体(稀释至1∶50)将切片在4℃孵育过夜,随后用生物素标记山羊抗兔IgG抗体生物素化30min后,在室温下用辣根酶标记链霉卵白素工作液孵育30min。每两个步骤之间,切片用磷酸盐缓冲液(pH:7.2,氯化钠NaCl:8.0 g,磷酸二氢钾KH2PO4:0.20 g,氯化钾KCl:0.20 g,水合磷酸氢二钠Na2HPO4·H2O:1.56 g)充分清洗3次,每次3min。在50mmol/L的氨基丁三醇氯化氢溶液(pH:7.4)中,用0.02%的3,3'-二氨基联苯胺和0.006%过氧化氢作用2min,再用苏木素将切片进行对比染色,用适当的封片剂封片。
1.3.3蛋白免疫印迹法(Western blot)检测样本来自于月龄分别为新生、1、3、6和12个月的APP转基因阳性小鼠和阴性对照小鼠的海马。样本取出后立即置入-80℃冰箱中冷冻保存。用标准方法完成对蛋白质印迹的分析。蛋白质的提取:解冻标本并在氨基丁三醇/盐缓冲液(50 mmol/L氨基丁三醇,150 mmol/L氯化钠,5mmol/L依地酸钙钠酸四钠,2mmol/L苯甲磺酰基氟化物,1μg/ml胃酶抑素A,1μg/ml N-α-p-甲苯磺酰基-L赖氨酸氯甲基酮,pH:7.6和1%曲拉通X-100)中均匀加工处理。离心后收集上清液,用Bradford法对蛋白进行含量测定。样品(30或60μg/泳道)在6%的SDS-聚丙烯酰胺凝胶上进行电泳分离,而后电泳转移到硝酸纤维素膜上。用考马斯亮蓝对膜的未用部分染色,证实同样数量的蛋白已经被装载并转运。用8%的脱脂乳封闭后(室温1 h),随之用含有1∶200的抗血清的膜孵育(4℃过夜),再用含辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)的膜在室温下孵育1 h。用电化发光系统,蛋白质条带在载膜上完全显现出来,用放射自显影胶片(电化发光计算机胶片;载膜)检测到化学发光。分析底片上条带的光密度值,以同一膜上靶蛋白光密度/β-肌动蛋白光密度,其比值作为目的蛋白的相对光密度值。
1.4统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料用均数±标准差()表示,多组间比较用单因素方差分析(ANOVA)(见表1),组间两两比较用最小显著性差异法(LSD法),P<0.05为差异有统计学意义。

表1 单因素方差分析对多组间比较
2 结果
2.1DSCAM在APP转基因小鼠脑内的表达部位
免疫组织化学法发现,DSCAM主要在野生对照小鼠(见图1A、1C、1E)和APP转基因小鼠(见图1B、1D、1F)大脑皮层、小脑浦肯野细胞、海马锥体细胞、海马齿状回的颗粒细胞层、丘脑以及脑干神经元中表达,主要分布在胞膜的周边,在浦肯野细胞的轴突内也发现DSCAM的表达。
2.2DSCAM在不同月龄和不同基因型小鼠海马中的表达
Western blot证实,在APP转基因小鼠和野生型小鼠中,随着小鼠月龄的增加,DSCAM在海马中的表达量逐渐减少(P<0.05),到达3个月时,DSCAM的表达量达到高峰,1个月龄小鼠较3个月龄小鼠DSCAM的表达量差异无统计学意义(P>0.05)。DSCAM在APP转基因小鼠海马中的表达量明显高于同月龄的野生型对照组小鼠,差异有统计学意义(P<0.05)。结果显示DSCAM在APP转基因小鼠海马内存在过度表达。见表2、图2。
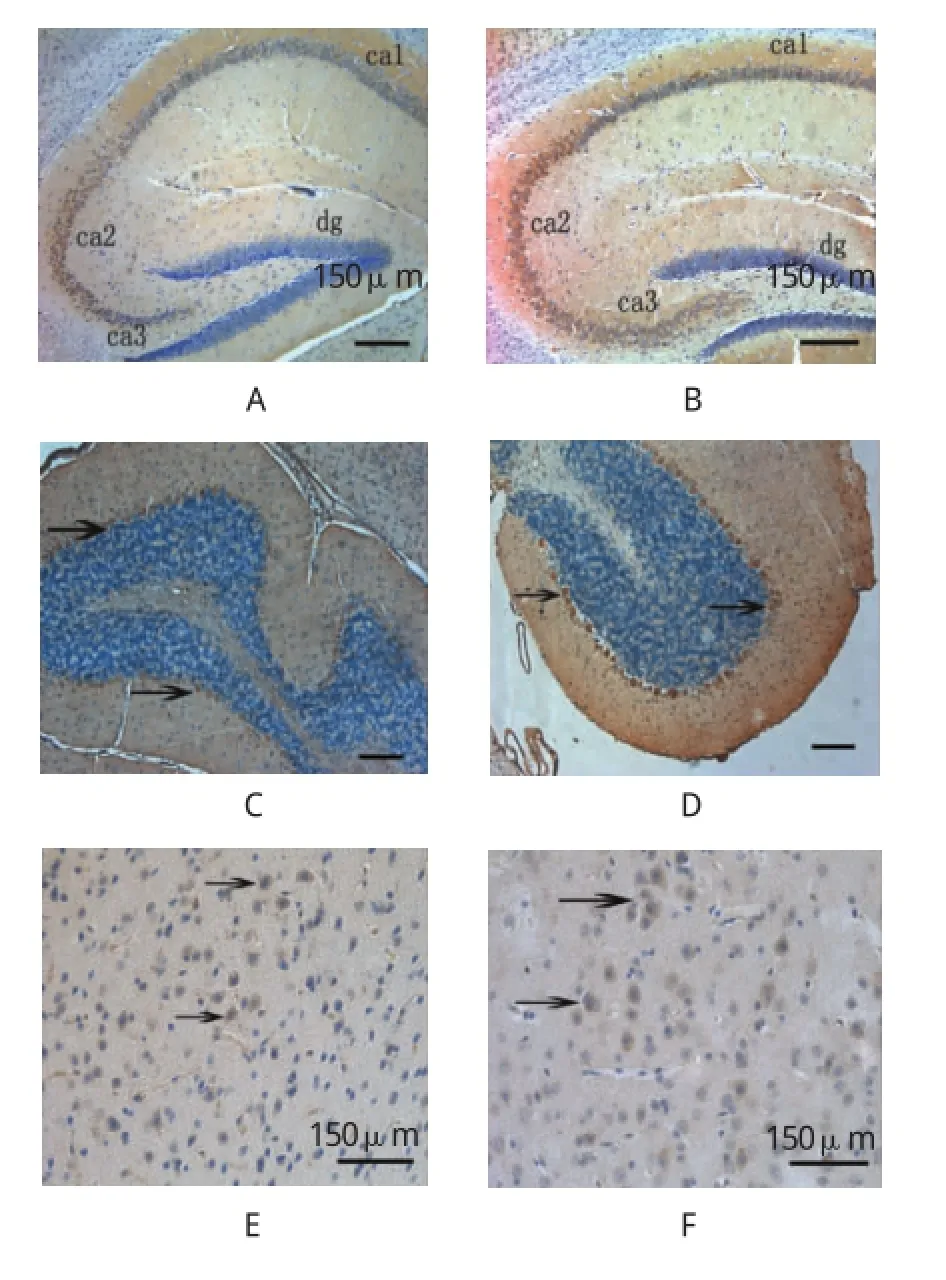
图1 DSCAM在小鼠脑内的表达部位
表2 DSCAM在每组小鼠海马中表达的相对光密度值Western blo t(n=10,%,)

表2 DSCAM在每组小鼠海马中表达的相对光密度值Western blo t(n=10,%,)
注:野生型组1个月与3个月比较,P=0.540;野生型3个月与6个月比较,P=0.000;野生型6个月与12个月比较,P=0.000;转基因组1个月与3个月比较,P=0.736;转基因组3个月与6个月比较,P=0.000;转基因组6个月与12个月比较,P=0.000
组别12个月野生型 51.1±1.783 50.7±1.590 42.7±1.631 35.2±1.488转基因 80.1±1.273 79.9±1.336 45.6±1.325 40.2±1.085 P值 0.000 0.000 0.000 0.000 1个月3个月6个月
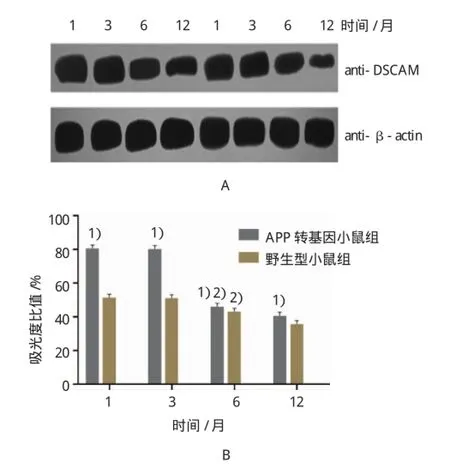
图2 DSCAM在APP转基因小鼠和同月龄野生型小鼠海马中的表达 (n=10)
3 讨论
通常认为,转基因模型的表型是由导入或删除的基因所决定的。在本研究中笔者发现,DSCAM在APP转基因小鼠海马中存在显著的过度表达,提示DSCAM的表达异常可能参与APP小鼠的神经病理学上的改变和行为表型。实际上,这些小鼠甚至在老年斑形成之前就已经被证实出现学习和记忆缺陷。DSCAM在可塑性强的海马神经元中的表达增加是学习和记忆的关键。研究发现,包含胞内域的截短的DSCAM在突触后的过度表达阻断AMPA受体的聚集,而AMPA受体的聚集则是突触可塑性持久表达所必须的,突触可塑性持久表达则是海兔学习的基础[9]。因此,DSCAM的过度表达可能导致APP小鼠的某些表型,但仍需要更多的研究来证明这种假设。
老年斑和β淀粉样蛋白沉积是AD患者和中年DS受试者神经病理学核心特征。在DS中额外的APP基因导致了Aβ淀粉样蛋白早期沉积。DSCAM在衰老斑的核心和神经突触中的免疫反应提示DSCAM在空斑形成中的作用。而且,DSCAM的过度表达可能通过抑制突触生成和轴突生长的机制导致DS发病[6]。实际上DS患者并没有AD患者类似的神经病理学特征,提示DS患者的认知功能缺陷可能是DSCAM的过度表达所致。
研究发现,DSCAM广泛表达在APP转基因小鼠大脑皮层、小脑浦肯野细胞、海马、丘脑及脑干神经元中[3],这些区域涉及脑的许多种高级功能,如躯体感觉信息的输入和加工处理、随意运动、运动的学习、外显学习和记忆。DSCAM在APP转基因小鼠海马中的表达明显高于同月龄野生对照组,特别是在小鼠青年期。外显记忆依赖连接齿状颗粒细胞和海马锥体细胞的完整的纤维以及连接海马和其他脑区的通路,例如海马与额叶皮层间通路。有关果蝇的研究证实DSCAM的过度表达和表达不足均会导致有缺陷轴突导向以及异常的神经网络的形成[10]。10%~13%的DSCAM胚胎杂合子就导致了Bolwig神经的轴突导向缺陷[25]进一步提示神经元可能对DSCAM的剂量特别敏感。此外,对海兔和果蝇的研究表明,在一些条件下免疫球蛋白超家族神经蛋白量的增加会抑制突触生长或迁移[10]。因此,过度表达的DSCAM可能引起可在DS患者中看到的异常的架构和皮层缺陷[11]。
笔者研究发现,DSCAM在APP转基因小鼠小脑中的过度表达可能涉及小鼠的学习运动能力和运动协调能力的缺陷,并在其中扮演重要角色[12]。在此笔者提出DSCAM在海马中的过度表达可能参与APP转基因小鼠的学习和记忆缺陷,其机制可能是通过改变神经细胞的黏附性,抑制突触和/或神经突的生长,扰乱轴突导向和正常的神经连接结构来实现的。此外DSCAM可能促进衰老斑的形成或者增强这些包涵体的神经变性潜力。仍有必要进一步研究DSCAM是否在DS和AD患者的海马中存在过度表达,APP与DSCAM在表达上和功能上如何相互作用,以及DSCAM是否和怎样独自改变作为学习和记忆的基础的突触塑形过程。
[1]ANTONARAKIS SE.10 years of genomics,chromosome 21,and down syndrome[J].Genomics,1998,51(1):1-16.
[2]JANNOT A S,PELET A,HENRION-CAUDE A,et al.Chromosome 21 scan in Down syndrome reveals DSCAM as a predisposing locus in Hirschsprung disease[J].PLoS One,2013,8(5): e62519.
[3]JIA Y L,JING L J,LI JY,et al.Expression and significance of DSCAM in the cerebral cortex of APP transgenic mice[J].Neu-rosci Lett,2011,491(2):153-157.
[4]CVETKOVSKA V,HIBBERT A D,EMRAN F,et al.Overexpression of Down syndrome cell adhesion molecule impairs precise synaptic targeting[J].Nat Neurosci.2013,16(6):677-682.
[5]MORALES D H.Down syndrome cell adhesion molecule is important for early development in Xenopus tropicalis[J].Genesis, 2014,52(10):849-857.
[6]TADROS W,XU S,AKIN O,et al.Dscam Proteins Direct Dendritic Targeting through Adhesion[J].Neuron,2016,89(3):480-493.
[7]WOJTOWICZ W M,WU W,ANDRE I,et al.A vast repertoire of Dscam binding specificities arises from modular interactions of variable Ig domains[J].Cell,2007,130(6):1134-1145.
[8]MILLARD SS,ZIPURSKY S L.Dscam-mediated repulsion controls tiling and self-avoidance[J].Curr Opin Neurobiol,2008,18(1): 84-89.
[9]LI H L,HUANG B S,VISHWASRAO H,et al.Dscam mediates remodeling of glutamate receptors in Aplysia during de novo and learning-related synapse formation[J].Neuron,2009,61(4):527-540.
[10]SCHMUCKER D,CLEMENS J C,SHU H,et al.Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity[J].Cell,2000,101(6):671-684.
[11]AGARWALA K L,NAKAMURA S,TSUTSUMI Y,et al.Down syndrome cell adhesion molecule DSCAM mediates homophilic intercellular adhesion[J].Brain Res Mol Brain Res,2000,79 (1/2):118-126.
[12]贾永林,景黎君,鲁晶晶,等.唐氏综合征黏附分子(DSCAM)在APP转基因小鼠小脑内的表达变化及其意义[J].中国现代医学杂志, 2011,21(34):4231-4235.
(张西倩编辑)
Expression of Down syndrome cell adhesion molecule in hippocampus of APP transgenicm ice and its significance
Yong-lin Jia1,Bao-hua Zhang1,Zhi-xin Fu1,Yan-jie Jia2
(1.Department of Neurology,the Central Hospital of Kaifeng,Kaifeng,Henan 475000,China;2.Department of Neurology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan 450052,China)
Objective To investigate the changing regularity of the Down syndrome cell adhesion molecule(DSCAM)expression in the brain of amyloid precursor protein(APP)transgenic mice and explore the significance of DSCAM expression.Methods With immunohistochemistry and Western blot,the expression of DSCAM in the brains of APP transgenic mice(aged 1m,3m,6m and 12m),especially the expression pattern and location in hippocampus were detected.The control group included age-matched wide type mice.Results DSCAM was widely expressed in the cerebral cortex and hippocampal pyramidal cell layer in the APP transgenic mice.The expression of DSCAM decreased with age in the hippocampus of APP transgenic and wild-typemice(P<0.05).The hippocampus expression level of DSCAM in the APP transgenic mice was higher than that in the wild-typem ice(P<0.05).There was no significant difference in DSCAM expression between 1-month old and 3-month old mice(P>0.05).Conclusions We propose that over expression of DSCAM in the hippocampus might play an important role in the learning and memory defects of APP transgenic mice.
Down syndrome cell adhesion molecule;APP transgenic mouse;hippocampus;dementia
R 329;R 725.9
A
10.3969/j.issn.1005-8982.2016.14.005
1005-8982(2016)14-0022-05
2015-12-31
贾延劼,E-mail:jiayanjie1971@yahoo.com.cn;Tel:0371-66295112

