土壤线虫的室内扩培方法研究及条件优化
李 阳,贾美清,黄 静,汪钱英,刘成宝,许 帅,张国刚(天津师范大学 a.生命科学学院,b.天津市水资源与水环境重点实验室,天津 300387)
土壤线虫的室内扩培方法研究及条件优化
李阳1,贾美清2,黄静1,汪钱英1,刘成宝1,许帅1,张国刚1
(天津师范大学 a.生命科学学院,b.天津市水资源与水环境重点实验室,天津 300387)
摘要:为了寻求一种高效、快速的土壤线虫培养方法,在人工气候箱中分别以无菌水、土壤浸出液和生菜蛋黄(LE)为基质培养土壤线虫,分析基质对土壤线虫增殖的影响,并且对培养基浓度、培养基稀释方式、线虫初始接种密度、线虫培养空间等4种培养条件进行优化.研究结果表明:(1)在20d的培养周期内,土壤线虫在生菜蛋黄培养基中增殖成功;(2)以无菌水稀释、体积分数为25%的生菜蛋黄培养基中土壤线虫的休眠时间最短、增殖速率最大;(3)土壤线虫的初始接种密度为5条/mL时,培养效果最好;(4)培养空间对土壤线虫的增殖没有显著影响.
关键词:土壤线虫;增殖;最佳方法;条件优化
线虫隶属于无脊椎动物的线虫动物门.土壤生态系统中,线虫在有机质分解、养分矿化及能量传递等过程中起着重要作用[1-2].土壤线虫由于具有数量多、食性多样、世代周期短、对污染物反应迅速等特点,越来越多地被用作土壤指示物,以此评价生态系统的土壤健康水平、生态系统演替或者受干扰程度等[3-4].在以土壤线虫作为指示生物的研究中,往往需要充足的线虫样本[5],因此有必要建立一个操作便捷、富集高效的土壤线虫培养体系.目前对线虫培养的研究主要集中于病原线虫[6]及模式线虫——秀丽线虫的培养[7],有关土壤线虫的培养研究鲜见报道[8].李辉信等[9]研究土壤食细菌线虫的富化培养时发现在马铃薯蔗糖培养基中培养真菌后接入线虫,可使土壤食细菌线虫成功富化.
在现有的土壤线虫培养方式的基础上,本课题组研究了土壤线虫在生菜蛋黄、无菌水和土壤浸出液3种培养基中的增殖情况.在确定了最优培养基的基础上,进一步对培养基的浓度、培养基稀释方式、土壤线虫初始接种密度及土壤线虫的培养空间进行优化,旨在为土壤线虫培养体系的确立提供必要的实验基础.
1 材料与方法
1.1土壤采集与土壤线虫的分离
在2015年4月份,从天津师范大学校园内的人工草坪中采集0~5 cm的表层土壤,带回实验室.
采用Baermann漏斗法分离土壤线虫:将纱布包裹的土壤放入下端设置有乳胶管与止水夹的漏斗中,加入蒸馏水至水面淹没土壤,上端设置60 W的白炽灯以加快线虫分离速率,每小时打开止水夹收集土壤线虫1次.于体式显微镜下挑取活性较强的土壤线虫,用无菌水反复清洗5次至虫体表面无杂质,清洗后迅速均分到不同的培养基内以减小无菌水对土壤线虫的影响.
1.2不同培养基的制备方法
1.2.1土壤浸出液培养基的制备
取150 g新鲜土壤,加入500 mL的蒸馏水,煮沸10 min,过滤后收集滤液,冷却至室温后待用.
1.2.2生菜蛋黄(LE)培养基的制备
称取30 g洗净的生菜,剪碎后于研钵内研磨成匀浆,过滤并收集滤液.称取熟蛋黄15 g,加入无菌水捣碎.将蛋黄液与生菜液混匀,用无菌水定容至1 L后加热沸腾30 min,冷却至室温后pH调至7.0.最后将培养基于121℃下灭菌20 min,冷却至室温后待用.
1.3土壤线虫的培养及计数方法
在不同处理方式的培养皿中随机接入收集到的土壤线虫,各处理均设置3次重复.在人工气候箱中23℃下培养20 d,每天于同一时间在倒置显微镜下直接统计线虫数量.本实验主要调查土壤线虫密度和土壤强活性线虫密度2项指标.其中,土壤线虫密度是指每毫升培养基中形态结构完整的土壤线虫的数量;土壤强活性线虫密度指的是每毫升培养基中虫体移动波频率≥20/min的土壤线虫的数量[10].
1.4土壤线虫培养条件的优化方法
将LE培养基以无菌水稀释至体积分数分别为100%、50%和25%进行实验,选出最佳的LE培养基浓度.再分别以土壤浸出液和无菌水为溶剂,将LE培养基稀释至最佳浓度,选出最佳稀释溶剂.在此基础上,分别设置初始接种密度为10只/mL和5只/mL,选出最佳的土壤线虫初始接种密度.实验观察到土壤线虫在培养基中主要集中于培养皿底部,为明确空间结构对土壤线虫增殖的影响,选择体积分数为25%的LE培养基,接种密度为5只/mL,在培养液体积不变的条件下,用内径分别为2.2 cm和5.6 cm的培养皿培养土壤线虫,考察培养空间对线虫增殖的影响.
1.5统计分析
采用Excel和Sigmaplot 12.5进行数据处理与绘图,使用SPSS 13.0进行t检验和方差分析,采用LSD进行多重比较检验,p≤0.05为差异具有统计学意义.
2 结果与分析
2.1最优土壤线虫培养基的确定
本研究分别在无菌水、土壤浸出液和LE培养基中培养土壤线虫,在20 d的培养期内每天对线虫进行计数,结果如图1所示.
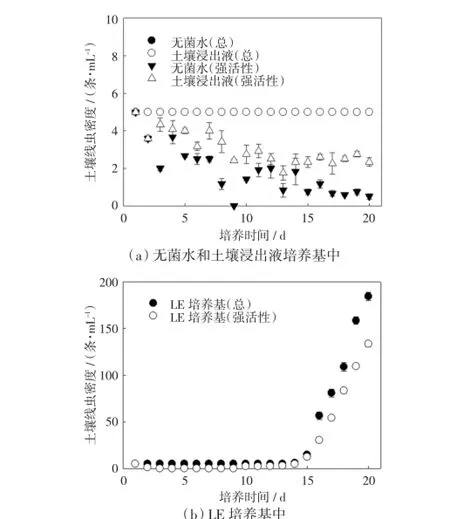
图1 不同培养基中土壤线虫密度与土壤强活性线虫密度Fig.1 Abundance of soil nematode and highly active soil nematode in different mediums
由图1可以看出,土壤浸出液与无菌水培养基中的土壤线虫增殖较少,在整个培养期内密度基本保持不变;LE培养基中的土壤线虫在培养前期和中期密度没有显著变化,从第14天起密度开始增加,显著高于另2种培养基中的线虫密度,差异具有统计学意义(p≤0.05),随后保持上升趋势,在培养20 d后达到最大值(184.58条/mL),为初始接种密度的36.92 倍.无菌水培养基中土壤线虫的活性在整个培养期内波动性下降,培养17 d以后,强活性线虫的密度稳定在1条/mL以下;土壤浸出液培养基中土壤线虫的活性同样呈现下降趋势,但在培养中、后期(14~20 d),仍有约1/2的土壤线虫保持强活性,即强活性线虫的密度约为2~3条/mL;LE培养基中土壤强活性线虫密度在培养前3 d内下降,随后逐渐恢复活性,培养前期和中期,LE培养基中土壤强活性线虫的密度与另2种培养基中的密度接近,培养超过13 d后,LE培养基中的土壤强活性线虫密度剧增,显著高于另2种培养基中的密度,差异具有统计学意义(p≤0.05).
2.2不同培养基体积分数对土壤线虫增殖的影响
根据2.1的结果,以LE为供试培养基,考察培养基体积分数对土壤线虫增殖的影响,结果如图2所示.
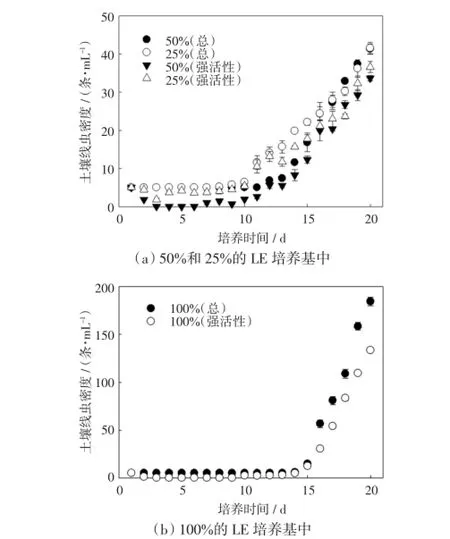
图2 不同体积分数LE培养基中土壤线虫密度与土壤强活性线虫密度Fig.2 Abundance of soil nematode and highly active soil nematode in different volume fractions of medium
由图2可以看出,体积分数为100%、50%和25%的LE培养基中,土壤线虫休眠的时间分别为13、11和7 d,即土壤线虫休眠时间与培养基体积分数呈现一定的正相关.但线虫开始增殖后,增殖速率与培养基体积分数相关性不明显.在培养9~15d时,体积分数为25%的LE培养基中土壤线虫密度显著高于体积分数为50%和100%的LE培养基中的密度(p≤0.05).培养16 d后,体积分数为20%和50%的LE培养基中线虫密度相近,均显著低于体积分数为100%的培养基中的线虫密度(p≤0.05).培养20 d后,体积分数为100%的培养基中土壤线虫密度达到184.58条/mL,为初始密度的36.92倍;体积分数为25%和50%的培养基中线虫密度分别为41.58条/mL和41.33条/mL,分别为初始密度的8.32和8.27倍.
3个体积分数的LE培养基中,土壤强活性线虫密度的变化趋势与线虫总密度一致.在培养的第3天,体积分数为25%的培养基中36.6%的土壤线虫保持较强活性,体积分数为100%和50%的培养基中没有强活性线虫.随着土壤线虫活性的恢复与增殖,从培养的第10天开始,体积分数为25%和50%的培养基中的线虫活性急剧增强.到了培养的第16天,体积分数为100%的培养基中的线虫恢复活性,密度显著高于体积分数为20%和50%的培养基中的数值,差异具有统计学意义(p≤0.05).在增殖期间,体积分数为100%的培养基中强活性线虫占总线虫的比率为71.79%,体积分数为50%和20%的培养基中比率分别为77.50%和83.27%,即培养基浓度越低,强活性线虫占全部线虫的比率越大.
综合考虑土壤线虫的休眠时间、增殖速率、土壤线虫活力、培养基使用量、最终检测用线虫密度等因素,认为体积分数为25%的LE培养基较为合理.
2.3培养基稀释方式对土壤线虫增殖的影响
根据2.2的结果,将LE培养基的体积分数设置为25%,研究分别以无菌水和土壤浸出液为溶剂的稀释方式对土壤线虫增殖的影响,结果如图3所示.
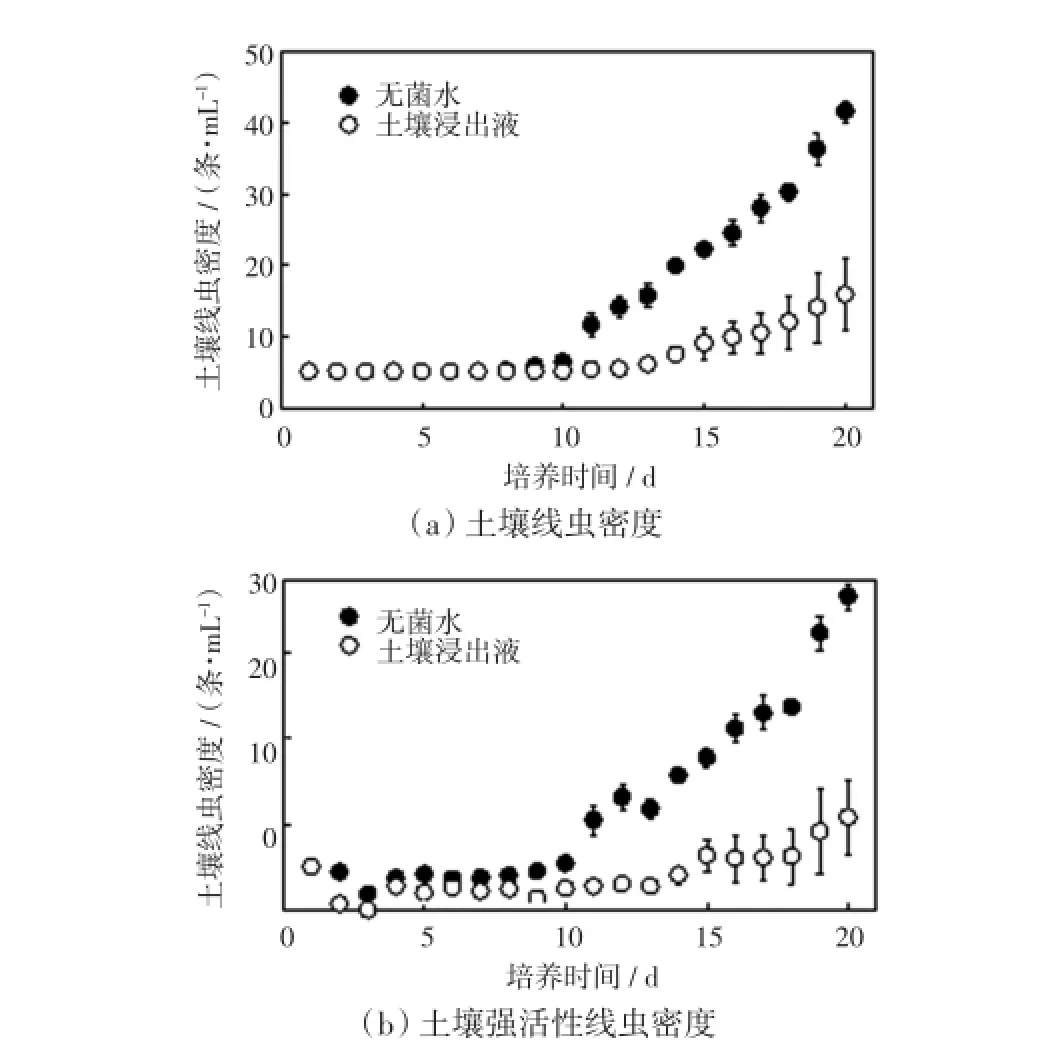
图3 不同稀释方式中土壤线虫密度与土壤强活性线虫密度Fig.3 Abundance of soil nematode and highly active soil nematode with different medium dilution methods
由图3(a)可以看出,以无菌水稀释的LE培养基中,土壤线虫在培养7 d后密度开始增加,10 d后密度急剧增加,到培养末期密度超过40条/mL,从培养的第11天开始,以无菌水稀释的LE培养基中的土壤线虫密度显著高于以土壤浸出液稀释的LE培养基中的密度,差异具有统计学意义(p≤0.05).以土壤浸出液稀释的LE培养基中,培养11 d后土壤线虫开始增殖,但速率缓慢,培养末期土壤线虫的密度仅为15条/mL.由图3(b)可以看出,在培养的前3 d,土壤浸出液与无菌水稀释的LE培养基中,土壤强活性线虫所占比率下降,而后土壤线虫的活性开始恢复;培养5 d后,土壤浸出液稀释的培养基中强活性线虫数量开始显著低于无菌水稀释的培养基中的数值(p≤0.05);培养结束时,无菌水稀释的培养基中,强活性线虫的密度约为37条/mL,而土壤浸出液稀释处理的培养基中强活性线虫的密度仅为10条/mL左右.由此认为,无菌水稀释培养基的处理方式更加有利于土壤线虫的培养.
2.4不同初始接种密度对土壤线虫增殖的影响
在无菌水稀释的体积分数为25%的LE培养基中,设置土壤线虫的初始接种密度分别为5条/mL和10条/mL,分析不同接种密度对土壤线虫增殖的影响,结果如图4所示.
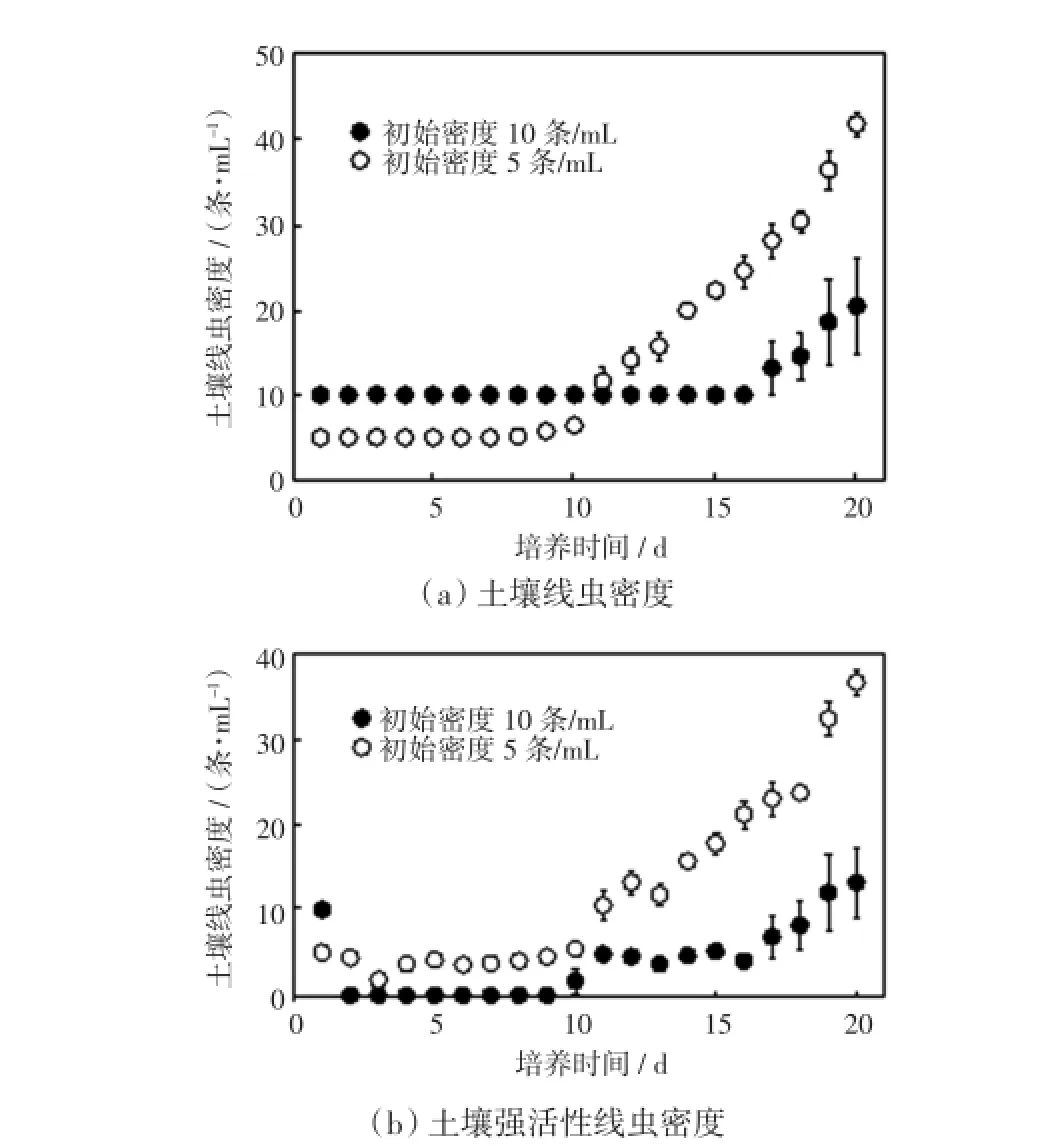
图4 不同初始接种密度下土壤线虫密度与土壤强活性线虫密度Fig.4 Abundance of soil nematode and highly active soil nematode by different initial population density
由图4(a)可以看出,土壤线虫的初始接种密度为5条/mL时,线虫在培养8 d后开始增殖,且在培养11 d后线虫密度开始高于初始接种密度为10条/mL的数值,培养20 d后,土壤线虫密度达到41.58条/ mL.土壤线虫的初始接种密度为10条/mL时,线虫在培养16 d后才开始增殖,且末期密度仅为20.33条/ mL,显著低于接种密度为5条/mL的数值.图4(b)的强活性线虫密度结果显示,在初始接种密度为10条/ mL的处理中,前期培养中土壤强活性线虫的密度明显下降,培养10 d后,活性才开始恢复;初始接种密度为5条/mL的处理中,线虫在培养4 d后活性开始恢复,在整个培养期间,强活性线虫的密度始终高于10条/mL的处理,差异具有统计学意义(p≤0.05).由此可见,初始接种密度为5条/mL的处理更有利于土壤线虫的增殖.
2.5不同培养空间对土壤线虫增殖的影响
在培养液体积相同的前提下,选用2种直径的培养皿培养土壤线虫,考察培养空间对土壤线虫增殖的影响,结果如图5所示.

图5 空间结构对土壤线虫密度与土壤强活性线虫密度的影响Fig.5 Influence of spatial struture on abundance of soil nematode and highly active soil nematode
由图5(a)可以看出,内径5.6 cm的培养皿中土壤线虫从培养的第9天开始增殖,在培养11~16 d期间,其线虫密度大于小内径培养皿中的线虫密度,在培养后期,2种培养空间的线虫密度相近.在图5(b)中,培养的前期和中期,内径5.6 cm的培养皿中的强活性线虫密度也高于内径2.2 cm培养皿中的密度,但在培养末期,二者相近.因此认为,培养空间对土壤线虫增殖的影响不大.
3 讨论与结论
线虫具有“假死”特性,这是其在应对不利环境下的自我保护机制.本项研究中,不同处理方式下,土壤线虫在接入培养基后的2~3 d内,线虫的活性都迅速下降,呈现休眠状态.随着培养时间的延长,土壤线虫打破休眠状态,活性恢复后仍然具备繁殖能力.为减少“假死”现象对实验结果的影响,在分离线虫过程中要尽量减少线虫在湿漏斗中的停滞时间,并在培养期间,将总线虫密度作为重要指标评价土壤线虫的增殖情况,土壤线虫虫体的摆动频率通常与其对环境的适应性和繁殖能力联系密切[11].
本研究分别采用无菌水、土壤浸出液和LE培养基作为基质培养土壤线虫,结果发现,只有LE培养基可使土壤线虫发生增殖.LE培养基含有大量的蛋白质与纤维素等营养物质,而其是否可为不同食性土壤线虫的生长与繁殖提供充足的食物来源,以及在LE培养体系中,各食性土壤线虫在取食过程中是否存在竞争关系还有待进一步探究.在无菌水中,土壤线虫可以存活但不能增殖,且活性不断下降,这是因为无菌水只提供了可供生存的水环境,营养物质及渗透压等条件均不利于线虫生存[11];另一方面,本实验中无菌水培养基的相关研究也可为土壤线虫在极端低渗条件下的生存状态及饥饿胁迫下土壤线虫的行为响应等研究提供基础.土壤浸出液的培养中,土壤线虫虽无明显增殖,但仍可保持较高活性,因此土壤浸出液可用于土壤线虫的长期保存.土壤线虫生存在植物或土壤颗粒表面形成的水膜中,低浓度的培养基与线虫生存环境更为相似,在培养过程中线虫具有较短的休眠时间;而线虫在高浓度培养基中休眠时间较长.休眠状态一旦被打破,高浓度培养基中优越的营养条件优势逐渐展现,土壤线虫短期内大量增殖.土壤浸出液稀释的LE培养基中,二者的复合效应反而给土壤线虫的生存与繁殖造成压力.增加线虫初始接种密度同样不能为土壤线虫的生存与增殖带来正向影响,个体平均可利用营养量较低可能是造成这一现象的主要原因.不同生存空间对线虫增殖的影响也不明显.对于线虫的培养,也有使用NGM培养基、LB培养基的报道[9,12],这些培养基可为某些特定类型的线虫提供准确的营养供给,但其营养成分与操作过程却较为复杂.一个操作便捷、快速大量的扩繁方式更能满足生态学研究的需求.
综上所述,在20 d的培养周期内,体积分数25% 的LE培养基中土壤线虫休眠时间最短,增殖速率快,以无菌水稀释LE培养基及5条/mL的初始接种密度下培养效果更优,而生存空间对土壤线虫增殖的影响不明显.
参考文献:
[1]EDWARDS C A.Assessing the effects of environmental pollutants on soil organisms,communities,processes and ecosystems[J].European Journal of Soil Biology,2002,38(3/4):225-231.
[2]ZACHARY A S,DIANA H W.Linking soil biodiversity and vegetation:implications for a changing planet[J].American Journal of Botany,2011,98(3):517-527.
[3]WARDLE D,BARDGETT R,KLIRONOMOS J,et al.Ecological linkages between aboveground and belowground biota[J].Science,2004,304:1629-1633.
[4]李玉娟,吴纪华,陈慧丽,等.线虫作为土壤健康指示生物的方法及应用[J].应用生态学报,2005,16(8):1541-1546. LI Y J,WU J H,CHEN H L,et al.Nematodes as bioindicator of soil health:methods and applications[J].Chinese Journal of Applied Ecology,2005,16(8):1541-1546(in Chinese).
[5]陈小云,刘满强,胡峰,等.根际微型土壤动物——原生动物和线虫的生态功能[J].生态学报,2007,27(8):3132-3143. CHEN X Y,LIU M Q,HU F,et al.Contributions of soil micro-fauna (protozoa and nematodes)to rhizosphere ecological functions[J].Acta Ecologica Sinica,2007,27(8):3132-3143(in Chinese).
[6]孙晶双.影响大豆胞囊线虫孵化及休眠的相关因子研究[D].沈阳:沈阳农业大学,2010. SUN J S.The influencing factors of hatching and dormancy of soybean cyst nematode(Heterodera glycines)[D].Shenyang:Shenyang Agricultural University,2010(in Chinese).
[7]邹联沛,周文琪,张明德,等.绕线虫培养条件的优化[J].上海大学学报:自然科学版,2010,10(5):553-556. ZOU L P,ZHOU W Q,ZHANG M D,et al.Optimizing the culture condition of Plectus sp.[J].Journal of Shanghai University:Natural Science Edition,2010,10(5):553-556(in Chinese).
[8]刘志典,张秀君.土壤线虫培养方法研究[J].广东农业科学,2013 (5):60-62. LIU Z D,ZHANG X J.Study on the culture of soil nematode[J].Guangdong Agricultural Sciences,2013(5):60-62(in Chinese).
[9]李辉信,陈小云,胡锋.土壤食细菌线虫的分离和富集培养方法[J].南京农业大学学报,2002,25(2):71-74. LI H X,CHEN X Y,HU F.Isolation and enrichment culturing of a soil bacterial-feeding nematode[J].Journal of Nanjing Agricultural University,2002,25(2):71-74(in Chinese).
[10]段玉玺.植物线虫学[M].北京:科学出版社,2011. DUAN Y X.Plant nematology[M].Beijing:Science Press,2011(in Chinese).
[11]刘维志.植物病原线虫学[M].北京:中国农业出版社,2000. LIU W Z.Plant pathogen nematology[M].Beijing:Chinese Agricultural Press,2000(in Chinese).
[12]庞林海,杜爱芳,李孝军,等.秀丽隐杆线虫培养特性与保存方法研究[J].浙江农业学报,2007,19(1):34-36. PANG L H,DU A F,LI X J,et al.Culture characters and preservation method of caenorhabditis elegans[J].Acta Agricultural Zhejiangensis,2007,19(1):34-36(in Chinese).
(责任编校纪翠荣)
第一作者:李阳(1990—),男,硕士研究生.
文章编号:1671-1114(2016)01-0057-05
中图分类号:Q142.3
文献标志码:A
收稿日期:2015-05-19
基金项目:国家自然科学基金资助项目(31100330,31270502);天津市科技支撑重点资助项目(15ZCZDSF00410);天津市应用基础与前沿技术研究计划资助项目(12JCYBJC19700);天津市“用三年时间引进千名以上高层次人才”资助项目(5KQM110006);天津师范大学引进人才基金资助项目(5RL111).
通信作者:张国刚(1976—),男,副教授,主要从事土壤生态学方面的研究.
Investigation and optimization on laboratory culture of soil nematode
LI Yang1,JIA Meiqing2,HUANG Jing1,WANG Qianying1,LIU Chengbao1,XU Shuai1,ZHANG Guogang1
(a.CollegeofLifeSciences;b.TianjinKeyLaboratoryofWaterResourcesandEnvironment,TianjinNormalUniversity,Tianjin300387,China)
Abstract:To find an efficient and quick laboratory culture method of soil nematode,the sterile water,the soil extract medium and the lettuce eggs medium were adopted seperately to cultivate soil nematode,and the influence of the three kinds of medium on soil nematode proliferation was analyzed.Furthermore,the culture conditions,including medium concentration,medium dilution method,initial population density of soil nematode and spatial structures,were optimized.The results showed that:(1)During the whole culture cycle of 20 d,the soil nematode cultivated in the lettuce eggs medium proliferated successfully;(2)The soil nematode growing in the lettuce eggs medium,which was diluted with sterile water and had the volume concentration of 25%,had the shortest latent period and the largest proliferating rate;(3)The best cultivating effect was obtained when the initial population density of soil nematode was 5 ind/mL;(4)There were no obvious effects of spatial structure on soil nematode proliferation.
Keywords:soil nematode;proliferation;best method;optimization

