菜豆组培快繁技术研究
韩启厚等


摘 要:以双丰3号菜豆为试验材料,比较了种子消毒方法,筛选了快繁最佳增殖培养基、生根培养基及移栽基质。结果表明,25%次氯酸钠浸泡20 min对菜豆种子消毒效果最好;最佳增殖培养基为MSB5+6-BA 5.0 mg/L,14 d获得再生芽为9.2个/外植体;最佳生根培养基为1/2 MSB5+IBA 0.1 mg/L,生根率达95.3%;最佳移栽基质为草炭∶蘑菇渣=1∶1,移栽成活率为97%。
关键词:菜豆;消毒;增殖;生根;移栽
菜豆(Phaseolus vulgaris L.)又称四季豆、芸豆、扁豆等,分为食豆和食荚两种类型,菜豆在我国各省市均有栽培,种植范围十分广泛,是我国重要的粮食作物和蔬菜作物。菜豆能为人类提供丰富的蛋白质、碳水化合物、维生素及矿物质等[1],其嫩荚尤其是人们喜食的蔬菜之一。
植物组织培养技术已在许多作物上得到应用,并对农业生产起到巨大的推动作用,但关于菜豆组织培养技术的报道却相对较少[2],主要是由于菜豆组织的再生能力较弱,组织培养难度较大。因此,本试验对菜豆组培快繁技术做了初步研究,为菜豆种质资源保存、种质资源创新、脱毒技术应用、遗传转化以及优良品种快繁等工作提供可以利用的技术平台。
1 材料与方法
1.1 试验材料及时间、地点
供试材料为双丰3号(天津科润蔬菜研究所提供),试验于2012年1月至2014年6月在天津科润蔬菜研究所组培实验室完成。
1.2 种子消毒
挑选籽粒均匀一致的菜豆种子,放置于玻璃容器内。采用如下4种常见豆类种子消毒方法,并作适当改动。T1:70%乙醇处理3 min,无菌水冲洗3次,25%次氯酸钠溶液浸泡20 min,无菌水洗涤5~6次[3];T2:25%次氯酸钠处理20 min,无菌水洗涤5~6次[4];T3:氯气熏蒸6 h[5];T4:氯气熏蒸12 h[6]。
将处理种子的种脐向下接种于萌发培养基(MS[7]+6-BA 0.5 mg/L)中,密封好后放置于培养室中培养,每个处理50粒种子,3次重复,共600粒种子。培养室环境温度为25℃,光照强度为4 000 lx,光周期为16 h光照/8 h黑暗。培养5~6 d即可长出幼苗,供试验备用。
1.3 增殖培养
在超净工作台上,取生长5~6 d的2叶1心的无菌苗,放置于灭菌后的培养皿中,切掉胚根及2片真叶,保留叶柄,作为外植体备用。将处理好的外植体的下胚轴部分插入增殖培养基中,插入深度0.5 cm左右。增殖培养基为MSB5(将MS培养基中的有机成分换成B5培养基的有机成分,其他成分不变,缩写为MSB5)加入不同浓度的6-BA,最终培养基中6-BA浓度分别为0.5、1.0、3.0、5.0 mg/L,每个培养瓶中3个外植体,每个处理10瓶,3次重复,共120瓶。将密封好的培养瓶放置于培养室中培养,培养条件同上。
培养7 d后,再生芽长到2~3 cm切一次,记录再生芽数量;将外植体置于相同培养基中继续培养,14 d后切第二次,记录再生芽数量,最后统计两次再生芽数量,筛选最佳快繁培养基。
1.4 再生芽的生根
切取通过快繁获得的均匀一致的再生植株,插入含有不同浓度IBA的培养基中,基本培养基为1/2 MSB5,IBA浓度分别为0、0.1,0.3、0.5、0.7、1.0 mg/L,每个培养瓶接种再生芽10个,每个处理5瓶,3次重复,共90瓶。10 d后测生根率和生根数量,生根率和生根数量最多的培养基为最佳生根培养基。
1.5 组培苗的移栽
先将生根后的组培苗开盖炼苗3~4 d,后将组培苗连瓶一起放置温室内炼苗3~4 d,炼苗结束后将组培苗取出,在水中除掉根部的培养基,尽量使再生根完整。将完整的组培苗移栽到含有不同比例基质的营养钵中,基质处理分为6种,分别为100%草炭、蛭石、蘑菇渣、草炭+蛭石(1∶1)、草炭+蘑菇渣(1∶1)、蘑菇渣+蛭石(1∶1),每个处理移栽30株组培苗,移栽完的营养钵放置在有塑料薄膜覆盖的小拱棚内,移栽后前3 d适当向拱棚内喷水,保证拱棚内相对湿度达100%,3 d后逐渐放风直至除掉拱棚,10 d后调查成活率。
2 结果与分析
2.1 种子消毒方法的筛选
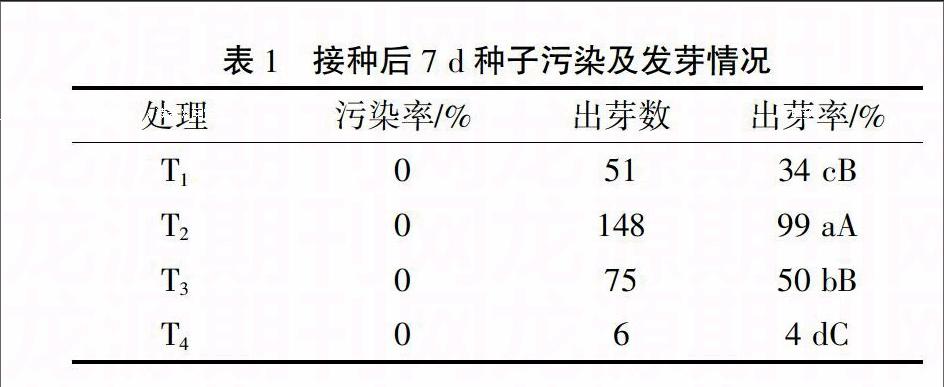
由表1可知,将4种消毒方法处理后的种子均无污染,可见4种方法均有较好的消毒效果,但对种子出芽率影响有很大差别。T2处理对发芽率影响最小,该处理下种子发芽率极显著高于其他3个处理,T4处理对种子芽率影响最大,发芽率仅4%,极显著低于其他3个处理。T3、T4均为氯气熏蒸消毒,氯气熏蒸是最近大豆种子消毒采用的方法,用其消毒对菜豆种子伤害较大。本试验结果表明,氯气不适用于菜豆种子消毒,而采用次氯酸钠消毒最佳。
2.2 增殖培养基的筛选
从表2可看出,在本试验范围内,随着培养基中6-BA浓度的增加,再生芽数量不断增加。MSB5+6-BA 5.0 mg/L培养基中再生芽数量在第一次和第二次均最高,显著高于其他培养基,并与MSB5+6-BA 0.5 mg/L培养基达极显著差异水平。第二次再生芽数量均要比第一次略低,但增长趋势与第一次完全一致。两次再生芽数量总和,MSB5+6-BA 5.0 mg/L培养基显著高于其他培养基,并与MSB5+6-BA 0.5 mg/L和MSB5+6-BA 1.0 mg/L培养基达极显著差异水平。从3组数据上看,MSB5+6-BA 5.0 mg/L培养基是最佳的快繁培养基,扩繁系数为9.2个/外植体。
2.3 生根培养基的筛选
从表3可看出,当IBA浓度为0.1 mg/L时生根率最高,达到92.5%,显著高于不加IBA的培养基,其后,随着IBA浓度增加,生根率逐渐下降。从生根数量上看,同样是IBA浓度为0.1 mg/L时最多,达12.3根/株。随着IBA浓度的增加,促进了再生植株基部愈伤组织的产生,抑制了再生植株的生根。综上,最佳生根培养基是1/2 MSB5+IBA 0.1 mg/L。
2.4 移栽基质的筛选
从表4可以看出,无论是单一基质还是不同基质混配,移栽成活率均在90%左右,其中以草炭∶蘑菇渣比例为1∶1的时候成活率最高,达到了97%,可能是由于草炭和蘑菇渣的透气性较好,并且其中都含有一定的营养物质和配料,能够充分供应组培苗的生长,而其他基质养分不够充足或养分比较单一,因而导致移栽成活率较低,因此,草炭∶蘑菇渣=1∶1为最佳的移栽培养基。
3 结论与讨论
种子消毒方法多种多样,本试验比较了国外菜豆及大豆种子常用的4种消毒方法。根据本试验和前人的研究结果,作者认为,氯气穿透力较强,且操作时浓度不易精确把握,对种子刺激作用比其他方法强烈,因此氯气熏蒸比较适合于大豆[5]等一些种皮相对较厚或对氯气不太敏感的种子消毒,对种子损伤小,而用在菜豆种子上则严重影响种子的发芽率,不适于菜豆种子消毒。次氯酸钠消毒是菜豆种子消毒最好的选择。菜豆种子由于产地及采收习惯存在差异,种皮表面污染物多少也同样存在差异,如果种子带菌量较多,可适当在次氯酸钠消毒方法上增加一些消毒步骤,消毒会更加彻底;而对于一般比较干净的菜豆种子来讲,采用次氯酸钠消毒足以达到彻底消毒的效果。
快繁是在最短的时间内获得最多的再生植株,本试验主要是利用菜豆幼苗上存在多个芽点的特点,采用6-BA刺激芽点生长产生丛生不定芽,达到快繁的目的,比通过愈伤组织培养更容易获得再生植株[8],增殖效率更高。随着培养基中6-BA浓度的提高,再生芽数量逐渐增加,而且相同6-BA浓度第二次再生芽数量少于第一次,说明在继代培养过程中器官形成能力和增殖能力有随着培养代数增加而下降的趋势,这与Crocomo等[9]结论相同。
再生植株生根是比较容易的,即使不加入任何激素其依然可生根,但一般生根少、质量差。加入一定浓度的生长素可以促进根的生成,但生长素浓度过大会抑制生根[10],刺激再生植株基部生成大量愈伤组织,从而阻碍了再生根的形成[11]。
组培苗移栽成活与否主要是看组培苗是否能够适应环境的变化,采用草炭和蘑菇渣混合基质效果最好,主要是草炭和蘑菇渣的透气性好,而且其中养分及有机质成分也相对较高,满足了组培苗对氧气及养分的需求,因此最有利于组培苗成活。
菜豆组培快繁与常规种子繁种相比,不受时间及空间的限制,并且快繁系数远远高于种子繁殖。菜豆组培快繁的成功将为优良种质资源保存、保持种性及快速推广提供十分有效的手段。
参考文献
[1] Blair M W, Caldas G V, Lascano C E. Tannin content of commercial classes of common bean[J]. Annu Rep Bean Improv Coop, 2006, 49: 151-152.
[2] 安利佳,李凤霞,张俊敏,等.豆科植物组织培养的研究[J].植物学报,1992,4(10):743-752.
[3] Delgado-Sanchez P, Saucedo-Ruiz M, Guzman-Maldonado S H, et al. An organogenic plant regeneration system for common bean (Phaseolus vulgaris L.)[J]. Plant Science, 2006, 170: 822-827.
[4] Franklin C I, Trieu T N, Gonzales R A, et al. Plant regeneration from seedling explants of green bean (Phaseolus vulgaris L.) via organogenesis[J]. Plant Cell, Tissue and Organ Culture, 1991, 24: 199-206.
[5] 刘海坤,卫志明.一种大豆成熟种子的消毒方法[J].植物生理学通讯,2002,38(3):260-261.
[6] 李海燕,武小霞,韩英鹏,等.影响大豆子叶节再生的因素研究[J].东北农业大学学报,2008,39(3):5-8.
[7] Murashige T, Skoog F. A revised medium for rapid growth and bioassay with tobacco tissue cultures[J]. Physiology Plant, 1962, 50: 151-158.
[8] 包英华,白音,王羽梅,等.菜豆(双青35号)再生体系的建立[J].韶关学院学报:自然科学版,2005,26(12):74-77.
[9] Crocomo O J, Sharp W R, Peters J E. Plantlet morphogenesis and the control of callus growth and root induction of Phaseolus vulgaris with addition of bean seed extract[J]. Zeitschrift für Pflanzenphysiologie, 1976, 78: 458-460.
[10] Kwapata K, Sabzikar R, Sticklen M B, et al. In vitro regeneration and morphogenesis studies in common bean[J]. Plant Cell, Tissue and Organ Culture, 2010, 100: 97-105.
[11] López Arnaldos T, Munoz R , Ferrer A, et al. Changes in phenol content during strawberry(Fragaria×ananassa, cv. Chandler) callus culture[J]. Physiology Plant, 2001, 113:315-322.
Abstract: In this paper, we took common bean cultivar Shuangfeng No.3 as experiment material, and compared seed disinfection methods, in order to screen out rapid and suitable enrichment medium, rooting medium and transplanting matrix. The results showed that, the disinfection effect of treatment with 25% sodium hypochlorite for soaking 20 minutes was the best, and the most suitable enrichment medium was MSB5+6-BA 5.0 mg/L, which could obtain 9.2 regenerated buds every explant after cultured 14 days. The most suitable medium for rooting was 1/2 MSB5+IBA 0.1 mg/L, which rooting rate was above 95.3%, while the most suitable transplanting matrix was peat∶spent mushroom compost=1∶1, with transplanting survival rate of 97%.
Key words: Common bean; Disinfection; Enrichment; Rooting; Transplanting

