川翠3号黄瓜SSR指纹图谱的构建及种子纯度鉴定
杨宏等

摘 要:为了建立杂交黄瓜品种川翠3号的快速纯度鉴定体系,用164对全基因组覆盖的SSR引物对川翠3号及其亲本进行了多态性筛选及纯度鉴定。其中4对引物表现出稳定的共显性,电泳图谱清晰、易分辨,特异性强,对川翠3号种子鉴定纯度为99.0%,真、假杂种编号与田间鉴定结果一致,可以用来区别其中混杂的母本、父本及其他种子,说明这4对引物组成的指纹图谱能为川翠3号杂交种的真伪鉴定、纯度检测及亲本提纯等提供准确的技术指导。
关键词:黄瓜;川翠3号;SSR指纹图谱;纯度鉴定
种子纯度鉴定是保证种子质量的关键环节。传统的种子形态学鉴定、幼苗鉴定法不适用于黄瓜种子纯度鉴定。田间小区种植鉴定法,周期长、费用高,无法满足种子贸易中快速鉴定的要求,且受环境影响大,结果不够准确。DNA电泳鉴定技术为种子的纯度鉴定提供了一种更为快速、高效的方法,可以弥补其他纯度鉴定技术中的许多缺陷,具有以下优点:在植物任何组织的任何发育时期均可用于分析;多态性位点分布广,遗传稳定;不受任何环境因素的影响。
SSR引物共显性的特点在杂交种纯度鉴定具有独特优势,已在水稻[1~4]、玉米[5]、棉花[6,7]、油菜[8,9]、茄子[10]、大白菜[11]、花椰菜[12]、黄瓜[13]等多种作物上应用。SSR的位点特异性和日益丰富的标记群体使SSR成为基因精细定位及作图的有力工具。目前黄瓜已开发的SSR标记已有2 000多对[14~16],位点多,分布均匀,检测区域覆盖黄瓜7条染色体。利用SSR分子标记,黄瓜叶片苦味、矮化、果实网纹等重要基因都能够被定位,为克隆奠定了基础[16~18]。同时,SSR分子标记也是黄瓜种质资源多样性分析的重要方法之一[19,20]。总之, SSR标记具有共显性、位点特异性、位点丰富、稳定、易操作等特点,因此成为构建分子指纹图谱的重要标记。
随着品种保护的需求增加,加之亲本退化等问题严重,需要建立信息更丰富的骨干材料分子指纹图谱。川翠3号是高产优质华北型黄瓜新品种,对黄瓜霜霉病、白粉病等主要病害有较强抗性,具有较大的推广应用前景。本文利用SSR 分子标记技术,构建了川翠3号及其亲本的DNA指纹图谱,以期为该品种的权益保护、真伪鉴别、杂种纯度鉴定和亲本提纯等提供理论依据和技术指导。
1 材料与方法
1.1 试验材料
黄瓜品种川翠3号单株100株及其亲本各20株,由四川省农业科学院园艺研究所黄瓜课题组提供。供试材料于2013年7月中旬播种,7月23日定植于四川省农科院园艺所黄瓜课题组双流基地,露地常规栽培管理。小区种植F1植株350株,田间种植按随机区组设计,3次重复。随机选取100株挂牌标记编号,用于SSR分析和田间性状调查。
1.2 试验方法
①基因组DNA的提取 父本、母本各20株,幼嫩叶片等量混合后用CTAB法小量提取DNA。100株F1植株分单株取幼嫩叶片,分别提取DNA,且DNA试管标记号与植株田间挂牌号一致。在1%琼脂糖凝胶上检测DNA质量,并稀释到适当浓度,-20℃保存备用。
②PCR扩增和电泳检测 164对全基因组覆盖的SSR引物来自Ren等[14]、Miao等[15]公开发表信息,由上海生工生化公司合成。SSR反应体系,总
共25 μL,包括:20 ng模板DNA,前后引物各
1.0 μmol/L,10×PCR Buffer 2.5 μL,1.0 U Taq酶,
0.2 mmol/L dNTPs。SSR扩增体系为:94℃预变性
5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30次循环;最后72℃延伸10 min。采用8%的非变性聚丙烯酰胺凝胶,180 V电泳2.5 h后检测PCR扩增产物,获得亲本和杂交种的扩增条带,银染显色后记录结果。SSR标记的数据记录根据电泳结果采用0、1系统描述条带的相对位置,条带清晰的记为1,缺失的则记为0,依据分子量从小到大的顺序读带,不具多态性的条带不予统计。
③田间纯度鉴定 9月中旬对100株标记单株进行田间纯度鉴定。田间纯度鉴定方法为主要差异表型性状比对,调查性状有:株型、株高、叶形、节间长度、瓜形、瓜色、果实表面蜡粉、瓜把、瓜长等。
2 结果与分析
2.1 杂交种共显性标记的筛选
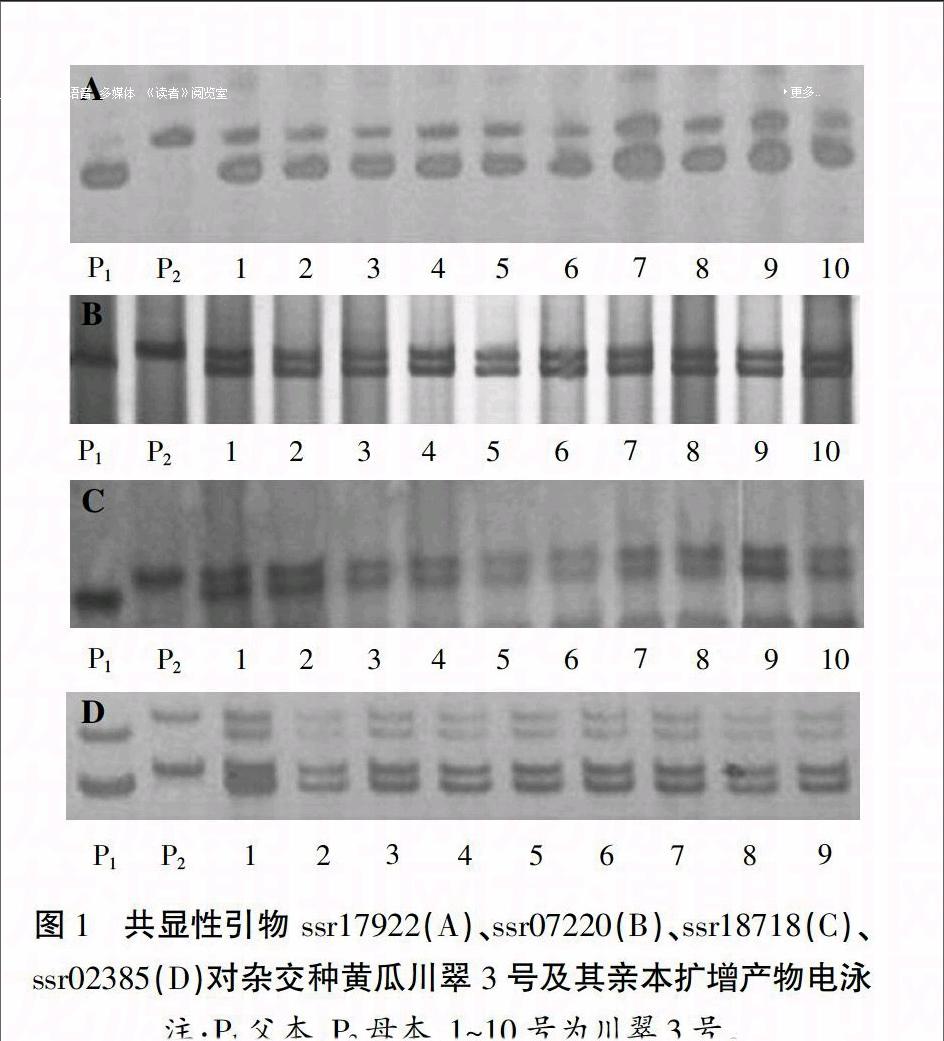
用164对SSR引物对亲本DNA进行扩增,每对引物扩增的位点为1~2个,片段大小介于100~500 bp。扩增后电泳检测显示12对引物亲本间有多态性,多态性比例为7.31%。其中4对引物(ssr17922、ssr07220、ssr18718、ssr02385)在F1中呈共显性(表1),条带清晰,亲本特征片段分子量差异大于10 bp,分别位于1号、3号和6号染色体。这4对SSR引物扩增出的条带可以明确区分杂交种F1和亲本(图1)。这4对引物组成了川翠3号及其亲本的DNA指纹图谱(表2)。
2.2 杂交种SSR纯度鉴定
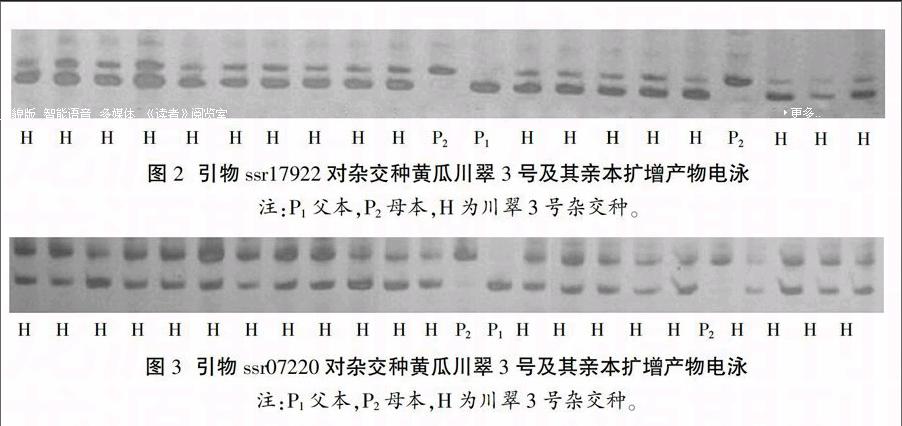
利用ssr17922、ssr07220、ssr18718、ssr02385 4对引物对100株F1进行鉴定。结果显示,这4对引物在99株单株中均扩增出含双亲条带的杂合带型,1株为母本基因型(图2、3)。因此,分子标记鉴定结果表明,该100株单株中有真杂种99株,纯度为99.0%,1株假杂种为母本。
2.3 杂交种田间鉴定
盛果期对100株标记单株进行田间鉴定,其中99株表现一致,所有农艺性状均符合川翠3号黄瓜植物学性状描述,显示为真杂种,1株杂株的植物学性状与母本一致。因此,田间鉴定结果表明,该100株单株的纯度为99.0%,1株假杂种为母本混杂。
3 讨论与结论
本试验结果表明,田间鉴定与分子标记鉴定结果均显示该100株杂种群体的纯度为99.0%,且假杂种田间编号与分子标记纯度鉴定的编号一致。因此,分子标记纯度鉴定方法准确、有效,可代替田间纯度鉴定。
研究发现的4对引物ssr17922、ssr07220、ssr18718、ssr02385在川翠3号黄瓜及其亲本中呈共显性,条带清晰、稳定、易识别,这些特殊SSR 条带构成了该品种及其亲本的指纹图谱。使用ssr17922、ssr07220、ssr18718、ssr02385中的任何一组引物都能准确迅速地鉴定川翠3号及其亲本,4组引物可以鉴别川翠3号和其他品种。川翠3号指纹图谱的构建不仅能为该品种真伪鉴别和材料提纯提供技术支持,为黄瓜新品种的审定和保护提供重要依据,并在新品种的DUS测试和品种资源遗传多样性的评价等方面具有重要的应用价值。此外,该指纹图谱还能为川翠3号相关表型性状基因的定位分析提供信息,缩小引物筛选范围,同时为同类型华北型黄瓜纯度鉴定提供可供选择的标记。
使用分子标记开展纯度鉴定迅速、准确,可节省大量人力和时间。杂交种纯度低不仅损害经营企业的声誉和利益,缩短品种的推广年限,还会导致产量下降,影响农民收益。目前,种子公司经常采用的鉴定方法是将当年生产的杂交种抽样到海南南繁基地进行田间纯度检测,形态性状易受气候条件和栽培措施等方面的影响,准确性较差,而且成本高、时间长。本试验中,田间纯度鉴定从播种到盛果期进行植物学性状调查,耗时2个月,且催芽、育苗、整地、定植、田间管理、植物学性状调查等需要大量人工,而应用分子标记进行纯度鉴定需要催芽、提取DNA、PCR和凝胶电泳,选取1对引物进行分析鉴定,整个周期约1周,且鉴定结果准确,不受环境影响。
本研究中,亲本间多态性引物仅占164对引物的7.31%,表明川翠3号黄瓜亲本间遗传背景较窄。性状调查表明,该品种亲本间差异仅能通过瓜色、瓜形的差异来判断,容易误判并且在无瓜情况下很难判断品种真实性。使用SSR分子标记能大大提高纯度鉴定的准确性,是窄遗传背景杂交种子纯度鉴定的有效方法。
参考文献
[1] 彭锁堂,庄杰云,颜启传,等.我国主要杂交水稻组合及其亲本SSR标记和纯度鉴定[J].中国水稻科学,2003,17(1):1-5.
[2] 徐艳芳,向殉朝,张艳丽,等.SSR技术对杂交稻种冈优
188的纯度鉴定[J].种子,2012,31(7):126-128.
[3] 赵虹,徐国华,廖芳丽.SSR分子标记技术在杂交水稻种子纯度鉴定中的作用[J].湖北农业科学,2011,50(17):
3 490-3 491.
[4] 赵虹,张宇飞,林梅,等.SSR鉴定水稻两系杂交种纯度的运用与探讨Ⅳ.不同品种同一引物检测试验[J].湖北农业科学,2012,51(21):4 720-4 721.
[5] 李晓辉,李新海,李文华,等.SSR标记技术在玉米杂交种种子纯度测定中的应用[J].作物学报,2003,29(1):63-68.
[6] 郎需勇,吴建功,杨亮,等.SSR分子标记技术在杂交棉纯度鉴定中的应用[J].中国棉花,2012,39(9):17-20.
[7] 葛瑞华,田东洋,袁小玲,等.湘农大棉1号的SSR数字指纹图谱构建及纯度鉴定[J].中国农学通报,2012,28(6):79-83.
[8] 张宁洁,陈丽,朱文秀,等.SSR标记在油菜隐性核不育杂交种的纯度鉴定研究[J].安徽农业科学,2012,40(11):
6 376-6 377.
[9] 曲亮,陈卫江,李莓,等.SSR标记技术在甘蓝型油菜杂交种纯度鉴定中的应用[J].湖南农业大学学报:自然科学版,2009,35(3):229-232.
[10] 王利英,乔军,石瑶,等.茄子SSR多态性引物的筛选及品种纯度鉴定[J].华北农学报,2012,27(4):98-101.
[11] 管志坤,罗双霞,李艳霞,等.利用SSR标记鉴定油绿3号大白菜品种纯度[J].种子,2011,30(9):34-35.
[12] 赵新,文正华,王永,等.花椰菜杂交种科润F1代种子纯度的EST-SSR鉴定[J].种子,2012,31(5):119-122.
[13] 张桂华,李家旺,张文珠,等.利用SSR 技术对黄瓜新品种津优35 号进行种子纯度鉴定[J].北方园艺,2010(12):140-141.
[14] Ren Y, Zhang Z H, Lui J H, et al. An integrated genetic and cytogenetic map of the cucumber genome[J]. PLoS One, 2009(6): 1-8.
[15] Miao H, Zhang S P, Wang X W, et al. A linkage map of cultivated cucumber (Cucumis sativus L.) with 248 microsatellite marker loci and seven genes for horticulturally important traits[J]. Euphytica, 2011, 182:167-176.
[16] Zhang W W, Pan J S, He H L, et al. Construction of a high density integrated genetic map for cucumber (Cucumis sativus L.)[J]. Theor Appl Genet, 2012, 124:249-259.
[17] Li Y H, Yang L M, Pathak M, et al. Fine genetic mapping of cp: a recessive gene for compact (dwarf) plant architecture in cucumber, Cucumis sativus L.[J]. Theor Appl Genet, 2011, 123: 973-983.
[18] Zhang S P, Miao H, Yang Y H, et al. A major quantitative trait locus conferring resistance to fusarium wilt was detected in cucumber by using recombinant inbred lines[J]. Mol Breeding, 2014, 34(4): 1 805-1 815.
[19] Hu J, Wang L, Li J. Comparison of genomic SSR and EST-SSR markers for estimating genetic diversity in cucumber[J]. Biologia Plantarum, 2011, 55: 577-580.
[20] Pandey S, Ansari W A, Mishra V K, et al. Genetic diversity in Indian cucumber based on microsatellite and morphological markers[J]. Biochemical Systematics and Ecology, 2013, 51: 19-27.
Abstract: In order to establish fast purity identification system for hybrid cucumber cultivar Chuancui No.3 seed, we used 164 pairs SSR primers which covered whole genome for purity identification and polymorphic analysis of cucumber cultivar Chuancui No.3 and its parents. The results showed that, four primers were stably codominant, their electrophoretogram were clear, easy to distinguish, and had high specialty, its molecular marker identification purity was 99.0% by detecting some cucumber cultivar Chuancui No.3 seeds, which was the same as the field identification result,they could be used to distinguish medley female parent, male parent and other seeds. So, the fingerprint with these four pairs primers could provide more accurate technical guidance for authenticity identification, purity test and parents purification of hybrids.
Key words: Cucumber; Chuancui No.3; SSR fingerprint; Purity identification

