乙酰木聚糖酯酶协同木聚糖酶降解木聚糖的研究
朱天地,何 瑶,杨 标,刘加驰,邬敏辰*
(1.江南大学 生物工程学院 江苏 无锡214122;2.江南大学 无锡医学院 江苏 无锡214122)
乙酰木聚糖酯酶协同木聚糖酶降解木聚糖的研究
朱天地1,何 瑶1,杨 标2,刘加驰2,邬敏辰*2
(1.江南大学 生物工程学院 江苏 无锡214122;2.江南大学 无锡医学院 江苏 无锡214122)
探讨了宇佐美曲霉(Aspergillus usamii)乙酰木聚糖酯酶和第10、11家族木聚糖酶之间的协同作用。利用作者所在实验室构建保藏的3株工程酵母Pichia pastoris GS115/Auaxe、GS115/ Auxyn11A和GS115/Auxyn10A进行甲醇诱导发酵,分别获得重组乙酰木聚糖酯酶和木聚糖酶。在木聚糖酶最适pH、40℃、料液质量体积比1 g∶60mL、水解2 h的条件下分别研究了不同加酶量作用于小麦麸皮时生成的还原糖量。结果表明,乙酰木聚糖酯酶与第11家族木聚糖酶有更好的协同作用,并在添加量比(酶活力比)为5∶1时所测协同效果最好,还原糖生成量较木聚糖酶单独作用增加了46%。因此,在乙酰木聚糖酯酶的作用下,木聚糖上乙酰基的去除,对提高木聚糖酶对木聚糖的水解效率具有重要作用。
乙酰木聚糖酯酶;木聚糖酶;协同作用;木聚糖
半纤维素是自然界中除纤维素以外最丰富的可再生生物资源,木聚糖是植物细胞壁中半纤维素的重要组成成分,约占植物细胞干重的15%-35%[1]。木聚糖是连接木质素和纤维素的“桥梁”。在果胶等物质的参与下,木聚糖的侧链基团和木质素以化学键相互连接,并与纤维素结合,形成致密的结构,这种致密结构是细胞壁稳定的基础[2]。木质纤维素中的木聚糖主要可分为硬木木聚糖 (被子植物)和软木木聚糖(裸子植物和一年生植物)[3]。硬木木聚糖以O-乙酰-4-O-甲基葡萄糖醛酸木聚糖的形式存在,聚合度在150~200之间,通常在木糖的C-3位点高度乙酰化。与硬木木聚糖不同,软木木聚糖为阿拉伯-4-O-甲基葡萄糖醛酸木聚糖,聚合度小,在70~130之间,以α-L-阿拉伯呋喃糖基替代乙酰基,并通过α-1,3-糖苷键与木糖残基相连[4]。木聚糖的结构也是多种多样,通常包含不同的侧链基团,如阿拉伯糖、O-乙酰基、阿魏酸、4-O-甲基葡萄糖醛酸和香豆酸等[5]。这些侧链基团是影响其被水解的因素之一,产生空间障碍,限制了主链降解酶和主链的接触,降低了可及性[6-7]。
广义上来讲,木聚糖酶(Xylanase)指的是一类具有将木聚糖水解为低聚木糖及木糖作用的酶的总称。由于木聚糖的来源及其结构复杂性不同,其完全降解需要多种酶的协同作用,其中主要包括β-1,4-内切木聚糖酶(β-1,4-endoxylanase,EC 3.2.1.8)、β-1,4-外切木聚糖酶(β-1,4-exoxylanase,EC 3.2.1.37)和β-木糖苷酶3种。此外,还有一些作用于木聚糖支链的水解酶,如α-L-呋喃阿拉伯糖苷酶、乙酰木聚糖酯酶、阿魏酸酯酶和p-香豆酸酯酶等[8]。基于酶蛋白一级结构的同源性及疏水簇分析,绝大多数木聚糖酶都属于糖苷水解酶(Glycoside Hydrolase,GH)10和11家族[9]。GH11家族木聚糖酶具有底物特异性高、相对分子质量小(<30 000)和等电点一般为中性等特点。GH10家族木聚糖酶具有作用底物广泛、高相对分子质量(>30 000)及等电点偏酸性等特点。由于木聚糖的彻底降解需要多种酶的协同作用,Faulds等[10]人做了关于阿魏酸酯酶与GH11和GH10协同作用释放酚酸方面的研究。Várnai等[11]人报道了关于木聚糖酶与甘露聚糖酶协同作用于软木的相关研究。迄今为止,关于乙酰木聚糖酯酶与木聚糖酶之间的协同作用鲜有报道。
乙酰木聚糖酯酶(EC 3.1.1.6,Acetyl Xylan Esterase,AXE)能够消除乙酰化木聚糖中木糖残基C-2和C-3位的O-乙酰取代基。作者利用实验室构建保藏的 3株工程酵母 Pichia pastoris GS115/ Auaxe、GS115/Auxyn10A和 GS115/Auxyn11A进行甲醇诱导发酵,分别获得重组乙酰木聚糖酯酶、GH10和GH11家族木聚糖酶,双酶协同降解小麦麸皮。作者为酶法高效水解农业废弃物奠定了一定的基础。
1 材料与方法
1.1菌株和培养基
P.pastoris GS115/Auaxe、GS115/Auxyn11A 与GS115/Auxyn10A工程菌株均由江南大学无锡医学院分子生物学实验室构建和保藏;YPD、BMGY和BMMY培养基参考 Multi-Copy Pichia Expression Kit(Invitrogen公司)操作手册。
1.2材料和试剂
生物素、酵母提取物、YNB、胰蛋白胨均购自上海Sangon公司;榉木木聚糖购自美国Sigma公司;麸皮购自农贸市场,去淀粉麸皮的处理按照Mukherjee等[12]和龚燕燕等[13]提供的方法,每次处理做3组平行实验,每次预处理后并没有发现统计学差异;其它化学试剂均为国产或进口分析纯。
1.3乙酰木聚糖酯酶和木聚糖酶粗酶液的制备
分别挑取 GS115/Auaxe、GS115/Auxyn11A和GS115/Auxyn10A单菌落接种到25 mL液体BMGY中,30℃、220 r/min条件下振荡培养24 h,室温静置约1~2 h,弃上清,加入30 mL的BMMY,于同样条件下培养至72 h,每隔24 h添加体积分数1%的甲醇进行诱导。酵母发酵液于8 000 r/min离心10 min,收获上清即分别为重组乙酰木聚糖酯酶和木聚糖酶粗酶液。
1.4酶活的测定
以对硝基苯酚醋酸酯为底物,用分光光度法测定经重组乙酰木聚糖酯酶(reAuAxe)水解后产物中对硝基苯酚的吸光值。具体步骤按Krastanova等[14]提供的方法稍作修改:取0.04 mL 100 mmol/L的底物 (DMSO溶解)与0.86mL 100mmol/L的磷酸盐缓冲液(pH 6.0)混匀,加入0.1 mL适当稀释的酶液,50℃下准确反应10 min后加入3 mL甲醇终止反应,再加入2 mL去离子水,测定A410。在上述反应条件下,1个酶活性单位 (U)定义为每分钟产生1 μmol对硝基苯酚所需的酶量。
采用改进的DNS法[8]测定木聚糖酶酶活,2.4 mL 0.5%木聚糖溶液 (pH 4.6)加入0.1 mL适当稀释倍数的酶液,于50℃下反应15 min,加入2.5 mL DNS试剂,沸水浴中显色7min,测定A540nm。在上述反应条件下,一个酶活性单位(U)定义为每分钟产生1μmol还原糖所需的酶量。
1.5乙酰木聚糖酯酶与木聚糖酶协同作用的研究
1.5.1不同加酶量的协同作用为了研究乙酰木聚糖酯酶与木聚糖酶之间是否有协同作用,先确定木聚糖酶单独作用去淀粉小麦麸皮时的添加量,然后再研究乙酰木聚糖酯酶添加量的影响。分别准确称取0.5 g去淀粉小麦麸皮于100mL摇瓶中,加入不同单位木聚糖酶(50~200 U),以100 mmol/L、pH 5.0磷酸钠缓冲液将反应体系补至终体积为30 mL,置于40℃恒温振荡器中酶解2 h后沸水浴10 min终止反应。水解液于10 000 r/min离心10 min,然后测定上清液中还原糖的含量。
1.5.2不同加酶顺序的协同作用为了验证乙酰木聚糖酯酶和木聚糖酶是否有协同作用,均以0.5 g去淀粉小麦麸皮为底物,分别设计了以下反应体系:1)只添加缓冲液反应2 h;2)只加入木聚糖酶反应2 h;3)只加入乙酰木聚糖酯酶反应2 h;4)先加木聚糖酯反应2 h,酶灭活后再加乙酰木聚糖酯酶反应2 h;5)同时加入乙酰木聚糖酯酶和木聚糖酶反应2 h;6)先加木聚糖酶反应2 h,酶灭活后再加乙酰木聚糖酯酶反应2 h。
1.5.3不同酶量比的协同作用分别准确称取0.5 g去淀粉小麦麸皮于100 mL摇瓶中,加入不同酶量比的reAuAxe和11家族重组木聚糖酶(reAuXyn11A)酶液,以100mmol/L、pH 5.0磷酸钠缓冲液将反应体系补至终体积为30mL,置于40℃恒温振荡器中酶解2 h后沸水浴10min终止反应。水解液于10 000 r/min离心10 min,然后测定上清液中还原糖的含量。以底物中只加缓冲液的相同体系经相同处理的样品作为对照。为防止反应体系中微生物对还原糖的降解,在反应体系中添加了终质量浓度为100mg/mL的氨苄青霉素。
不同酶量比(酶活力比)的reAuAxe和10家族木聚糖酶 (reAuXyn10A)反应体系除100mmol/L、pH 5.5磷酸钠缓冲液外其他条件均与上述相同。
2 结果与分析
2.1乙酰木聚糖酯酶和木聚糖酶的酶学性质
Koseki[15]等人克隆表达了来自米曲霉的乙酰木聚糖酯酶,此乙酰木聚糖酯酶的最适温度和pH分别是45℃和6.0,在40~50℃、pH 6.0~7.0范围内酶活性稳定。黄孢原毛平革菌的乙酰木聚糖酯酶酶活大小为39.86 U/mg,最适温度及pH分别为30~35℃和7.0[16]。根据1.4中酶活的测定方法,reAuAxe的酶活为35.6 U/mL,reAuXyn11A的酶活则为582 U/mL,reAuXyn10A的酶活则为 170 U/mL。reAuAxe、reAuXyn11A及reAuXyn10A酶学性质[17-18]如表1所示。来自宇佐美曲霉的第10家族木聚糖酶和第11家族木聚糖酶的最适pH分别是5.5和5.0,而乙酰木聚糖酯酶在pH在4.5~7.0范围内仍有较高活性,所以乙酰木聚糖酯酶和第10和11家族木聚糖酶协同作用时反应pH分别为5.5和5.0。与米曲霉乙酰木聚糖酯酶比较可见,reAuAxe的最适温度更高一些,且pH稳定性范围更广。与黄孢原毛平革菌乙酰木聚糖酯酶比较,reAuAxe的酶活性更高并且最适温度比前者高近20℃。将3种不同来源的乙酰木聚糖酯酶的相关酶学特性进行比较可见,reAuAxe有着酶活性更高、pH稳定性范围更广的优势。

表1 reAuAxe、reAuXyn11A及reAuXyn10A的酶学性质Table 1 Enzymatic properties of reAuAxe,reAuXyn11A and reAuXyn10A
2.2乙酰木聚糖酯酶与GH11家族木聚糖酶的协同降解作用
2.2.1不同加酶量的协同作用按照1.5.1中的方法,考察最佳木聚糖酶添加量,结果如图1所示,在50~200 U之间,还原糖量随着酶添加量的增加而逐渐升高。当酶量为150 U时,生成的还原糖量为0.75mg/mL,但当酶添加量大于150 U时,还原糖量趋于平稳。因此,最佳木聚糖酶添加量为150 U。确定木聚糖酶添加量后,再研究乙酰木聚糖酯酶的添加量。

图1 不同加酶量对还原糖释放量的影响Fig.1 Effects of enzyme concentration on the release of reducing sugar
2.2.2不同加酶顺序的协同作用如图2所示,在反应体系中只添加缓冲液或乙酰木聚糖酯酶均没有检测到还原糖的释放(方案1和3)。如方案4、5 和6所示,在反应体系中先添加reAuXyn11A、同时添加两种酶、先添加reAuAxe,分别释放出0.78、0.89、1.00mg/mL的还原糖,比单独添加reAuXyn11A时还原糖的产生量分别提高了5.0%、20.2%和35.1%。方案4与方案2相比,方案4中还原糖量略高一点,可能是由于木聚糖酶作用木聚糖主链生成不同大小的片段,然后乙酰木聚糖酯酶作用于这些片段,使其结构疏松,暴露出少量的还原端,所以还原糖量会增加但是增加量不大。方案5比方案2还原糖量增加了20.2%,说明双酶在协同降解去淀粉小麦麸皮的过程中有一定的协同作用。方案6比方案5生成的还原糖量多,可能是由于乙酰木聚糖酯酶先作用于木聚糖,能更充分的消去侧链的乙酰基团,使得木聚糖酶有更多的机会作用于木聚糖主链,并且总的反应时间也比方案5时间长,所以生成的还原糖量要更多。
2.2.3不同酶量比(酶活力比)的协同作用按照
1.5.2中的方法研究不同酶量比时 reAuAxe与reAuXyn11A的协同作用,结果如图3所示,不同酶量比产生还原糖的量不同。随着 reAuAxe与reAuXyn11A比例的增加,还原糖的产量也逐渐增加,但是还原糖增加量的趋势变缓,可能是由于加酶量达到饱和。当reAuAxe与reAuXyn11A的添加酶量比为5∶1时协同效果较好,还原糖生成量比木聚糖酶单独作用增加了46%。该结果表明,去淀粉麸皮中木聚糖上乙酰基的去除,对提高木聚糖酶的水解效率具有重要作用。Huy[16]等人分别以桦木木聚糖、榉木木聚糖和阿拉伯糖基木聚糖为底物研究黄孢原毛平革菌的乙酰木聚糖酯酶和木聚糖酶的协同作用,结果还原糖的增加量分别提高了19.4%,11.2%和6.3%。综上所述,来自宇佐美曲霉的乙酰木聚糖酯酶和GH11家族木聚糖酶的协同作用效果更好。
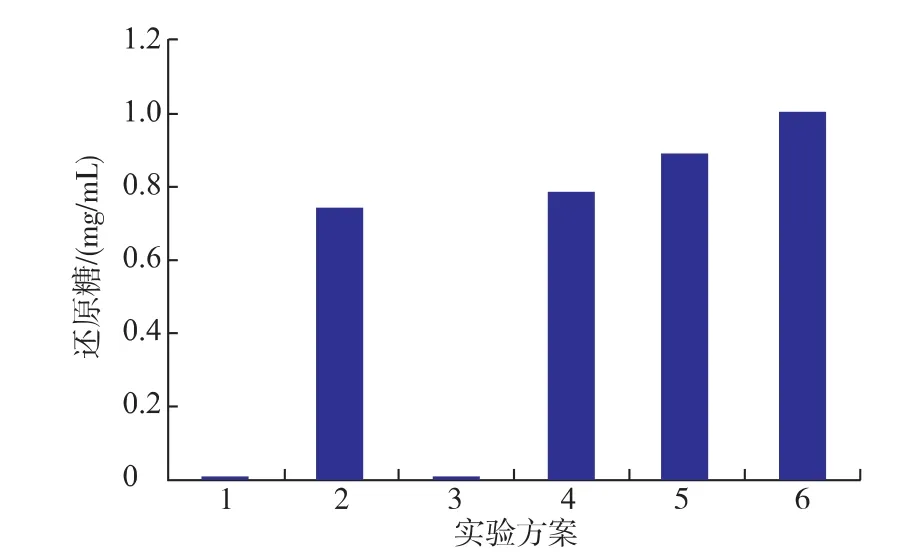
图2 加酶顺序对还原糖释放量的影响Fig.2 Effects of the addition order on the release of reducing sugar

图3 不同酶量比对还原糖释放量的影响Fig.3 Effects of different enzyme ratios on the release of reducing sugar
2.3乙酰木聚糖酯酶与GH10家族木聚糖酶的协同降解作用
2.3.1不同加酶顺序的协同作用如图4所示,在反应体系中只添加缓冲液或乙酰木聚糖酯酶均没有检测到还原糖的释放(方案1和3)。如方案4、5 和6所示,在反应体系中先添加reAuXyn10A、同时添加两种酶、先添加reAuAxe,均能释放出还原糖,比单独添加reAuXyn10A时还原糖的产生量分别提高了5.3%、6.6%和14.6%。方案5与方案6的还原糖生成量均低于reAuAxe与reAuXyn11A作用生成还原糖的量。
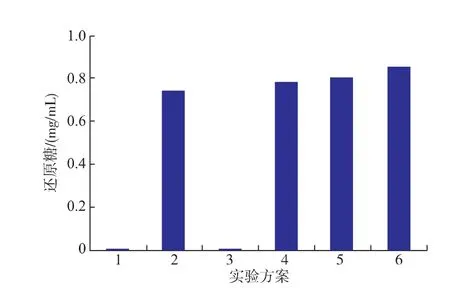
图4 加酶顺序对还原糖释放量的影响Fig.4 Effects of the addition order on the release of reducing sugar
2.3.2不同酶量比(酶活力比)的协同作用按照1.5.2中的方法测不同酶量比时 reAuAxe与reAuXyn10A的协同作用大小,结果如图5所示,不同的酶质量比例产生的还原糖量不同,随着reAuAxe和reAuXyn10A比例的增加产生的还原糖量逐渐增加,由于加酶量达到饱和,增加趋势平缓。当reAuAxe和reAuXyn10A添加量比为5∶1时协同效果较好,还原糖生成量比木聚糖酶单独作用增加了16%。比reAuAxe与reAuXyn11A协同作用还原糖增加量小,可能是受限于小麦麸皮组织缝隙的大小,使得分子量小的reAuXyn11A更容易进入组织水解木聚糖[19],另外由于11家族木聚糖酶空间位阻比较大,而10家族木聚糖酶的空间位阻较小,所以木聚糖侧链的乙酰基团的去除对于reAuXyn11A的影响比较大,综上所述,reAuAxe与reAuXyn11A的协同作用效果要更好。
3 结语
中国是农业大国,每年都产生很多的农业废弃物,如小麦麸皮、玉米芯、谷物类及甘蔗渣,都是地球上丰富的可再生有机碳源。中国近年来小麦的年产量超1亿多吨,随之每年产生高达2 000多万吨的副产品-麸皮,多被丢弃或用作动物饲料。麸皮是一种含量丰富的工业副产物,它可以进一步被降解利用,生产寡糖及发酵所需的糖。由于麸皮中木聚糖结构的复杂性,仅仅利用单个的酶作用很难高效、彻底地将其降解。木聚糖侧链上的乙酰基团的存在对木聚糖酶降解木聚糖产生了阻碍作用,进而影响底物的水解效率。乙酰木聚糖酯酶能够消除乙酰化木聚糖中木糖残基C-2和C-3位的O-乙酰取代基,从而提高木聚糖酶对主链的可及性,提高酶解效率。
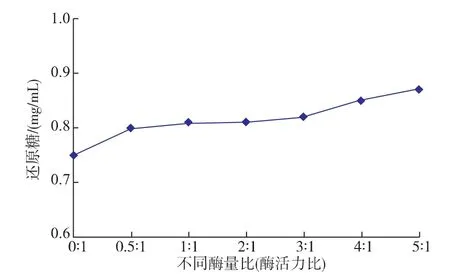
图5 不同酶量比对还原糖释放量的影响Fig.5 Effects of different enzyme ratios on the release of reducing sugar
作者以去淀粉小麦麸皮为研究对象,经试验确定reAuAxe和GH11家族reAuXyn11A在酶量比为5∶1,酶解时间为2 h,酶解温度为40℃,pH为5.0,料液质量体积比为1 g∶60mL时还原糖的生成量比木聚糖酶单独作用增加了46%。而 reAuAxe和GH10家族reAuXyn10A酶活力比为5∶1时在pH 5.5、40℃、料液质量体积比1 g∶60 mL、水解2 h的条件下还原糖的生成量比木聚糖酶单独作用增加了16%。由此可见,乙酰木聚糖酯酶与GH11家族reAuXyn11A协同作用效果更好。
[1]谢响明,孙晓霞,吴玉英,等.绿色糖单孢菌产木聚糖酶规律及其耐碱耐热性的初步研究 [J].生命科学研究,2005,9(1):55-59. XIE Xiangming,SUN Xiaoxia,WU Yuying,et al.Studies of xylanase from Saccharomonospora viridis and analysis of its thermostability and alkali-tolerance[J].Life Science Research,2005,9(1):55-59(in chinese).
[2]Beg Q K,KapoorM,Mahajan L,etal.M icrobialxylanasesand their industrialapplications:a review[J].Applied M icrobiology and Biotechnology,2001,56(3-4):326-338.
[3]Sunna A,Antranikian G.Xylanolytic enzymes from fungiand bacteria[J].Critical Reviews in Biotechnology,1997,17(1):39-67.
[4]Puls J.Chem istry of hemicelluloses:relationship between hem icellulose structure and enzymes required for hydrolysis[J]. Macromolecular Symposia,1997,120(1):183-196.
[5]Tang CD,Guo J,Wu M C,etal.Cloning and bioinformaticsanalysisof a novelacidophilicβ-mannanase gene,Auman5A,from Aspergillus usamii YL-01-78[J].W orld Journal of M icrobiology and Biotechnology,2011,27(12):2921-2929.
[6]De Vries R P,Visser J.Aspergillus enzymes involved in degradation of plant cellwall polysaccharides[J].M icrobiology and M olecular Biology Reviews,2001,65(4):497-522.
[7]Biely P,Cote G L,Kremnicky L,etal.Action ofacetylxylan esterase from Trichoderma reesei on acetylatedmethylglycosides[J]. FEBS Letters,1997,420(2):121-124.
[8]Wang JQ,Zhang H M,Wu M C,et al.Cloning and sequence analysis of a novel xylanase gene,Auxyn10A,from Aspergillus usamii[J].Biotechnology Letters,2011,33(5):1029-1038.
[9]Cantarel B L,Coutinho PM,Rancurel C,et al.The Carbohydrate-Active EnZymes database(CAZy):an expert resource for glycogenom ics[J].Nucleic Acids Research,2009,37(1):233-238.
[10]Faulds C B,MandalariG,Curto RB L,etal.Synergy between xylanases from glycoside hydrolase family 10 and family 11 and a feruloyl esterase in the release of phenolic acids from cereal arabinoxylan[J].App lied M icrobiology and Biotechnology,2006,71(5):622-629.
[11]Várnai A,Huikko L,Pere J,et al.Synergistic action of xylanase and mannanase improves the total hydrolysis of softwood[J]. Bioresource Technology,2011,102(19):9096-9104.
[12]Mukherjee G,Singh R K,M itra A,et al.Ferulic acid esterase production by Streptomyces sp[J].Bioresource Technology,2007,98(1):211-213.
[13]Gong Y Y,Yin X,Wu M C,etal.Cloning,expression of a feruloylesterase from Aspergillus usamii E001 and itsapplicability in generating ferulic acid from wheatbran[J].Journal of IndustrialM icrobiology and Biotechnology,2013,40(12):1433-1441.
[14]Krastanova I,Guarnaccia C,Zahariev S,etal.Heterologousexpression,purification,crystallization,X-ray analysisand phasing of the acetyl xylan esterase from Bacillus pumilus[J].Biochim ica et Biophysica Acta:Proteins and Proteom ics,2005,1748(2):222-230.
[15]Koseki T,M iwa Y,Akao T,et al.An Aspergillus oryzae acetyl xylan esterase:Molecular cloning and characteristics of recombinantenzyme expressed in Pichia pastoris[J].Journal of Biotechnology,2006,121(3):381-389.
[16]Huy N D,Thiyagarajan S,Kim DH,et al.Cloning and characterization of a novel bifunctional acetyl xylan esterase w ith carbohydrate bindingmodule from Phanerochaete chrysosporium[J].Journal of Bioscience and Bioengineering,2013,115(5):507-513.
[17]Zhang H M,Wang J Q,Wu M C,et al.Optimized expression,purification and characterization of a family 11 xylanase (AuXyn11A)from Aspergillus usamii E001 in Pichia pastoris[J].Journal of the Science of Food and Agriculture,2014,94 (4):699-706.
[18]Wang JQ,Yin X,Wu M C,etal.Expression of a family 10 xylanase gene from Aspergillus usamii E001 in Pichia pastoris and characterization of the recombinantenzyme[J].Journal of IndustrialM icrobiology&Biotechnology,2013,40(1):75-83.
[19]FauldsCB,MandalariG,Lo Curto RB,etal.Synergy between xylanases from glycoside hydrolase fam ily 10 and fam ily 11 and a feruloyl esterase in the release of phenolic acids from cereal arabinoxylan[J].App lied M icrobiology and Biotechnology,2006,71(5):622-629.
Combinative Degradation of Xylan with Acetyl Xylan Esterase and Xylanase
ZHU Tiandi1,HE Yao1,YANG Biao2,LIU Jiachi2,WUMinchen*2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi214122,China)
The synergetic effect of the recombinant acetylxylan esterase and xylanase from Aspergillus usamii(abbreviated as reAuAxe,reAuXyn11A,reAuXyn10A,respectively)was investigated.Thefermentationof PichiapastorisGS115/Auaxe,GS115/Auxyn11Aand GS115/Auxyn10A was carried out using methanol as inducer and reAuAxe,reAuXyn11A and reAuXyn10A were successfully expressed.The amounts on the release of reducing sugar were optim ized w ith enzyme concentration when incubated for 2 h at the optimal pH under 40℃w ith the solid-liquid ratio of 1 g∶60m L.A better synergistic effectwas found when acetylxylan esterase and reAuXyn11A were combined.Comparing to use xylanase alone,the released reduce sugar could increaseby 46%when reAuAxeand reAuXyn11A wereaddedw ith a ratio of5∶1.The removalof the O-acetylgroups from the xylose residuesby acetylxylan esterasewasnecessary and important for the efficiency improvementof xylan hydrolysis.
acetylxylan esterase,xylanase,synergistic effect,xylan
Q 55
A
1673—1689(2016)03—0375—06
2014-07-01
国家自然科学基金项目(31101229)。
邬敏辰(1962—),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程研究。E-mail:biowmc@126.com

