Eps8抗原改造表位HLA-A*0201限制性抗肿瘤能力观察
姜春俊,周炜均,谢晓灵,杜静文,张宏毫,贺艳杰,李玉华
(南方医科大学珠江医院,广州510282)
·论著·
Eps8抗原改造表位HLA-A*0201限制性抗肿瘤能力观察
姜春俊,周炜均,谢晓灵,杜静文,张宏毫,贺艳杰,李玉华
(南方医科大学珠江医院,广州510282)
目的观察人表皮生长因子受体通路底物8(Eps8)抗原改造表位是否有人白细胞抗原A(HLA-A)*0201限制性抗肿瘤能力。方法 替换Eps8抗原锚定位点氨基酸获得改造肽,用BIMAS、SYFPEITHI在线数据库及Aotodock 4.2软件预测改造表位与HLA-A*0201分子的结合力,筛选出稳定结合的改造表位E1-9V(ILDDIEFFV)、E1-1Y9V(YLDDIEFFV)。用经典肽结合力实验检测各改造表位与HLA-A*0201分子的亲和力。制备天然表位(E1)、E1-9V、E1-1Y9V特异性杀伤性T淋巴细胞(CTLs)。用乳酸脱氢酶(LDH)释放试验检测并比较E1-9V、E1-1Y9V特异性CTLs对MCF-7细胞、沉默Eps8的MCF-7细胞(MCF-7/shRNA)和抗HLA-A2抗体预孵育的MCF-7细胞(MCF-7/A2Ab)的杀伤率,E1-9V、E1-1Y9V特异性CTLs对SW480、U251、K562、IM-9细胞的杀伤率,E1、E1-9V、E1-1Y9V特异性CTLs对T2细胞的杀伤率。结果 E1-9V、E1-1Y9V均可与HLA-A*0201分子B、F对接口袋的氨基酸形成稳定氢键。肽结合力实验结果显示E1-9V、E1-1Y9V与HLA-A*0201均具有高亲和力,且高于天然表位E1,P均<0.05。E1-9V、E1-1Y9V特异性CTLs对MCF-7/shRNA、MCF-7/A2Ab细胞杀伤率明显低于MCF-7细胞,P均<0.05。 E1-9V、E1-1Y9V特异性CTLs对SW480、U251细胞杀伤率明显高于K562、IM-9细胞(P均<0.05)。E1-1Y9V特异性CTLs对T2细胞的杀伤率显著高于E1、E1-9V特异性CTLs,P均<0.05。结论 Eps8抗原改造表位E1-9V、E1-1Y9V与天然表位E1相比具有更高的HLA-A*0201分子亲和力,保留了原有的免疫原性,并且E1-1Y9V抗肿瘤免疫效应强于天然表位E1。
表皮生长因子受体通路底物8;抗原改造改造表位;细胞毒性T淋巴细胞;肿瘤疫苗;人白细胞抗原A*0201
恶性肿瘤严重威胁着人类健康,随着分子肿瘤学的发展,肿瘤的治疗理念发生了新的转变,近年来肿瘤免疫治疗逐渐兴起[1]。多肽疫苗具有易生产、安全性好、特异靶向肿瘤组织、特异性免疫反应强等特点,已成为肿瘤免疫治疗领域的一个热点。近年来,多种肿瘤抗原肽疫苗已进入临床试验阶段,并取得令人兴奋的结果[2, 3]。寻找多肽疫苗新靶点及对优势肽进行改造以提高其免疫原性和体内稳定性成为首要任务。表皮生长因子受体通路底物8(Eps8) 是表皮生长因子受体(EGFR)重要的激酶活性底物之一[4],是近年来新发现的肿瘤相关抗原[5],广泛高表达于乳腺癌、胶质瘤、结肠癌等实体肿瘤及血液系统恶性肿瘤中(包括白血病、多发性骨髓瘤等)[6],而在正常组织细胞内几乎不表达,与肿瘤的发生、增殖及转移密切相关[7]。因此,Eps8可能成为一个有效的肿瘤治疗靶点。人白细胞抗原A (HLA-A)*0201是中国人群中最常见的HLA-Ⅰ类分子[8],阳性率高达50%。大多数多肽不是良好的免疫原,受到肿瘤的免疫耐受机制及各种因子的制约,不能充分诱导CD8+T细胞的免疫反应。主要原因之一是多肽与主要组织相容性复合物(MHC)分子的亲和力很差。研究表明[9~11],对一些肿瘤相关抗原表位进行改造可以提高其MHC亲和力、降低其在体内的水解速度、提高免疫系统对肿瘤相关抗原特异性杀伤性T淋巴细胞(CTLs)的识别等,但是关于改造表位肽是否保留了原有的抗原性有待进一步证实。2013年9月~2015年6月,我们观察了Eps8抗原改造表位的HLA-A*0201限制性抗肿瘤能力,旨在寻找结合力高同时又保留原有抗原性的新表位。
1 材料与方法
1.1材料靶细胞中人转运相关蛋白(TAP)缺陷性T2细胞株购自ATCC公司,人多发性骨髓瘤细胞株IM-9购自广州吉妮欧生物科技有限公司,人神经胶质瘤细胞株U251、人结肠癌细胞株SW480、人乳腺癌细胞株MCF-7和人红白血病细胞株K562均由本实验室长期保留。上述细胞用含有10%胎牛血清的DMEM或RPMI1640培养液,置于37 ℃、5%CO2孵箱中培养。取对数生长期细胞进行实验。HLA-A*0201阳性人外周血单个核细胞(PBMCs)由本实验室分离保存。抗Eps8抗体购自Abcam公司,抗β-actin抗体购自Cell Signaling Technology公司,抗HLA-A*0201抗体购自BD Biosciences公司,FITC-HLA-A2流式抗体购自BD Biosciences公司。人β2微球蛋白购自Sigma公司。Eps8-shRNA慢病毒包装由吉凯公司完成。
1.2人Eps8抗原改造表位的设计、合成及其与HLA-A*0201分子亲和力鉴定用文献[12]报道的方法,通过替换Eps8抗原锚定位点氨基酸获得改造肽,用BIMAS、SYFPEITHI在线数据库及Aotodock 4.2软件[13]预测改造表位与HLA-A*0201分子的结合力,筛选稳定结合的改造表位E1-9V(ILDDIEFFV)、E1-1Y9V(YLDDIEFFV)。改造表位及阳性对照肽IMP58-66(GILGFVFTL)由中肽生化有限公司合成,纯度>95%。用经典肽结合力实验检测各改造表位与HLA-A*0201分子的亲和力[14, 15]。取对数期生长的T2细胞,分别与天然表位(E1)、改造表位(E1-9V、E1-1Y9V)、阳性对照肽(IMP58-66)以及人β2微球蛋白(3 μg/mL)孵育过夜,PBS洗涤2次后,加入抗HLA-A*0201抗体,4 ℃冰浴30 min;洗涤3次后用流式细胞仪检测T2细胞表面的免疫荧光强度。用不加肽的T2细胞作为背景对照。结果用荧光指数(FI)表示,FI=(样品平均荧光强度-背景平均荧光强度)/背景平均荧光强度。FI<1.0为低亲和力,1~1.5为中等亲和力,>1.5为高亲和力。
1.3E1、E1-9V、E1-1Y9V特异性CTLs的制备将HLA-A*0201阳性PBMCs接种于培养瓶,细胞密度1×106/mL,置于37 ℃、5% CO2细胞培养箱内静置贴壁2~4 h,收集悬浮细胞冻存备用。贴壁细胞中加入GM-CSF、IL-4、TNF-α诱导树突状细胞(DC)成熟,培养7 d后收集DC,2 Gy照射灭活后,用10 μg/mL的E1、E1-9V、E1-1Y9V溶液培养DC 2 h获得负肽DC。复苏悬浮细胞,与负肽DC按50∶1比例共培养,次日加入10 ng/mL的IL-7和50 U/mL的IL-2。此后每周用负肽DC重复刺激1次,刺激3个周期后,收集E1、E1-9V、E1-1Y9V特异性CTLs用于后续实验。
1.4E1-9V、E1-1Y9V特异性CTLs对MCF-7细胞、沉默Eps8的MCF-7细胞(MCF-7/shRNA)和抗HLA-A2抗体预孵育的MCF-7细胞(MCF-7/A2Ab)的杀伤效果测算MCF-7/shRNA制备方法为取对数生长期MCF-7细胞接种至24孔板,待细胞生长至70%~80%融合,加入Eps8-shRNA病毒液和5 μg/mL的polybrene工作液转染,24 h后更换培养液为含血清的新鲜培养基继续培养72 h后,于荧光显微镜下观察。加入2 μg/mL嘌呤霉素加压筛选,维持7 d,待非转染细胞全部死亡后,嘌呤霉素减量为0.5 μg/mL维持培养,得到MCF-7/shRNA细胞。MCF-7/A2Ab细胞制备方法参考文献[13]。采用乳酸脱氢酶(LDH)释放试验测算效应细胞(E1-9V、E1-1Y9V特异性CTLs)对靶细胞(MCF-7、MCF-7/shRNA、MCF-7/A2Ab细胞)的杀伤率,效应细胞和靶细胞比例为50∶1。LDH释放试验操作按试剂盒说明书进行。最后用酶标仪在492 nm波长处测量各实验孔及靶细胞最大释放孔、靶细胞自然释放孔、效应细胞自然释放孔、体积矫正孔和培养基对照孔的光密度(OD值)。各实验孔杀伤率(%)=(实验孔OD值-靶细胞自发释放孔OD值-效应细胞胞自发释放孔OD值+培养基对照孔OD值)/(靶细胞最大释放孔OD值-体积校正孔OD值-靶细胞自发释放孔OD值+培养基对照孔OD值)×100%。
1.5E1-9V、E1-1Y9V特异性CTLs对SW480、U251、K562、IM-9细胞的杀伤效果测算 采用LDH释放试验测算效应细胞(E1-9V、E1-1Y9V特异性CTLs)对靶细胞SW480、U251、K562、IM-9细胞的杀伤结果。LDH释放试验操作同1.4。
1.6E1、E1-9V、E1-1Y9V特异性CTLs对T2细胞的杀伤效果测算 效应细胞为E1、E1-9V、E1-1Y9V特异性CTLs,靶细胞为T2细胞(荷天然表位E1)。行LDH释放试验测算杀伤率,操作同1.4。

2 结果
2.1 Eps8抗原改造表位与HLA-A*0201的分子亲和力预测及实验结果SYFPEITHI软件预测改造表位E1-9V、E1-1Y9V与HLA-A*0201亲和力得分均为23分,BIMAS软件预测得分分别为6 185.760、16 737.939分。用Autodock 4.2软件模拟改造表位与HLA-A*0201分子对接,PyMol软件查看对接情况,结果显示E1-9V、E1-1Y9V均可与HLA-A*0201分子B、F对接口袋的氨基酸形成稳定氢键。肽结合力实验结果显示E1-9V、E1-1Y9V与HLA-A*0201分子均具有高亲和力,其FI分别为4.53±0.28、4.94±0.14,高于相应的天然表位E1的1.07±0.04及阳性对照表位的2.31±0.38,P均<0.05。
2.2E1-9V、E1-1Y9V特异性CTLs对MCF-7、MCF-7/shRNA、MCF-7/A2Ab细胞杀伤率比较 见表1。E1-9V、E1-1Y9V特异性CTLs对MCF-7/shRNA、MCF-7/A2Ab细胞杀伤率明显低于MCF-7细胞,P均<0.05。
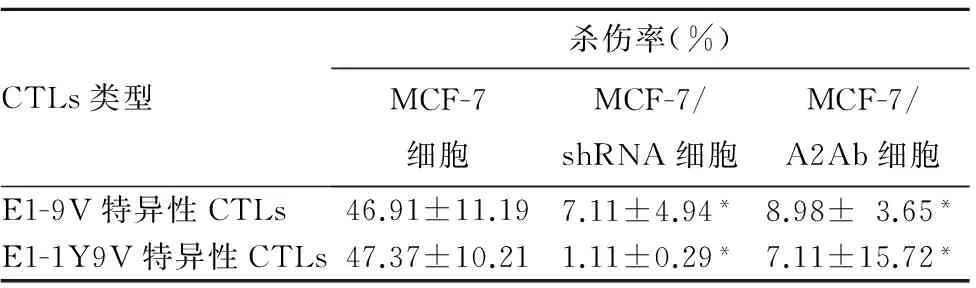
表1 E1-9V、E1-1Y9V特异性CTLs对MCF-7、MCF-7/shRNA、MCF-7/A2Ab细胞杀伤率比较
注:与MCF-7细胞相比,*P<0.05。
2.3E1-9V、E1-1Y9V特异性CTLs对SW480、U251、K562、IM-9细胞杀伤率比较见表2。 E1-9V、E1-1Y9V特异性CTLs对SW480、U251细胞杀伤率明显高于K562、IM-9细胞(P均<0.05), E1-9V、E1-1Y9V特异性CTLs对SW480细胞杀伤率与U251细胞相比差异均无统计学意义,E1-9V、E1-1Y9V特异性CTLs对K562细胞杀伤率与IM-9细胞相比差异均无统计学意义。

表2 E1-9V、E1-1Y9V特异性CTLs对SW480、U251、K562、IM-9细胞杀伤率比较
注:与K562细胞相比,*P<0.05领,与IM-9细胞相比,#P<0.05。
2.4E1、E1-9V、E1-1Y9V特异性CTLs对T2细胞杀伤率比较E1、E1-9V、E1-1Y9V特异性CTLs对载天然表位E1的T2细胞杀伤率分别为38.88%±3.05%、47.31%±4.21%、53.22%±2.21%。E1-1Y9V特异性CTLs对T2细胞的杀伤率显著高于E1、E1-9V特异性CTLs,P均<0.05;E1、E1-9V特异性CTLs对T2细胞的杀伤率差异无统计学意义。
3 讨论
90年代开始,随着对免疫系统和机体抗肿瘤免疫反应的了解逐渐深入,肿瘤免疫治疗开始备受关注。多肽疫苗作为以T细胞为基础的肿瘤免疫疗法之一[17, 18],已经成为近年来的研究热点。不同于传统的化疗和放疗,多肽疫苗在杀伤肿瘤细胞的同时,对正常细胞无杀害作用,具有特异性高、不良反应少、性质稳定、患者依从性好、制备方便等优势[16, 19~21]。T细胞的活化是多肽疫苗抗肿瘤反应的关键步骤,诱发体内细胞毒T淋巴细胞发挥抗肿瘤作用的并不是整个肿瘤抗原分子,而是与MHC分子结合的短肽即CTLs表位,CTLs表位与MHC分子的结合力在CTLs活化过程中起到至关重要的作用,决定了CTLs的特异性杀伤效果。因此,鉴定尽可能多的肿瘤抗原的 CTLs表位具有重要意义。然而肿瘤抗原与MHC分子亲和程度通常不高,且T细胞受体(TCR)识别肿瘤抗原表位的灵敏度不强,使多肽疫苗的免疫原性较弱,易引起免疫耐受,不能诱导强的免疫应答,临床疗效不理想。
文献报道对一些肿瘤相关抗原表位进行改造可以有效提高肽与MHC分子的亲和力,破坏自身表位耐受,从而激发有效的抗肿瘤应答,最终提高多肽疫苗的免疫原性。目前较为常用的CTLs表位肽的改造方法包括改造表位的锚定残基、改造抗原受体识别部位的残基、引入D型氨基酸、引入β-氨基酸等[12, 19~22]。在上述增强CTLs表位肽免疫原性的策略中,对表位采取氨基酸置换修饰的方式,可以得到结合力更高又同时保留原有抗原性的新表位。与MHC-Ⅰ类分子结合的抗原表位多为9个氨基酸,通常与MHC-Ⅰ分子结合的锚定残基位于P2和P9残基(即羧基末端)[23]。当第2位的氨基酸残基为亮氨酸(L)或甲硫氨酸(M),第9位的氨基酸残基为亮氨酸(L)、缬氨酸(V)或异亮氨酸(I)时,表位与HLA-A2分子亲和力较高[24, 25]。另有研究推测将次要锚定位点第1位的氨基酸替换为酪氨酸(Y),依靠其侧链苯环的疏水作用以及酚羟基的氢键作用也能够增强表位肽与HLA分子的相互作用。Herve等[26]将13条天然Ri-2表位的P2替换为亮氨酸(L),P9替换为缬氨酸(V),结合力实验发现这13条改造肽中,7条改造肽显示出高结合力。Tourdot等[27]将32种CTL表位(均为低HLA-A*0201亲和力)的P1残基替换为酪氨酸(Y)后,所有表位的HLA-A*0201亲和力均有所提高,且其抗原特异性不变。有许多肿瘤抗原,如POTE[24](包括POTE252-260、POTE323-331、POTE553-561)、p321[25]、gp100[28](gp100209-217)、MART-1[29](Melan-A26-35)、NY-ESO-1[30](NY-ESO-1157-165)、p53[31]等,它们的MHC的锚定残基经氨基酸替换改造后,其MHC分子亲和力、稳定性及免疫原性显著提高。Cassarino等[32]用gp100改造肽进行了临床试验,结果发现在11例接受gp100改造肽免疫接种的患者中有10例出现免疫应答,提示改造肽有一定的肿瘤免疫治疗效果。大量研究证实,改造表位具有广阔的发展前景,或将成为一种新型肿瘤特异性免疫治疗手段,具有重要的临床意义。
本研究通过对天然表位E1锚定残基的置换获得改造表位,旨在鉴定出保留原有免疫原性且MHC结合力强的新表位。通过在线生物学软件初步筛选得到2个排名靠前的改造表位E1-9V(ILDDIEFFV)、E1-1Y9V(YLDDIEFFV),分子对接结果显示其均可与HLA-A*0201分子形成稳定氢键结合。T2结合力实验发现改造表位与HLA-A*0201分子的结合力显著高于天然表位,与设想的改造结果一致。本研究中,用E1-9V和E1-1Y9V这2个改造表位诱导的特异性CTLs,对高表达Eps8且HLA-A*0201阳性的SW480、U251细胞株杀伤率高于Eps8高表达HLA-A*0201阴性的K562细胞及Eps8低表达HLA-A*0201阳性的IM-9细胞;E1-9V和E1-1Y9V特异性CTLs对沉默Eps8的MCF-7/shRNA和抗HLA-A2抗体预孵育导致HLA-A*0201阴性的MCF-7/A2Ab细胞的杀伤率低于高表达Eps8且HLA-A*0201阳性MCF-7细胞。这表明Eps8改造表位E1-9V和E1-1Y9V保留了原有表位的抗肿瘤作用,这一作用有HLA-A*0201限制性。E1-1Y9V特异性T细胞对T2细胞的毒性作用显著高于E1-9V及天然表位E1,表明其保留原有免疫原性的同时具有更强的促免疫效应。
综上所述,Eps8改造表位E1-9V、E1-1Y9V与天然表位E1相比具有与HLA-A*0201分子更高的亲和力,保留了原有的免疫原性,并且E1-1Y9V抗肿瘤免疫效应强于相应的天然表位。Eps8抗原来源HLA-A*0201限制性改造表位有可能规避免疫耐受,可以考虑将其作为Eps8多肽疫苗的候选表位。
[1] 韩向阳,杨庆华,张静. 增强疫苗诱导的细胞毒性T淋巴细胞抗肿瘤免疫反应的调控[J]. 山东医药,2013,53(39):98-101.
[2] Mittendorf EA, Clifton GT, Holmes JP, et al. Clinical trial results of the HER-2/neu (E75) vaccine to prevent breast cancer recurrence in high-risk patients: from US Military Cancer Institute Clinical Trials Group Study I-01 and I-02[J]. Cancer,2012,118(10):2594-2602.
[3] Brayer J, Lancet JE, Powers J, et al. WT1 vaccination in AML and MDS: A pilottrial with synthetic analog peptides[J]. Am J Hematol,2015,90(7):602-607.
[4] Fazioli F, Minichiello L, Matoska V, et al. Eps8, a substrate for the epidermal growth factor receptor kinase, enhances EGF-dependent mitogenic signals[J]. EMBO J,1993,12(10):3799-3808.
[5] Wang L, Cai SH, Xiong WY, et al. Real-time quantitative polymerase chain reaction assay for detecting the eps8 gene in acute myeloid leukemia[J]. Clin Lab,2013,59(11-12):1261-1269.
[6] 熊文艳,陆志刚,涂三芳,等. Eps8在恶性血液肿瘤细胞株中的表达分析[J]. 山东医药,2011,51(12):9-11.
[7] Chen C, Liang Z, Huang W, et al. Eps8 regulates cellular proliferation and migration of breast cancer[J]. Int J Oncol,2015,46(1):205-214.
[8] Liang B, Zhu L, Liang Z, et al. A simplified PCR-SSP method for HLA-A2 subtype in a population of Wuhan, China[J]. Cell Mol Immunol,2006,3(6):453-458.
[9] Berzofsky JA, Terabe M, Wood LV. Strategies to use immune modulators in therapeutic vaccines against cancer[J]. Semin Oncol,2012,39(3):348-357.
[10] Tang Y, Lin Z, Ni B, et al. An altered peptide ligand for naive cytotoxic T lymphocyte epitope of TRP-2(180-188) enhanced immunogenicity[J]. Cancer Immunol Immunother,2007,56(3):319-329.
[11] Li F, Yang D, Wang Y, et al. Identification and modification of an HLA-A*0201-restricted cytotoxic T lymphocyte epitope from Ran antigen[J]. Cancer Immunol Immunother,2009,58(12):2039-2049.
[12] Walter S, Weinschenk T, Stenzl A, et al. Multipeptide immune response to cancer vaccine IMA901 after single-dose cyclophosphamide associates with longer patient survival[J]. Nat Med,2012,18(8):1254-1261.
[13] Morris GM, Huey R, Lindstrom W, et al. AutoDock4 and AutoDockTools4: automated docking with selective receptor flexibility[J]. J Comput Chem,2009,30(16):2785-2791.
[14] Jin S, Lin X, Guan H, et al. Cell-specific expression of the analgesic-antitumor peptide coding sequence under the control of the human alpha-fetoprotein gene promoter and enhancer[J]. Exp Ther Med,2015,9(3):863-867.
[15] Lv Y, Ruan Z, Wang L, et al. Identification of a novel conserved HLA-A*0201-restricted epitope from the spike protein of SARS-CoV[J]. BMC Immunol,2009,10:61.
[16] Bijker MS, Melief CJ, Offringa R, et al. Design and development of synthetic peptide vaccines: past, present and future[J]. Expert Rev Vaccines,2007,6(4):591-603.
[17] 蒋涛,周彩存. T细胞相关免疫疗法在非小细胞肺癌治疗中的研究进展[J]. 肿瘤,2015,44(8):930-935.
[18] 张剑军,徐惠绵,郑志超,等. 热休克蛋白90α多肽疫苗的抗肿瘤效应研究[J]. 山东医药,2010,50(20):51-53.
[19] Perera CJ, Duffy SS, Lees JG, et al. Active immunization with myelin-derived altered peptide ligand reduces mechanical pain hypersensitivity following peripheral nerve injury[J]. J Neuroinflammation,2015,12(4):28.
[20] Douat-Casassus C, Marchand-Geneste N, Diez E, et al. Synthetic anticancer vaccine candidates: rational design of antigenic peptide mimetics that activate tumor-specific T-cells[J]. J Med Chem,2007,50(7):1598-1609.
[21] Chen X, Tang Y, Zhang Y, et al. Tapasin modification on the intracellular epitope HBcAg18-27 enhances HBV-specific CTL immune response and inhibits hepatitis B virus replication in vivo[J]. Lab Invest,2014,94(5):478-490.
[22] Webb AI, Dunstone MA, Williamson NA, et al. T cell determinants incorporating beta-amino acid residues are protease resistant and remain immunogenic in vivo[J]. J Immunol, 2005,175(6):3810-3818.
[23] Chen Y, Sidney J, Southwood S, et al. Naturally processed peptides longer than nine amino acid residues bind to the class I MHC molecule HLA-A2.1 with high affinity and in different conformations[J]. J Immunol,1994,152(6):2874-2881.
[24] Huang YH, Terabe M, Pendleton CD, et al. Identification and enhancement of HLA-A2.1-restricted CTL epitopes in a new human cancer antigen-POTE[J]. PLoS One,2013,8(6):64365.
[25] Wu YH, Gao YF, He YJ, et al. A novel cytotoxic T lymphocyte epitope analogue with enhanced activity derived from cyclooxygenase-2[J]. Scand J Immunol,2012,76(3):278-285.
[26] Herve M, Maillere B, Mourier G, et al. On the immunogenic properties of retro-inverso peptides. Total retro-inversion of T-cell epitopes causes a loss of binding to MHC Ⅱ molecules[J]. Mol Immunol,1997,34(2):157-163.
[27] Tourdot S, Scardino A, Saloustrou E, et al. A general strategy to enhance immunogenicity of low-affinity HLA-A2. 1-associated peptides: implication in the identification of cryptic tumor epitopes[J]. Eur J Immunol,2000,30(12):3411-3421.
[28] Walker EB, Miller W, Haley D, et al. Characterization of the class I-restricted gp100 melanoma peptide-stimulated primary immune response in tumor-free vaccine-draining lymph nodes and peripheral blood[J]. Clin Cancer Res,2009,15(7):2541-2551.
[29] Valmori D, Fonteneau JF, Lizana CM, et al. Enhanced generation of specific tumor-reactive CTL in vitro by selected Melan-A/MART-1 immunodominant peptide analogues[J]. J Immunol,1998,160(4):1750-1758.
[30] Stewart-Jones G, Wadle A, Hombach A, et al. Rational development of high-affinity T-cell receptor-like antibodies[J]. Proc Natl Acad Sci USA,2009,106(14):5784-5788.
[31] Czarna A, Popowicz GM, Pecak A, et al. High affinity interaction of the p53 peptide-analogue with human Mdm2 and Mdmx[J]. Cell Cycle,2009,8(8):1176-1184.
[32] Cassarino DS, Miller WJ, Auerbach A, et al. The effects of gp100 and tyrosinase peptide vaccinations on nevi in melanoma patients[J]. J Cutan Pathol,2006,33(5):335-342.
Observation on anti-cancer ability of HLA-A*0201-restricted modified epitope from Eps8 antigen
JIANGChunjun,ZHOUWeijun,XIEXiaoling,DUJingwen,ZHANGHonghao,HEYanjie,LIYuhua
(ZhujiangHospitalofSouthernMedicalUniversity,Guangzhou510282,China)
ObjectiveTo observe whether modified epitopes from the human epidermal growth factor receptor pathway substrate 8 (Eps8) antigen have leucocyte antigen (HLA -A)*0201 restrictive anti-tumor ability.MethodsWe obtained the modified peptides from Eps8 containing HLA-A*0201-binding anchor motifs by replacing anchor residues, then we selected stable binding affinity peptides E1-9V (ILDDIEFFV) and E1-1Y9V(YLDDIEFFV) by using different computer algorithms such as BIMAS, SYFPEITHI database and Aotodock 4.2 software to predict the modified peptides and their binding affinity to HLA-A*0201, respectively. T2 binding assay were performed to verify modified epitopes' binding affinity to HLA-A*0201. Cytotoxic T lymphocytes (CTLs) were induced from peripheral blood mononuclear cells (PBMCs) of HLA-A*0201 positive healthy donors stimulated by modified epitopes E1-9V and E1-1Y9V. The kill rates on SW480, U251, K562, IM-9 and T2 cells were compared between E1-9V and E1-1Y9V peptide-specific CTLs, and meanwhile, the kill rates on T2 cells were compared among E1, E1-9V and E1-1Y9VE1-9V peptide-specific CTLs.ResultsBoth E1-9V and E1-1Y9V formed stable hydrogen bonds with amino acids of HLA-A*0201 molecular B, F docking pockets.T2 binding assay showed that E1-9V and E1-1Y9V showed significantly higher affinity for HLA-A*0201 than the native peptide E1 (all P<0.05). Modified peptide-specific CTLs of E1-9V and E1-1Y9V had lower kill rates on MCF-7/shRNA and MCF-7/A2Ab cells than that of MCF-7 cells (allP<0.05). In addition , the CTLs expressed higher cytotoxicity against tumor cells SW480 and U251 than that of K562 and IM-9 (allP<0.05). E1-1Y9V peptide-specific CTLs showed higher cytotoxicity against tumor cells T2 than E1 and E1-9V peptide-specific CTLs (allP<0.05).ConclusionCompared with native peptide E1, modified epitopes E1-9V and E1-1Y9V have higher binding affinity with HLA-A*0201 and retain immunogenecity. In addition, the anti-tumor immunity effect of modified epitope E1-1Y9V is stronger than native peptide E1.
epidermal growth factor receptor pathway substrate No. 8 (Eps8); modified epitope; cytotoxic T lymphocytes; tumor vaccine; human leukocyte antigen A (HLA-A)*0201
国家自然科学基金面上项目(81372249);国家自然科学基金青年项目(81300431);广东省中国科学院全面战略合作专项基金资助项目(2013B091500072);广东省高等教育“创新强校工程”专项基金资助项目(2014GKXM029)。
姜春俊(1989-),女,硕士,主要研究方向为血液系统恶性肿瘤基础及临床。E-mail: chunjun.jiang@foxmail.com
简介:李玉华(1973-),女,博士生导师,主任医师,主要研究方向为肿瘤疫苗。E-mai: liyuhua2011gz@163.com
10.3969/j.issn.1002-266X.2016.26.001
R394
A
1002-266X(2016)26-0001-05
2016-03-27)

