螺旋藻激酶对人脐静脉内皮细胞通透性及动脉粥样硬化大鼠血清黏附因子的影响
王慧杰,庞辉,陈萌, 王科,杨莹,陈相宜
(广西医科大学,南宁530021)
螺旋藻激酶对人脐静脉内皮细胞通透性及动脉粥样硬化大鼠血清黏附因子的影响
王慧杰,庞辉,陈萌, 王科,杨莹,陈相宜
(广西医科大学,南宁530021)
目的研究螺旋藻激酶(SPK)对人脐静脉血管内皮细胞通透性及动脉粥样硬化大鼠血清黏附因子的影响。方法 体外培养人脐静脉内皮细胞,采用H2O2建立氧化损伤内皮细胞模型。测定单层细胞透过率、细胞外乳酸脱氢酶(LDH)渗出量、细胞分泌的细胞间黏附分子 1(ICAM-1)量;采用高脂饲料喂养法建立大鼠动脉粥样硬化(AS)模型, 同时给予SPK干预,连续饲养12周。末次给药后取血,分离血清, ELISA法测定细胞间黏附分子1(ICAM-1)、血管细胞黏附分子1(VCAM-1)。结果体外实验:SPK可显著降低氧化损伤造成的单层细胞通透性,减少细胞外溢出的LDH和细胞分泌的ICAM-1(P均<0.05);体内实验:SPK显著降低AS模型大鼠血清ICAM-1、VCAM-1水平(P均<0.05)。结论 SPK可降低血管内皮细胞通透性,减少其释放黏附因子;降低AS大鼠血清黏附因子,预防AS。
螺旋藻激酶;血管内皮细胞;动脉粥样硬化;乳酸脱氢酶;细胞间黏附分子1;血管细胞黏附分子1;大鼠
动脉粥样硬化(AS) 是从血管内膜开始的一种常见血管性病变,是引起心脑血管疾病的主要原因,严重威胁人类生命健康[1]。血管内皮细胞(VEC)损伤是AS启动的起始环节,而氧化应激被认为是血管内皮损伤最重要的致病因素[2]。氧化应激主要通过氧化作用促进局部炎症反应、诱导血管基因改变和参与影响信号转导途径等多方面参与AS的发生和发展过程。因此,寻找高效、低毒、价格合理的抗氧化、保护VEC的药物是现代医药学研究的热点。螺旋藻经过发酵酶化后产生一种具有生物活性的蛋白激酶,称为螺旋藻激酶(SPK)。前期药理实验证明,SPK具有延长大鼠血液凝固和抑制大鼠血栓形成的作用[3],以及对体外培养肾上腺素损伤模型的人脐静脉内皮细胞(HUVECS)具有一定的保护作用[4]。2015年1~9月,本实验通过H2O2建立氧化损伤内皮细胞模型,通过测定单层细胞透过率、细胞培养液乳酸脱氢酶(LDH)渗出量、内皮细胞培养液中细胞间黏附分子1(ICAM-1)含量,观察SPK对单层细胞通透性的影响;通过复制大鼠AS模型,观察SPK对AS模型大鼠血清中ICAM-1、血管细胞黏附分子1(VCAM-1)含量的影响,观察SPK对VEC的通透性及其分泌的黏附因子的影响,推测其抗AS的作用。
1 材料与方法
1.1材料动物:SD大鼠,雄性,体质量220~250 g,由广西医科大学实验动物中心提供,动物合格证号:桂动许字(2000)第001号,实验室温度控制在20~25 ℃。细胞株:人脐静脉内皮细胞细胞系(HUVEC304)购自美国ScienCell公司。主要试剂:SPK发酵提取物粉剂,由广西北海市康福保健食品有限公司提供,SPK:螺旋藻发酵物粉剂进行水提,低温离心收集上清液,硫酸铵分级盐析收集沉淀,经超纯水透析,凝胶柱层析,冻干保存备用,得到的SPK,比活达2 631 IU/mg[5];RPMI1640培养基购自美国GIBCO公司;胎牛血清购自美国GIBCO公司;Trypsin1∶250 购自美国Amerco公司;辛伐他汀片(10C140907)购自涿州东乐制药有限公司;维生素D3(121203)购自上海通用药业股份有限公司。人ICAM-1试剂盒,大鼠ICAM-1、VCAM-1试剂盒购自武汉华美生物工程有限公司。主要仪器:美国Thermo 3111二氧化碳培养箱;苏州安泰空气技术有限公司超净工作台;日本Olympus 倒置显微镜;日本岛津紫外可见分光光度计;SIGMA公司3K15型高速冷冻离心机;美国伯乐酶标仪;上海跃进医疗器械厂电热恒温干燥箱。
1.2体外细胞实验
1.2.1分组及处理正常对照组:正常培养细胞,实验中不添加任何除培养细胞需要的培养液之外的干扰试剂;损伤组:在细胞培养系中加终浓度为2 mmol/L H2O2共培养4 h;阳性对照组:在细胞培养系中预先用终浓度为10 μg/mL维生素E预处理12 h,再加终浓度为2 mmol/L H2O2,继续共培养14 h;SPK低、中、高剂量组:在细胞培养系中分别预先用终浓度为1、2、3 mg/mL SPK预处理12 h,再加终浓度为2 mmol/L H2O2,继续共培养4 h。各组细胞处理结束后,收集细胞培养上清液,-20 ℃冷冻保存待测。
1.2.2内皮细胞单层通透模型的建立采用Transwell小室。按试剂盒操作方法在Transwell小室培养HUVECS,阳性对照组和SPK各组按实验分组分别加入维生素E和不同浓度SPK共培养12 h。随后除正常对照组外,各组加2 mmol/L H2O2溶液刺激4 h后,每孔吸去顶层小室液体,重新加入l mg/mL牛血清白蛋白200 μL,培养箱孵育45 min。在顶层小室和下层孔内各取样品100 μL,考马斯蛋白定量试剂盒检测蛋白浓度。单层内皮细胞对白蛋白通透性的大小用通透系数T表示,按以下公式计算: T=(C下×L下)/(t×A×C上)[注:其中C下为底层孔内白蛋白浓度,L下为底层小室液体量,t为时间,A为滤膜面积,C上为顶层小室白蛋白浓度。
1.2.3细胞外培养上清LDH及ICAM-1的测定通过比色法测定丙酮酸含量推算出LDH的活力。按照试剂盒的操作步骤依次加入所用试剂后,在波长450 nm下测OD值,按说明书计算公式:细胞培养液LDH的含量=OD测定管/OD标准管×标准管浓度×1 000。ICAM-1的测定采用ELISA法。取100 μL收集的上清液,检测步骤按试剂盒说明书,在酶标板内依次加入试剂,显色后酶标仪450 nm测OD值,根据标准品的OD值和浓度使用CurveExpert 1.4软件绘制标准曲线,选择R2值最大的公式,代入OD值,计算培养上清液中的ICAM-1含量。
1.3体内实验
1.3.1动物分组、模型制备及处理方法健康成年雄性SD大鼠78只,随机分为6组,每组13只,空白对照组普通饲料喂养。模型组,阳性对照组,SPK低、中、高剂量组给予高脂饲料喂养(高脂饲料配方:3%胆固醇,0.2%丙基硫氧嘧啶,0.9%胆酸钠,10%猪油,5%白糖,80.9%基础饲料)[6]12周,建立动脉粥样硬化(AS)模型。第1周每只大鼠按600 000 U/kg的总剂量腹腔注射维生素D3, 分 3 d给完,第3、6、9周一次性给予10万U/kg维生素D3,空白对照组腹腔注射等体积注射用油,每组动物单独喂养,自由饮食、饮水。给药:空白对照组、模型组给予蒸馏水2 mL每天灌胃1次;阳性对照组给予辛伐他汀,按照5 mg/kg药物灌胃给药;SPK低、中、高剂量组按照SPK 80、160、320 U/kg每天灌胃给药1次,每组动物灌胃液体量均为2 mL,连续饲养12周。于12周末,大鼠空腹12 h, 10%水合氯醛麻醉,腹主动脉取血,常温静置30 min,离心10 min(3 000 r/min),取血清分装保存于超低温(-80 ℃)冰箱待测。由于饲养过程中阳性对照组动物死亡3只,其余组死亡小于3只,每组选取10只作为样本检测。
1.3.2血清ICAM-1、VCAM-1检测采用ELISA法。取100 μL大鼠血清,检测步骤按试剂盒说明书,在酶标板内依次加入试剂,显色后酶标仪450 nm测OD值,根据标准品OD值和标准品浓度使用CurveExpert 1.4软件绘制标准曲线,选择R2值最大的公式,代入OD值,计算血清中的ICAM-1、VCAM-1量。
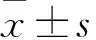
2 结果
2.1各组细胞T及LDH、ICAM-1水平比较与正常对照组相比,损伤组细胞T升高了6倍以上;与损伤组比较,阳性对照组则使通透性减少了60%以上,SPK各浓度组对氧化造成的细胞通透性增强表现出明显的抑制作用,且这种作用随药物浓度的增大而增强(P均<0.05)。与正常对照组相比,损伤组细胞外渗出LDH水平明显升高, ICAM-1分泌量增多(P均<0.05);与损伤组比较,阳性对照组和SPK各剂量组细胞外LDH、ICAM-1均降低,且此趋势与SPK的浓度呈剂量依赖关系(P均<0.05)。见表1。
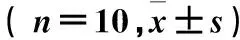
表1 各组细胞T及LDH、 ICAM-1水平比较
注:与正常对照组比较,aP<0.05;与损伤组比较,bP<0.05。
2.2各组血清ICAM-1、VCAM-1水平比较与模型组比较,SPK高、中、低剂量组血清ICAM-1、VCAM-1水平均降低,高剂量SPK可将ICAM-1降至正常水平(P<0.05或<0.01)。见表2。
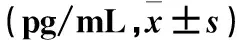
表2 各组血清ICAM-1和VCAM-1水平比较
注:与空白对照组相比,*P<0.05 ,**P<0.01;与模型组相比,#P<0.01。
3 讨论
VEC是位于循环血液与血管壁内皮下组织间的单层细胞,覆盖于整个血管网的内表面,是血管壁组织和血液之间的第一道屏障,直接与循环的血液接触。VEC不仅是一个选择性通透的保护膜,防止血液成分对平滑肌细胞的过度作用,而且是重要的分泌器官和效应器官,参与多种与血管有关的生理和病理过程,它对心血管功能的正常发挥具有重要的调节作用。VEC功能障碍是AS、高血压、心力衰竭等多种血管性疾病发病的重要环节[7]。VEC易受到血液中活性物质,特别是自由基、脂质过氧化物的影响,而活性氧自由基是VEC损伤的主要原因[8]。H2O2是一种强氧化剂,可直接作用于细胞膜脂质,造成脂质过氧化反应,损伤细胞膜。损伤的VEC出现功能紊乱,可导致血小板、炎性细胞活化且黏附率上升;另外VEC受活性氧物质攻击而发生功能失常,还表现在细胞间粘连接等结构破坏, 受损的VEC表达多种细胞黏附分子,其中ICAM-1和VCAM-l是活化VEC和巨噬细胞表面的两种主要的黏附分子[9]。黏附分子可吸引、募集单核细胞黏附,增加氧化低密度脂蛋白产生,间接产生致炎效应;黏附分子表达的增加还可促进血中单核细胞、T淋巴细胞黏附于受损内皮表面并进入内皮下;单核细胞分化为巨噬细胞,巨噬细胞摄取脂蛋白变为泡沫细胞,大量的泡沫细胞堆积最终形成AS[10]。本实验通过体外培养建立H2O2造成的内皮细胞氧化损伤模型。H2O2损伤的VEC表达黏附分子,黏附分子介导炎症细胞黏附于血管内皮,并穿过内皮细胞层最终沉积于内膜下,细胞单层通透性增强,使细胞内的LDH释放到细胞外,细胞培养液中 LDH活性增加[11];LDH活性的高低是反映细胞受损伤程度非常灵敏的指标。本研究结果显示,经过SPK干预的氧化受损后的VEC T明显降低,SPK使细胞培养液上清的LDH活性明显降低,ICAM-1表达减少。因此SPK可减少H2O2对体外培养HUVECS的氧化损伤。
AS是一种慢性炎症性疾病,是血管壁对各种损伤的一种异常反应,具有经典炎症变性、渗出及增生的特点[12]。本研究中,我们采用高脂饲料联合维生素D3复制大鼠AS模型,单纯高脂饮食可导致大鼠血清中ICAM-1和VCAM-l表达增加,给予SPK联合高脂饮食饲养大鼠,可降低由于高脂饮食引起的ICAM-1和VCAM-l含量的增加。而且SPK高剂量组的作用效果明显优于中、低剂量组, 能起到更好的抑制黏附分子表达的作用,提示SPK能显著降低AS大鼠血清中ICAM-1和VCAM-l含量,预防其进展。
综上,SPK可以通过对抗内皮细胞氧化损伤,明显降低氧化损伤造成的VEC通透性,维持内皮细胞屏障作用,提高细胞抗氧化能力,减少VEC黏附因子的表达,对抗炎症反应的发生,进而来实现预防AS发生发展的作用。
[1] 殷亚昕,刘润梅,翟红霞,等.不同饲料联合维生素 D3建立大鼠动脉粥样硬化模型的比较[J].中国康复理论与实践,2010,16(12):1134-1136.
[2] De Caterina R, Massaro M, Scoditti E, et al. Pharmacological modulation of vascular inflammation in atherothrombosis [J]. Ann N Y Acad Sci, 2010,1207:23-31.
[3] 庞辉,李小花,陈高斯,等.螺旋藻激酶对大鼠动静脉环路血栓的溶栓作用研究 [J].时珍国药国药,2010,21(4):908-909.
[4] 赵杰,肖云晓,庞辉,等.螺旋藻激酶对人脐静脉内皮细胞t-PAmRNA、PAI-1mRNA表达的影响[J].时珍国医国药,2012,23(6):1471-1473.
[5] 肖云晓,陈高斯,庞辉.螺旋藻激酶分离提纯方法初探[J].时珍国药国药,2011,22(6):1399-1400.
[6] 赵娟,李相君,孙波.维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J].实用医学杂志,2009,25(21):3569.
[7] Nakayama M, Nakamura J, Hamada Y, et al. Aldose reduetase inhibition ameliorates pupillary light reflex and F-wve latency in patients with mild diabetic neuropathy[J]. Diabetes Care, 2001,24(6):1093-1098.
[8] Kapitonova MY, Muid S, Froemming GR, et al. Real space flight travel is associated with ultrastructuralchanges, cytoskeletal disruption and premature senescence of HUVEC[J]. Malays J Pathol, 2012,34(2):103-113.
[9] Collins RG, Velji R, Guevara NV, et al. P-Selectin or intercellular adhesion molecule (ICAM)-ldeficiency substantially protects against atherosclerosis in apolipoprotein E-deficient mice[J]. J Exp Med, 200,191(1):189-194.
[10] Ichiki T, Funakoshi Y, Ito K, et al. Expression of monocyte chemoattractant protein-1 by nonenzymatically glycated albumin (Amadori adducts) in vascular smooth muscle cells [J]. Biochem Biophys Res Commun, 2000,269(3):666-670.
[11] Olah G, Modis K, Gero D, et al. Cytoprotective effect of gamma-tocopherol against tumor necrosis factor alpha induced cell dysfunction in L929 cells [J]. Int J Mol Med, 2011,28(5):711-720.
[12] 刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报,2015,3(2):141-152.
Effects of spirulinakinase on permeability and adhesion molecules of vascular endothelial cells
WANGHuijie1,PANGHui,CHENMeng,WANGKe,YANGYing,CHENXiangyi
(1GuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo investigate the effects of spirulinakinase (SPK) on the cell permeability and the adhesion molecules of vascular endothelial cells, and serum adhesion molecules of atherosclerosis (AS) rats. MethodsThe human umbilical vein endothelial cells (HUVECs) were cultured in vitro, and then were induced by hydrogen peroxide (H2O2) to establish the oxidative damage endothelial cell models. We determined the permeability rate (T) of monolayer cell and lactate dehydrogenase (LDH) seepage and intercellular adhesion molecule-1 (ICAM-1). The rat AS model was established by high-fat diet, and different doses of spirulina kinase (SPK) were given by gavage. After 12 weeks, rats were killed and the blood serum was collected to measure ICAM-1 and vascular cell adhesion molecule-1 (VCAM-1) by ELISA. ResultsSPK significantly reduced the oxidative damage-induced permeability of monolayer cell, and the leakage of LDH and the secreted ICAM-1 were decreased in vitro experiment (allP<0.05); SPK significantly reduced the levels of ICAM-1 and VCAM-1 in the serum of AS model rats in vivo experiment (allP<0.05). ConclusionSPK can decrease the permeability of vascular endothelial cells and reduce the release of adhesion molecules; SPK can decrease the adhesion molecules in serum of AS rats to prevent AS.
spirulinakinase; vascular endothelial cells; lactate dehydrogenase; intercellular adhesion molecule-1; vascular cell adhesion molecule-1; rafs
广西壮族自治区自然科学基金项目(2013GXNSFAA019176)。
王慧杰(1988-),女,硕士,研究方向为海洋药物及心血管保护机制研究。E-mail:347920956@qq.com
简介:庞辉(1962-),女,教授,硕士生导师,研究方向为海洋药物及心血管保护机制研究。E-mail:454720524@qq.com
10.3969/j.issn.1002-266X.2016.17.003
R972.6
A
1002-266X(2016)17-0009-04
2016-01-28)

