以分泌型荧光素酶为报告基因的单轮感染流感病毒的构建
张永欣,赵斐,王臻,张瑞欣,周金明,岑山
·论著·
以分泌型荧光素酶为报告基因的单轮感染流感病毒的构建
张永欣*,赵斐*,王臻,张瑞欣,周金明,岑山
目的构建以分泌型荧光素酶为报告基因的单轮感染流感病毒用于药物作用机制的快速鉴别。
方法通过使用分泌型荧光素酶(Gluc)序列替代流感病毒HA 基因,并利用表达质粒反式提供 HA 蛋白,借助甲型流感病毒 WSN 反向遗传学产毒系统,构建带有报告系统的单轮感染流感病毒。
结果首轮接种单轮感染流感病毒的细胞上清中可以检测到 Gluc 信号,但检测不到病毒滴度,而在第二轮感染的细胞上清中检测不到 Gluc 信号,表明该单轮感染病毒在感染过程中能够分泌 Gluc 蛋白并且不能产生具有感染性的子代病毒颗粒。通过对复制动力学和时相的观察,明确了单轮感染病毒的生活周期,同时结合 4 种已知作用机制的抗流感药物的阻断实验结果,证明该系统可以用来快速、有效地鉴别药物的作用机制。
结论成功构建了以分泌型荧光素酶为报告基因的单轮感染流感病毒,该系统可以用于抗病毒药物作用机制的快速鉴别。
流感病毒 A 型;药物评价, 临床前;单轮感染病毒;Gluc 报告基因
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):300-307
甲型流感病毒是急性呼吸道传染性疾病的主要病原体之一。临床上预防和治疗流感的手段主要有疫苗和抗流感药物,但是由于流感病毒具有极强的重组变异和抗原漂移能力,严重地限制了流感疫苗的免疫保护作用。同时,目前的流感病毒流行株对临床一线抗流感药物也产生了不同程度的耐药[1-2],因此亟需寻找新的抗流感药物靶标和发展新型抗流感病毒药物。
抗流感病毒药物研发过程中,药物作用机制研究是其中一个重要方面。由于流感病毒复制周期比较短,病毒的多轮感染对药物作用环节的确定造成较大干扰。因此,通过构建单轮感染流感病毒,对其药物作用时相进行观察,可以快速、有效地鉴别药物的作用机制;同时,将单轮感染模型应用于高致病性流感毒株,可以降低操作的危险性以及对实验条件的要求。
甲型流感病毒的生活周期包括病毒吸附,脱衣壳,病毒核糖核蛋白(vRNPs)转运入核,基因组转录和复制,病毒蛋白合成,vRNPs 核输出、组装和释放等过程[3]。病毒颗粒经过 HA 介导[4]的吸附、进入等环节后在细胞质中完成脱衣壳过程,病毒 vRNPs 释放进入细胞质,随后入核,在核内启动转录和复制过程。转录产生的病毒 mRNA 翻译成病毒蛋白,复制产生的 vRNA 与新合成的病毒蛋白组装成 vRNPs 后出核,运送至细胞膜的出芽位点。病毒各组分在出芽位点组装成完整的病毒颗粒后出芽释放,完成流感病毒整个生活史。
研究表明在病毒包装细胞中给 HA 缺陷的流感病毒反式提供 HA 蛋白,获得的重组病毒可以有效地感染细胞,但其子代病毒没有感染性[5]。例如,König 等[6]用海肾荧光素酶编码基因替代了 HA的编码区,构建了可以表达海肾荧光素酶的单轮感染流感病毒。本研究借鉴上述报告的工作原理,结合分泌型的 Gaussia 荧光素酶,构建了单轮感染的流感病毒,进而将其应用于药物作用机制的快速检测。虽然类似的分析方法在流感病毒基础研究中已有应用[7],但是将其应用于药物作用机制的研究尚属首次,同时分泌型报告基因极大地简化了分析程序。
1 材料与方法
1.1材料
1.1.1质粒pHW181-PB2、pHW182-PB1、pHW183-PA、 pHW185-NP、 pHW186-NA、pHW187-M、pHW188-NS 分别为流感病毒H1N1/WSN/33 的 PB2、PB1、PA、NP、NA、M 和NS 蛋白的表达质粒,获赠于 Dr. Robert G. Webster[8]。pHH-Gluc 质粒获赠于 Dr. Erik de Vires[9]。在 pHW184-Gluc 质粒中,Gaussia 荧光素酶基因的编码序列反向插入取代了流感病毒H1N1/WSN/33 HA 节段的编码区。将 HA 的编码序列插入到 pCAGGS 载体中构建得到表达 HA蛋白的质粒 pCAGGS-HA-IRES-puro。
1.1.2主要试剂腔肠素 h 购自美国 Promega公司;Flu-M1 鼠单克隆抗体(货号:SC-69824)、Flu-HA 鼠单克隆抗体(货号:SC-52025)、β-actin 鼠单克隆抗体(货号:SC-47778)购自美国 Santa Cruz公司;辣根过氧化物酶(HRP)标记山羊抗小鼠 IgG(货号:ZB-2305)、TRITC 标记山羊抗小鼠 IgG(货号:ZF-0313)购自北京中杉金桥有限公司;Trizol 购自美国 Invitrogen 公司;一步法荧光定量PCR 反应试剂盒购自日本 Takara 公司。
1.1.3仪器Gradient Thermal Cycler PCR 仪购自美国 Bio-Rad 公司;Centro XS3 LB 960 酶标仪购自德国 Berthold 公司;Stratagene MX3000P 实时荧光定量 PCR 仪购自美国 Agilent 公司;HC Power Supply 蛋白电泳仪购自美国 Bio-Rad 公司;LSM 710 激光共聚焦扫描显微镜购自德国Zeiss 公司。
1.2方法
1.2.1流感病毒制备在直径 100 mm 培养皿中同时接种 293T 细胞和可以稳定表达流感 HA 蛋白的 MDCK-HA 细胞。培养 24 h 后,转染流感病毒7 质粒和 pHW184-Gluc 及 pCAGGS-HA-IRES-puro质粒。36 h 后收集上清,离心后过滤,浓缩,分装,保存于 -80 ℃ 冰箱。
1.2.2细胞培养及感染A549 细胞培养于含10% 胎牛血清的 DMEM 培养基,接种于 6 孔板(细胞数 4 × 105个/孔)。培养 24 h 后以 MOI = 1接种病毒,24 h 后收集上清或者细胞。
1.2.3Gluc活性测定Gluc 活性检测依照文献[10]的方法操作。首先在 PBS 溶液中溶解腔肠素h,配制成浓度为 16.7 μmol/L 的腔肠素 h 底物,室温避光孵育 30 min。同时,取 5 μl 待测上清液放入白色不透明、平底的 96 孔板中,再加入 35 μl PBS 溶液。使用酶标仪进行荧光强度测定。检测时,由于反应产物半衰期极短,使用进样器将避光孵育的底物按每孔 60 μl 的进样量逐孔加入并收集信号,检测 Gluc 的相对活性。
1.2.4Western blot 检测收集细胞于 6 孔板,每孔加入细胞裂解液 100 μl,冰浴 0.5 h 裂解细胞。提取细胞总蛋白,进行 SDS-PAGE 电泳,转膜,抗体孵育及 ECL 显色。
1.2.5病毒感染力(TCID50)测定单轮感染的流感病毒滴度检测借助稳定表达流感 HA 蛋白的MDCK 细胞,参照文献[11]进行 TCID50检测。1.2.6实时荧光定量 PCR 检测病毒基因的mRNA 表达水平按照试剂盒说明书,提取细胞总RNA。使用一步法荧光定量 PCR 反应试剂盒以管家基因 gapdh 为内参,用 2-ΔΔCt法[12]对待测基因mRNA 水平进行相对定量。
1.2.7激光共聚焦实验病毒感染 A549 细胞后先于 4 ℃ 同步化吸附 1 h 再换成预热的 DMEM培养基,置于 37 ℃,5% CO2孵箱中按照实验需要培养一段时间后免疫荧光处理并观察。一抗使用浓度为 1∶1000 的 Flu-NP 鼠单克隆抗体,二抗为TRITC 标记的山羊抗小鼠 IgG(1∶200)。
1.2.8时间添加实验A549 细胞铺 24 孔板,每孔接种 1 × 105个细胞。细胞培养 24 h 后,加入单轮感染流感病毒,4 ℃ 同步化吸附 1 h,用预冷的 PBS 清洗 3 遍,每孔加入 300 μl 37 ℃ 预热的含 2% FBS 的 DMEM 培养基。以病毒吸附完成为 0 点,在 -1 ~ 0 h,0 ~ 2 h,2 ~ 4 h,4 ~ 6 h,6 ~8 h,8 ~ 10 h 分别加入不同作用机制的抗流感药物,感染 12 h 后收集细胞上清,检测 Gluc 信号。
2 结果
2.1带有 Gluc 报告基因的单轮感染流感病毒的构建
流感病毒基因组为负链 RNA,因此使用 Gluc编码序列的反向互补序列替换 pHW184-HA 质粒的编码区(图 1A)。同时将 HA 的编码序列插入到哺乳动物表达载体 pCAGGS 上(图 1B)。将上述两个质粒连同编码流感病毒其他蛋白的 7 个质粒共转染细胞后,包装得到的流感病毒含有完整的病毒外壳,但基因组中的 HA 节段被编码分泌型Gluc 蛋白的序列所取代。该假病毒可以正常地感染宿主细胞,产生分泌型荧光素酶,但在感染过程中无法表达 HA 蛋白,因此不能包装、释放完整的子代病毒颗粒进行下一轮感染,所以称为单轮感染流感病毒(图 1C)。
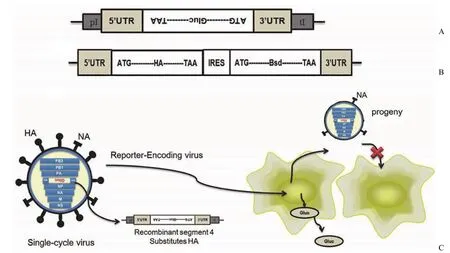
图1 单轮感染流感病毒的构建方案(A:pHW184-Gluc 质粒示意图;B:pCAGGS-HA-IRES-puro 质粒示意图;C:单轮感染流感病毒感染细胞后可分泌 Gluc 荧光素酶,但不能包装产生具有感染性的子代颗粒)Figure 1 The scheme of the assay (A: Schematic representation of pHW184-Gluc; B: Schematic representation of pCAGGS-HA-IRES-puro; C: The single-cycle virus could express secreted Gluc during infection, but not produce infectious progenies)
为了验证构建的单轮感染流感病毒的可靠性,分别用单轮感染流感病毒和野生型流感病毒感染6 孔板中的 A549 细胞,24 h 后收集上清检测Gluc 信号以及病毒的滴度。同时将收集到的上清再去感染 A549 细胞,24 h 后收集上清再次检测Gluc 信号和病毒滴度。
结果如图 2A 所示,只有首轮感染单轮流感病毒的实验组可以检测到 Gluc 信号,实验组收集的上清再次感染细胞后无明显的 Gluc 信号;对照组野生型流感病毒不含有 Gluc 报告基因因而无Gluc 信号。图 2B 中,分别检测病毒接种液、初次感染后以及再次感染后所收集上清的病毒滴度发现,单轮感染流感病毒感染细胞后收集的上清均检测不到病毒滴度,不具有感染性;而野生型流感病毒感染细胞后收集的上清滴度虽然较接种液有所降低,但仍然具有一定的感染性。以上结果表明,我们成功地构建了可以表达 Gluc 蛋白的单轮感染流感病毒,该病毒在感染过程中能够分泌 Gluc蛋白并且不能产生具有感染性的子代病毒颗粒。
为了进一步证实该病毒的单轮感染是由于 HA蛋白的缺失造成的,将上述实验收集到的细胞裂解液进行 Western blot 分析,分别检测流感病毒的M1 蛋白和 HA 蛋白。结果显示,野生型流感病毒感染的细胞中均能检测到 M1 和 HA 蛋白;而在单轮感染流感病毒的第一轮感染中,只有 M1 蛋白能被检测到,HA 蛋白未被检出,从而证明我们构建的单轮感染流感病毒是由于基因组中的 HA 编码序列被取代,导致子代病毒的包膜中缺失 HA 蛋白无法进行下一轮感染,达到单轮感染的目的(图2C、2D)。
2.2单轮感染流感病毒的复制动力学
为了观察单轮感染流感病毒的复制动力学过程,分别用单轮感染流感病毒和野生型流感病毒感染 A549 细胞,同步化吸附后于不同的时间点取样检测 Gluc 信号以及病毒 mRNA 的含量。如图 3A 所示,单轮病毒感染 4 ~ 6 h 后,Gluc 信号出现明显上升,10 ~ 12 h 到达平台期;在图 3B中,单轮感染病毒 mRNA 的水平在 2 ~ 10 h 逐渐升高,10 h 以后逐渐达到平衡,其趋势与 Gluc 结果相一致。在感染的早期(2 ~ 4 h),Gluc 信号升高的程度略低于 mRNA,估计与蛋白翻译滞后于RNA 转录有关。野生型流感病毒 mRNA 水平在感染 2 h 后显著上升,在 10 h 之内与单轮感染病毒的复制动力学曲线基本吻合,而且在 10 h 后仍处于持续升高的过程,与其持续性多轮感染的过程相符合。
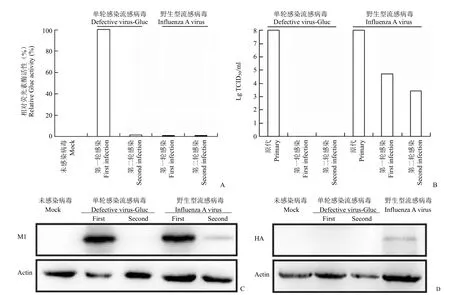
图2 单轮感染流感病毒的可靠性检验 (A:检测上清的 Gluc 活性;B:检测上清的病毒滴度;C:检测细胞裂解液中的流感 M1 蛋白;D:检测细胞裂解液中的流感 HA 蛋白)Figure 2 Verification of the single-cycle infectious influenza virus (A: Measurement of Gluc activity; B: Measurement of supernatant titer; C: Western blot analysis of M1 protein; D: Western blot analysis of HA protein)

图3 单轮感染流感病毒的复制动力学曲线(A:以 Gluc 活性为标准绘制的动力学曲线;B:以病毒 mRNA 水平为标准绘制的动力学曲线)Figure 3 Replication dynamics of the single-cycle infectious influenza virus (A: Measurement of Gluc activity; B: Measurement of viral mRNA level by qRT-PCR)
2.3单轮感染流感病毒的复制时相
单轮感染病毒的生活周期包括病毒吸附、脱衣壳、vRNPs 入核、基因组转录和复制、病毒蛋白合成、vRNPs 核输出等过程。为了明确各个阶段的时间范围,探寻单轮感染病毒的复制时相,为后期抗病毒药物作用机制的快速鉴别提供理论依据,我们用单轮感染流感病毒和野生型流感病毒分别感染A549 细胞,同步化吸附后通过免疫荧光观察不同时间阶段 NP 蛋白的定位。我们发现在野生型流感病毒感染的对照组中,同步化吸附后 4 h 可在部分细胞核中观察到 NP 蛋白。感染 4 ~ 8 h 后细胞核中的 NP 蛋白呈现大幅度上升,8 ~ 10 h 后胞浆中出现 NP 蛋白的累积。24 h 后由于细胞病变,细胞核的形态发生改变。在单轮感染病毒的实验组中,感染 6 h 后部分细胞核中出现 NP 蛋白,6 ~10 h 后细胞核中的 NP 蛋白大量增多,24 h 后NP 蛋白分布于胞质中,细胞形态没有较大改变(图 4)。图 3B 结果显示,病毒 mRNA 水平在感染 4 h 后才出现明显升高,提示早期核内定位的NP 蛋白应为转运入核的 vRNPs。NP 蛋白在早期阶段主要参与基因组的转录和复制,晚期阶段参与vRNPs 的组装及出核。由此我们推断单轮感染流感病毒的复制时相为:病毒吸附宿主细胞后,4 h 之内完成脱衣壳,入核,并进行基因组转录和复制,6 ~ 10 h 病毒蛋白逐渐合成,随后新组装的 vRNPs出核转运到胞浆。子代病毒因缺失 HA 蛋白而无法继续完成病毒的生活周期。该复制时相也与病毒复制动力学的观察结果相一致。
2.4单轮感染流感病毒鉴别药物作用机制的应用

图4 应用免疫荧光技术确定单轮感染流感病毒的复制时相Figure 4 Replication phases of the single-cycle infectious influenza virus measured by immunofluorescence

图5 4 种作用机制明确的抗流感药物证明药物作用机制与作用时间的相关性(A:利巴韦林;B:奥司他韦;C:金刚烷胺;D:T-705)Figure 5 Inhibition test with 4 kinds of anti-flu drugs to confirm the relation between action mechanism and adding time of agents (A: Ribavirin; B: Oseltamir; C: Amantadine; D: T-705)
为了验证构建的单轮感染病毒是否可以用于鉴别药物的作用机制,我们用不同作用机制的抗流感药物,通过时间添加实验,考察药物的抗病毒活性。在感染的不同时间段分别加入利巴韦林(抑制GTP 合成)、奥司他韦(NA 抑制剂)、金刚烷胺(抑制病毒脱衣壳)、T-705(抑制基因组转录复制)。图 5 结果显示,加入利巴韦林的实验组中,只有2 ~ 4 h 的药物作用组 Gluc 信号降低,说明利巴韦林主要抑制基因组复制的初始阶段,对复制的合成阶段作用不明显,这与其竞争性抑制单磷酸肌苷(IMP)脱氢酶,阻断 GTP 从头合成途径的作用机制相符合[13]。加入奥司他韦的实验组中,-1 ~ 4 h的药物作用组 Gluc 信号降低,其中以 0 ~ 2 h 作用组信号降低最为显著,说明 NA 被奥司他韦抑制后,与受体结合的病毒颗粒的释放受到显著影响。由于 NA 在识别细胞受体、促进病毒进入等过程中也发挥一定的作用,所以在 -1 ~ 0 h 和 2 ~ 4 h 的药物作用阶段也表现出信号的降低;加入金刚烷胺的实验组中,只有 0 ~ 2 h 的药物作用组 Gluc 信号明显降低,说明病毒脱衣壳过程发生在病毒进入后的早期阶段(感染后 2 h 之内),时间节点与上述复制周期的观察结果十分吻合。加入 T-705 的实验组中,0 ~ 6 h 的各药物作用组均出现水平相当的Gluc 信号降低,提示该阶段是病毒 RNA 复制与转录的主要时期[14]。值得关注的是,尽管病毒 RNA 在 6 ~ 10 h 仍然持续上升(图 3),但 T-705 在该阶段加入后并未表现出 Gluc 的抑制活性。这一结果提示在病毒 RNA 合成的晚期阶段(6 ~ 10 h)有可能主要为基因组复制阶段,并非为蛋白翻译提供mRNA[15]。综合上述 4 种药物的阻断实验结果我们得出:抑制 GTP 合成的药物作用时间为 2 ~4 h,抑制 NA 活性的药物作用时间为 -1 ~ 4 h,抑制病毒脱衣壳药物的作用时间为 0 ~ 2 h,抑制病毒基因组转录复制药物的作用时间为 0 ~ 6 h。结合单轮感染病毒复制时相的结果我们认为,药物阻断实验的结果可以有效地证实药物的作用机制,并且实验周期较短(< 48 h),因此单轮感染流感病毒可以作为一种快速、有效的鉴别药物作用机制的手段。
3 讨论
我们通过 Gluc 序列替代流感 HA 基因,并使用表达质粒反式提供 HA 蛋白,借助流感 8 质粒产毒系统,构建了带有报告系统的单轮感染流感病毒,并证实了该病毒感染细胞后一方面可以有效地表达报告基因,另一方面子代病毒由于不含有完整的包膜结构因而只存在单轮感染。接着通过对复制动力学和时相的观察,确定了单轮感染流感病毒在细胞内的生活周期,对其在细胞内的生物学进程有了明确的掌握。通过不同时间段的药物阻断实验,证实了构建的单轮感染流感病毒可以用来快速、有效地鉴别药物的作用机制,辅助传统的抗流感病毒药物筛选中药物作用机制的研究。另外通过构建能够稳定表达流感 HA 蛋白的 MDCK-HA 细胞系,使其反式提供 HA 蛋白完成子代病毒的包装,不仅大大简化了单轮病毒的产毒过程,而且实现了在病毒完整生活周期中对药物作用机制的筛选。综上所述,本文构建的单轮感染流感病毒,借助分泌型的Gaussia 荧光素酶,不仅为药物作用机制的研究提供了一个新型、快捷的研究手段,同时我们设想将构建单轮感染流感病毒的手段应用到高致病性禽流感病毒上,进一步扩大抗病毒药物的研究范围,减少高致病性禽流感病毒操作的危险性以及对实验条件的要求。
[1] Bright RA, Shay DK, Shu B, et al. Adamantane resistance among influenza A viruses isolated early during the 2005-2006 influenza season in the United States. JAMA, 2006, 295(8):891-894.
[2] Kiso M, Mitamura K, Sakai-Tagawa Y, et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study. Lancet,2004, 364(9436):759-765.
[3] Watanabe T, Watanabe S, Kawaoka Y. Cellular networks involved in the influenza virus life cycle. Cell Host Microbe, 2010, 7(6):427-439.
[4] Bonnafous P, Stegmann T. Membrane perturbation and fusion pore formation in influenza hemagglutinin-mediated membrane fusion. A new model for fusion. J Biol Chem, 2000, 275(9):6160-6166.
[5] Pattnaik AK, Brown DJ, Nayak DP. Formation of influenza virus particles lacking hemagglutinin on the viral envelope. J Virol, 1986,60(3):994-1001.
[6] König R, Stertz S, Zhou Y, et al. Human host factors required for influenza virus replication. Nature, 2010, 463(7282):813-817.
[7] Bottini A, De SK, Baaten BJ, et al. Identification of small molecules that interfere with H1N1 influenza A viral replication. ChemMedChem, 2012, 7(12):2227-2235.
[8] Hoffmann E, Neumann G, Kawaoka Y, et al. A DNA transfection system for generation of influenza A virus from eight plasmids. Proc Natl Acad Sci U S A, 2000, 97(11):6108-6113.
[9] de Vries E, Tscherne DM, Wienholts MJ, et al. Dissection of the influenza A virus endocytic routes reveals macropinocytosis as an alternative entry pathway. PLoS Pathog, 2011, 7(3):e1001329.
[10] Tannous BA. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc, 2009, 4(4):582-591.
[11] LaBarre DD, Lowy RJ. Improvements in methods for calculating virus titer estimates from TCID50 and plaque assays. J Virol Methods,2001, 96(2):107-126.
[12] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc, 2008, 3(6):1101-1108.
[13] Leyssen P, Balzarini J, De Clercq E, et al. The predominant mechanism by which ribavirin exerts its antiviral activity in vitro against flaviviruses and paramyxoviruses is mediated by inhibition of IMP dehydrogenase. J Virol, 2005, 79(3):1943-1947.
[14] Furuta Y, Takahashi K, Kuno-Maekawa M, et al. Mechanism of action of T-705 against influenza virus. Antimicrob Agents Chemother, 2005,49(3):981-986.
[15] Newcomb LL, Kuo RL, Ye Q, et al. Interaction of the influenza a virus nucleocapsid protein with the viral RNA polymerase potentiates unprimed viral RNA replication. J Virol, 2009, 83(1):29-36.
【Abstract】
ObjectiveTo construct a single-cycle infectious influenza virus with the Gluc reporter system for rapid identification of mechanism of antiviral drugs.
MethodsWe have constructed a single-cycle infectious influenza virus with the Gluc reporter system by co-transfection of 8 influenza virus packaging plasmids in which the HA coding sequence was replaced by the sequence of the secreted Gaussia luciferase. In addition, the HA protein was offered by the expression plasmid pCAGGS-HA-IRES-puro.
ResultsThe Gluc signal could be detected in the cell supernatant during the first round infection with the single-cycle infectious virus but no infectious virions were detected. And also, during the second round infection, no Gluc signal could be detected. It was indicated that during infection the single-cycle infectious virus could express Gluc protein but not produce infectious progeny particles. By studies of replication kinetics and life phase, we specified the life cycle of the single-cycle infectious virus. Combined with the results of the blocking experiment by four kinds of anti-flu drugs with clear action mechanism, it was proved that this single round infectious system could be applied for quick and effective identification of action mechanism of anti-flu agents.
ConclusionA single-cycle infectious influenza virus with the Gluc reporter system is successfully constructed and may be used for identification of action mechanism of anti-flu agents.
Author Affiliation: Department of Immunology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Union Medical College, Beijing 100050, China
Corresponding Authors: ZHOU Jin-ming, Email: zhou_jim@hotmail.com; CEN Shan, Email: shancen@hotmail.com
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):300-307
Construction of a single-cycle infectious influenza virus with the Gluc reporter system
ZHANG Yong-xin, ZHAO Fei, WANG Zhen, ZHANG Rui-xin, ZHOU Jin-ming, CEN Shan
Influenza A virus;Drug evaluation, preclinical;Single-cycle infectious virus;Gluc reporter
10.3969/j.issn.1673-713X.2016.04.003
国家自然科学基金(81401675)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所免疫生物学室
周金明,Email:zhou_jim@hotmail.com;岑山,Email:shancen@hotmail.com
2016-03-25
*同为第一作者

