MRSA大鼠感染性心内膜炎模型的建立
白羽,李雪,杨信怡,李聪然,卢曦,胡辛欣,聂彤影,庞晶,王秀坤,游雪甫
论著
MRSA大鼠感染性心内膜炎模型的建立
白羽,李雪,杨信怡,李聪然,卢曦,胡辛欣,聂彤影,庞晶,王秀坤,游雪甫
目的选用 ATCC43300 标准菌株,建立 MRSA 感染的大鼠心内膜炎模型。
方法大鼠经右侧颈总动脉插管至左心室,术后 24 h,尾静脉注射 103、104和 105CFU/只感染量的 ATCC43300 菌液,分别在感染后的 1、3、5 和 7 d 处死大鼠,采集心脏赘生物、脾脏和肾脏进行菌落计数,同时设非手术感染组和手术非感染组作为对照。
结果感染 1 d 后,心脏插管大鼠瓣膜处均有赘生物形成,严重者甚至形成壁性赘生物,且随感染菌浓度的增加,心内膜炎感染程度加剧。103CFU/只感染量组、104CFU/只感染量组、105CFU/只感染量组,赘生物细菌计数的对数值分别为 7.04 ± 1.38、9.32 ± 1.22、9.78 ± 1.03;感染 3 d 后,细菌性心内膜炎感染最为严重,细菌计数的对数值最高可达10.03 ± 0.71;随后的 5 ~ 7 d,感染程度随感染量均有不同程度的下降,103CFU/只感染量组和 104CFU/只感染量组,分别下降至 6.87 ± 0.63 和 8.23 ± 1.05;脾脏和肾脏的感染趋势与心脏大致相同,但感染程度低于心脏。手术非感染组和非手术感染组则无赘生物的形成。
结论应用该方法建立的模型具有可操作性强、简单、稳定、重复性好和成功率高的特点,更加适用于抗菌药物机制、新药筛选评价及心内膜炎相关性疾病的研究。
耐甲氧西林金黄色葡萄球菌;心内膜炎,细菌性;疾病模型,动物;大鼠
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):289-294
感染性心内膜炎(infective endocarditis,IE)是指由病原微生物直接侵犯心内膜而引起的炎症性疾病。细菌是引发心内膜炎的主要病原微生物,因此,IE 又称细菌性心内膜炎。近年来其发病率在国外逐年上升,与无抗生素时代相比,IE 占心内膜炎的比例已由 20% 增至 70%。而我国亦呈现稳定增长趋势,这可能与人口老龄化造成的瓣膜退行性病变增多、人工瓣膜和心脏内装置的应用相对广泛、接受血液透析和牙周疾病的患者增多相关[1-4]。
IE 所致的心脏病变损害严重,临床治疗较困难,病死率可高达 21% ~ 35%[5],主要致病菌为葡萄球菌、链球菌和肠球菌。链球菌是既往最常见的病原菌,而近年来金黄色葡萄球菌的感染情况最为严重,且随着耐药菌株不断出现,耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)引起的 IE 感染情况亦不断增长,临床上大约 53.3% 的病例为 MRSA 感染。由MRSA 引发的 IE 病情十分凶险,从而给抗生素治疗带来挑战。目前糖肽类抗生素——万古霉素是MRSA 感染性心内膜炎的标准治疗原则。但随着万古霉素在临床应用的增加,MRSA 对万古霉素的敏感性呈下降趋势,临床报道的治疗失败率较高,尚缺乏控制 IE 感染的确切治疗手段[6-8]。目前,IE 临床前研究亦需合适的动物模型。以往采用兔心内膜炎模型存在诸多缺点,因此本研究采用 MRSA 的国际标准菌株 ATCC43300 建立大鼠巩固、稳定和重复性好的 IE 动物模型,以利于 IE 发病机制的研究及其抗耐药菌新药的筛选评价。
1 材料与方法
1.1材料
1.1.1动物SPF 级 SD 大鼠 200 只,280 ~300 g,雌雄各半,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2012-0001,饲养于中国医学科学院医药生物技术研究所感染动物房。
1.1.2菌株耐甲氧西林金黄色葡萄球菌标准菌株 ATCC43300,购自美国模式菌种收集中心(ATCC),实验室保藏。
1.1.3药品与试剂BHI 培养基为美国 Defico公司产品;PE10 导管为美国 Smiths Medical 公司产品;营养琼脂购自中国药品生物制品检定所;戊巴比妥钠购自德国 Serva 公司。
1.1.4仪器T25 型匀浆仪为德国 IKA 公司产品。
1.2实验方法
1.2.1大鼠心脏插管SD 大鼠,腹腔注射 1%的戊巴比妥钠溶液(40 mg/kg),麻醉后固定于手术台上,暴露颈部正中位置,用 75% 的酒精清理下巴到略低于胸骨的脖颈区域,用手术剪在大鼠颈部中心偏右的地方开一小口,用镊子小心分离皮下组织及肌肉,分离出右侧颈总动脉。用手术缝合线将远心端结扎,在近心端用动脉夹夹闭,并且准备一根手术缝合线在近心端打一小结(未结扎),以便在后续过程中快速结扎,减少大鼠出血量(图 1A)。用眼科手术剪在右侧颈总动脉剪一小斜切口,插入PE10 导管(图 1B),去掉动脉夹,将导管缓慢向前推入,直到遇到阻力。遇到阻力后,稍稍收回导管,使之插入距离为 4 ~ 4.5 cm(图 1C)。去掉动脉夹,对近心端进行结扎和导管末端封口处理。清理手术过程中的血液之后,可以看到导管随心脏有较强的搏动感,表明导管已进入左心室腔内。缝合手术切口,消毒后放回笼中饲养,24 h 后进行细菌感染。
1.2.2动物分组术后 24 h 的大鼠随机分为手术感染组和手术非感染组。手术感染组即大鼠感染性心内膜炎模型组,该组大鼠进行心脏插管手术后,通过尾静脉注射感染菌。手术非感染组,即只进行心脏插管手术,尾静脉注射给予等量的无菌生理盐水;同时设非手术感染组,即不进行心脏插管手术,只通过尾静脉注射感染菌。
1.2.3细菌感染ATCC43300 菌株在 BHI 培养基中 37 ℃ 下培养 24 h,无菌生理盐水稀释到所需菌液浓度。手术感染组和非手术感染组大鼠分别尾静脉注射菌液 0.5 ml/只;手术非感染组注射等量的无菌生理盐水。
1.2.4组织菌落计数和赘生物检查手术感染组和非手术感染组存活大鼠,分别于感染后的 1、3、5 和 7 d进行组织菌落计数和赘生物检查。具体方法为:将大鼠腹腔注射过量的戊巴比妥钠溶液处死,75% 酒精擦拭大鼠的腹部和胸腔,用手术剪在腹部剪一个 V 型开口,取出大鼠的脾脏和肾脏。随后打开胸腔,小心分离出右侧颈总动脉,观察导管位置并确认导管是否插入到心脏内,顺着导管的方向取出心脏,沿导管把心脏剪开,在左心室腔内、瓣膜处以及导管周围密切观察有无赘生物形成,挑取出赘生物(壁性赘生物)。非手术感染组若无赘生物生成,则剪取部分动脉瓣膜。凡是导管不在心脏内的一律淘汰。在无菌条件下称取各组织和赘生物的重量,分别加入适量的无菌生理盐水,匀浆后涂于琼脂平板进行菌落计数。手术非感染组大鼠,于手术后第 8 天处死,采集部分动脉瓣膜、脾和肾进行菌落计数。
1.2.5模型成功评判标准在本实验中,心内膜炎模型建立成功的评判标准主要为:①导管插入心脏后,是否可以观察到导管规律性搏动;②动物处死剖取心脏观察,导管前端应插入左心室腔内;③主动脉瓣应有赘生物形成。不符合标准的动物淘汰。

图1 大鼠左心室 PE10 导管插管(A:分离右侧颈总动脉,对远心端进行结扎,在近心端用动脉夹夹闭;B:将 PE10 导管插入到颈总动脉中;C:插管示意图)Figure 1 Cardiac catheterization involves passing PE10 catheter into the left ventricle (A: Separate the right carotid artery and tie off the artery at the exposed cephalic end, then place a clip on the artery to prevent bleeding; B: Insert a catheter with a forceps through the hole into the artery; C: Schematic diagram of intubation)
1.3统计学处理
应用 SPSS 16.0 软件对结果进行分析,各组数值以±s 表示。各组间数据的显著性比较,采用单因素方差分析,结合 Dunnet's test 检验完成。检验结果判定,以 P < 0.05 为差异有显著性意义,P < 0.01 为差异有非常显著意义。
2 结果
2.1手术非感染组结果
对 10 只 SD 大鼠进行心脏插管手术,不给予细菌感染,考察手术后大鼠的存活状态及存活率。结果显示,心脏插管后 1 d 内,动物死亡 2 只,其余动物活动基本正常;继续观察 7 d,再无动物死亡情况发生,且动物饮食、精神状态佳,无明显异常状况,能够正常生存。实施心脏插管手术的大鼠存活率为 80%,存活时间在 8 d 以上。心脏插管 8 d 后,大鼠经过量麻醉处死并解剖心脏观察显示,导管前端均插在左心室腔内;导管与心脏瓣膜无粘连,与主动脉瓣膜相连处导管周围及主动脉瓣处无异物;左心室腔内光滑,无赘生物生长;细菌计数显示未有细菌生长;脾脏和肾脏的匀浆液涂平皿,37 ℃ 培养 24 h,未见菌落生长。
2.2非手术感染组结果
正常大鼠尾静脉注射不同菌液浓度的ATCC43300 进行感染,各组分别于感染后的 1、3、5 和 7 d 处死部分动物,解剖心脏观察,对动脉瓣膜、脾脏和肾脏进行组织菌落计数,考察动物有无心脏瓣膜损伤,血液中的细菌是否引起 IE 主要受累脏器的感染。结果如表 1 所示,在各感染剂量下均未发现有心脏赘生物形成,主动脉瓣膜匀浆计数显示无细菌感染。脾脏和肾脏组织均有不同程度的细菌检出,组织匀浆计数显示,各组动物脾脏和肾脏组织细菌对数值无规律性,脾脏和肾脏感染情况呈现出明显的不稳定性。
2.3手术感染组
大鼠心脏插管手术 24 h 后,通过尾静脉注射适量细菌感染,1 ~ 7 d 解剖检查发现,动物的主动脉瓣膜与导管的接触面均排列有形状不规则和大小不等的疣状或息肉状赘生物,呈灰白色半透明(图 2);部分动物出现壁性赘生物,呈团块状,容易剥离,一般较主动脉瓣赘生物大,最大者几乎占满整个心室腔。依据模型评价标准,提示建模成功。分别观察 1、3、5 和 7 d 后的感染情况。结果如表 2 所示,动物处死后解剖心脏观察,各感染剂量组动物皆在感染 1 d 后有明显的赘生物形成。组织匀浆计数显示,心脏赘生物、脾脏和肾脏组织中均有细菌检出。
103CFU/只感染量组,感染 1 d 后心脏赘生物细菌计数的对数值为 7.04 ± 1.38,感染 3 d 时心脏赘生物中细菌计数的对数值升高达到 8.85 ± 1.81,感染 5 ~ 7 d,心脏赘生物中细菌数随时间缓慢降低。该剂量组中,脾脏和肾脏相同,即感染 3 d 组织中细菌数达最高值,随后缓慢降低。
104CFU/只感染量组,感染 1 d 后心脏赘生物细菌计数的对数值为 9.32 ± 1.22,3 d 后达最高值10.03 ± 0.71,随后的感染 5 ~ 7 d 内心脏赘生物中细菌数稍有下降。该剂量组中,脾脏组织细菌计数数值趋势与心脏赘生物细菌计数数值趋势相同,感染 3 d 组织中细菌数达最高值,感染 5 ~ 7 d 后数值皆有所降低,随后趋于平稳,而肾脏组织细菌计数对数值基本维持在 5 左右。
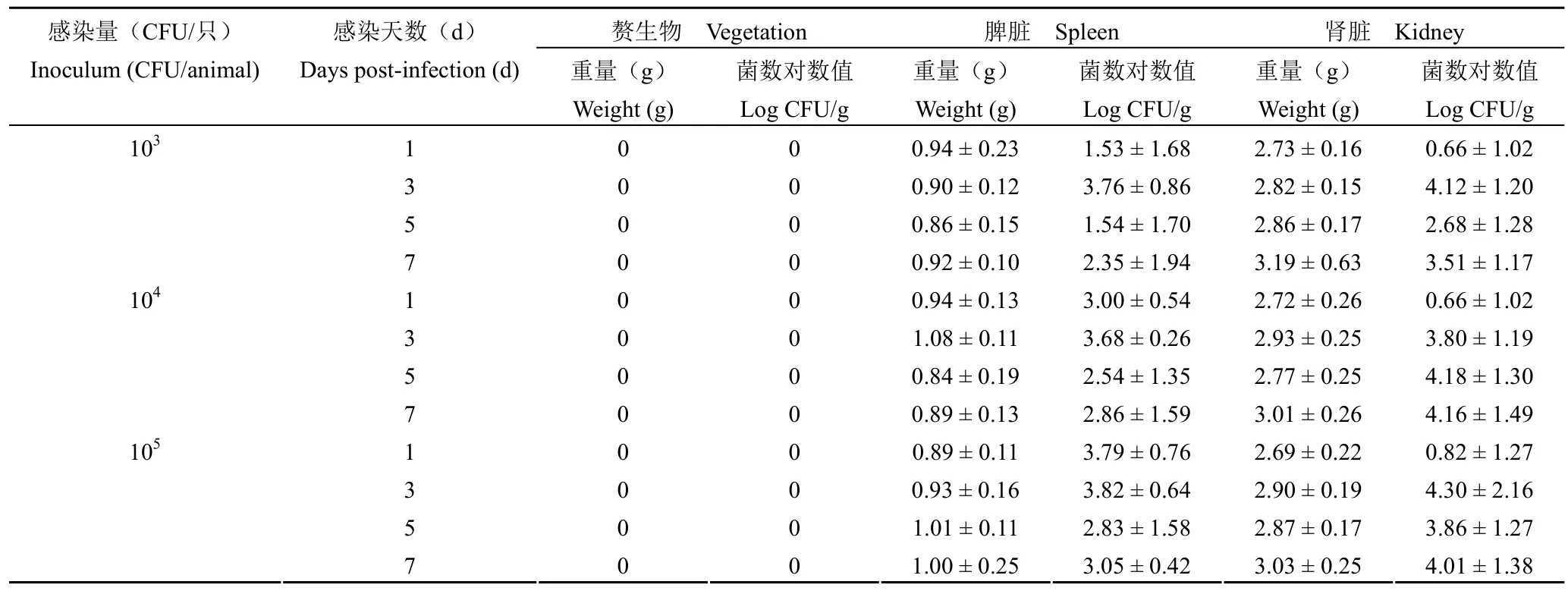
表1 非手术感染组脾脏和肾脏重量及组织菌落计数结果(n = 6)Table 1 Weights of spleen and kidney in the non surgical infection groups and the results of the colony counts (n = 6)
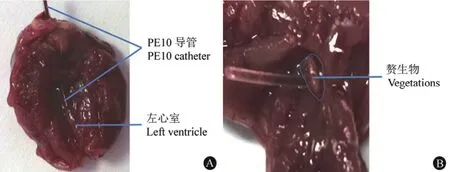
图2 解剖显示心脏插管位置(A)及心脏赘生物(B)Figure 2 Cardiac anatomy showed that the catheter was in the correct place (A) and numerous vegetations were visible around the aortic valves (B)
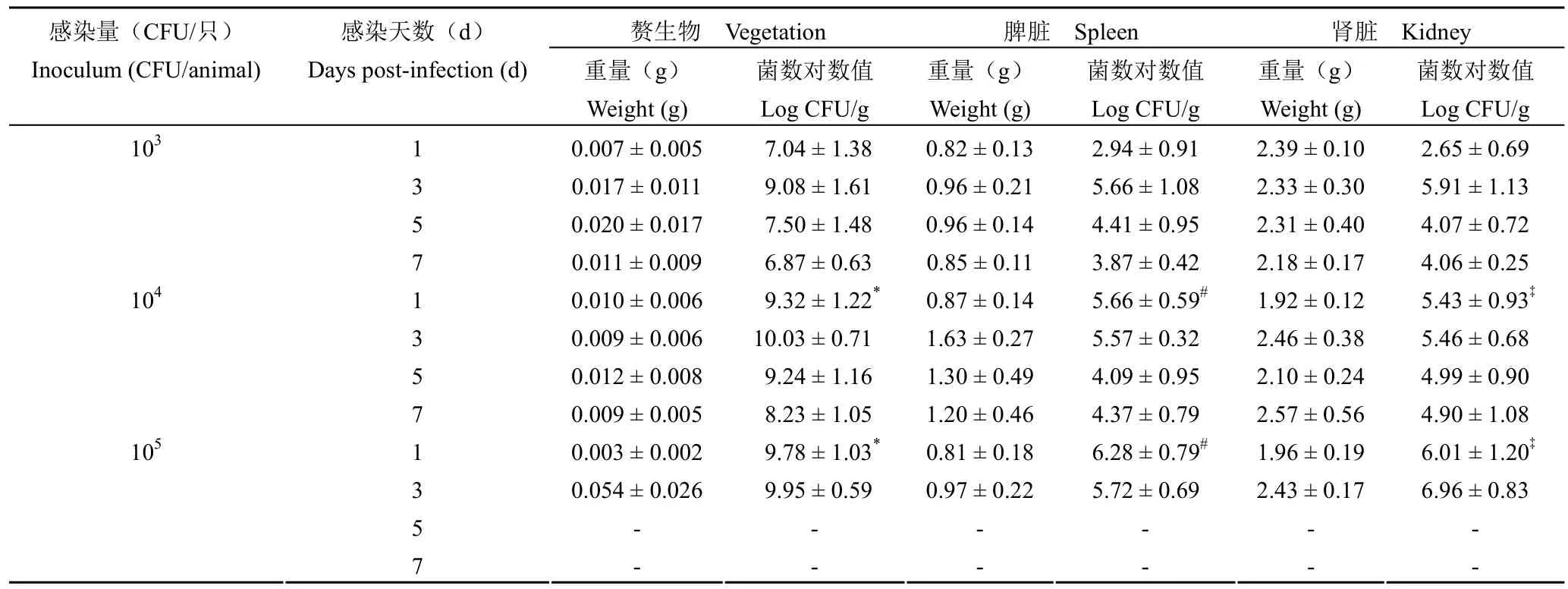
表2 手术感染组脾脏和肾脏重量及组织菌落计数结果(n = 6)Table 2 Weights of spleen and kidney in the surgical infection groups and results of the colony counts (n = 6)
105CFU/只感染量组,感染 1 d 心脏赘生物细菌计数的对数值为 9.78 ± 1.03,感染 3 d 时,其值高达 9.95 ± 0.59,并有动物陆续出现死亡;部分死亡大鼠解剖心脏,大体观察显示,赘生物充满整个左心室腔。感染 5 d 后动物死亡率为 100%;感染1 d 和 3 d 脾脏和肾脏组织细菌计数对数值皆为6 左右。
统计显示,在感染天数为 1d 情况下,与103CFU/只感染量组相比,其他两个感染剂量组的赘生物、脾脏和肾脏中感染细菌对数值皆明显升高(P < 0.05)。
3 讨论
感染性心内膜炎主要表现为附着在心内膜表面的大小不等且形状不一的赘生物,该赘生物是包含大量微生物和少量炎症细胞的血小板和纤维素团块,瓣膜为最常受累部位。研究表明,虽然健康的心脏血管内皮细胞可以抵抗菌血症,但是当心内膜损伤后,炎性细胞因子和组织相关纤维蛋白因子的释放,导致了血小板纤维蛋白血栓的形成,从而使菌落更加容易黏附[9]。心脏瓣膜硬化、风湿性心内膜炎或者菌血症(特别是金黄色葡萄球菌)是导致心内膜受损的主要原因[10]。黏附蛋白如纤连蛋白结合蛋白和葡萄球菌凝集因子 A 和 B 是细菌黏附的介质,同时也是细菌致病性的决定性因素。细菌定植引起内皮损伤和血栓沉积,最终形成赘生物。生物膜的产生(含多糖和蛋白质基质的多层细菌团)可以协助细菌抵抗抗生素,增加治疗难度[11]。根据病程长短,IE 分为急性和亚急性,亚急性 IE主要发生于器质性心脏病,为病程长的慢性持续性感染。急性 IE 多由致病菌感染受损的心内膜引发,病程进展迅速,瓣膜破坏严重,感染迁移多见。
IE 为威胁生命的严重感染,即便是医学发展到目前这个高度来讲,病死率相对其他疾病仍较高。随着耐药菌株的出现,尤其是 MRSA 的感染情况不断增长,难以控制的 IE 感染更加成为棘手问题。目前,MRSA 感染的心内膜炎药物治疗效果不佳,失败率较高,耐万古霉素的耐药菌株的出现也给治疗带来了巨大的阻力。利用感染性动物模型可以为人类心内膜炎疾病研究和治疗提供良好工具。建立合适的 IE 动物模型,用于 IE 发病机制研究、评价和筛选新药,大大推动我国的抗菌药物体内研究和新药的发现。
适宜动物种类的选择是模型建立成功的关键,家兔、大鼠和小鼠皆可用于 IE 感染模型研究。以往 IE 动物模型均采用家兔,家兔模型插管手术容易操作,但经济成本高,不适用于大规模的实验研究。而体型小、价格低廉的大、小鼠则更加实用。小鼠经济实惠,可以降低科研经费和饲养费,但小鼠颈动脉细小,需要借助体视镜进行心脏插管,手术难度较大,动物意外死亡率高,造模成功率较低,且造模成功的动物心脏内的赘生物微小不易分离。大鼠 IE 是一种急性和亚急性复合的感染性动物模型,能够很好地模拟人类自身瓣膜性心内膜炎。
本研究显示,采用 PE10 进行大鼠心脏插管,手术操作方便,造模速度快,动物意外死亡率低,手术成功率高。只进行心脏插管手术不给予ATCC43300 感染菌的动物,术后 1 ~ 7 d 内其心脏无赘生物生长,心脏以及脾脏和肾脏均无细菌感染情况发生,说明大鼠心脏瓣膜创伤性损伤在体内无致病菌感染的情况下,不引起 IE 的发生。无心脏瓣膜插管损伤的正常动物,静脉给予不同浓度感染菌,亦不能引起 IE。脾脏和肾脏组织均有细菌感染,但感染剂量组之间比较,感染情况不稳定、无规律性,主要由于不同动物的免疫状态存在差异导致。术后 24 h 给予 ATCC43300 感染菌,103CFU/只和 104CFU/只感染量组的动物均能存活 7 d以上;105CFU/只感染量组动物能存活 3 d,而后动物因 IE 感染情况严重,出现急性 IE 感染死亡。各组感染量虽不同,感染 1 d 后均可出现不同程度的主动脉瓣赘生物,甚至出现壁性赘生物,与人类急性心内膜炎感染的赘生物特征相符,且随感染菌浓度和时间的增加,心内膜炎感染程度加剧;感染 3 d 后,各感染量的动物心脏瓣膜细菌感染均达最高。随后的 5 ~ 7 d,大鼠心内膜炎的感染程度随感染量不同有所变化,103CFU/只和104CFU/只感染量组的动物心内膜炎的感染程度逐渐降低,105CFU/只感染量组的动物因 IE 感染严重而全部死亡。各感染量下的动物,脾脏和肾脏的感染情况与心脏相似。说明 103~ 105CFU/只的感染量,均可形成大鼠 MRSA 急性 IE 模型,应用中可根据具体情况选择合适感染量。
总之,本实验经心脏插管后尾静脉注射ATCC43300 菌株,103、104和105CFU/只感染浓度均可成功建立 MRSA 大鼠 IE 模型。该模型制作具有赘生物明显、易于操作、稳定、重复性好和成功率高的优点。在该模型的实际应用中,可根据不同的实验目的,选择适宜的感染浓度以建立实用的感染模型,使其更接近于临床患者的 IE 感染状况。MRSA 大鼠 IE 模型的成功建立,有助于在细菌耐药机制、IE 病理机制和抗菌药物的筛选评价等方面取得研究进展,以应对日趋复杂的临床耐药感染状况,为人类心内膜炎相关疾病研究和防治提供实验性参考。
[1] Cabell CH, Heidenreich PA, Chu VH, et al. Increasing rates of cardiac device infections among Medicare beneficiaries: 1990-1999. Am Heart J, 2004, 147(4):582-586.
[2] Darouiche RO. Treatment of infections associated with surgical implants. N Engl J Med, 2004, 350(14):1422-1429.
[3] McCarthy JT, Steckelberg JM. Infective endocarditis in patients receiving long-term hemodialysis. Mayo Clin Proc, 2000, 75(10):1008-1014.
[4] Durante-Mangoni E, Bradley S, Selton-Suty C, et al. Current features of infective endocarditis in elderly patients: results of the International Collaboration on Endocarditis Prospective Cohort Study. Arch Intern Med, 2008, 168(19):2095-2103.
[5] Millar BC, Moore JE. Emerging issues in infective endocarditis. Emerging Infectious Diseases, 2004, 10(6):1110-1116.
[6] Klevens RM, Edwards JR, Tenover FC, et al. Changes in the epidemiology of methicillin-resistant Staphylococcus aureus in intensive care units in U.S. hospitals, 1992-2003. Clin Infect Dis,2006, 42(3):389-391.
[7] Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology,and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med, 2009, 169(5):463-473.
[8] Centers for Disease Control and Prevention (CDC). Staphylococcus aureus resistant to vancomycin--United States, 2002. MMWR Morb Mortal Wkly Rep, 2002, 51(26):565-567.
[9] Widmer E, Que YA, Entenza JM, et al. New concepts in the pathoph-ysiology of infective endocarditis. Curr Infect Dis Rep, 2006,8(4):271-279.
[10] Werdan K, Dietz S, Löffler B, et al. Mechanisms of infective endocarditis: pathogen-host interaction and risk states. Nat Rev Cardiol, 2014, 11(1):35-50.
[11] Flemming HC, Wingender J. The biofilm matrix. Nat Rev Microbiol,2010, 8(9):623-633.
【Abstract】
ObjectiveTo establish an rat model of Staphylococcus aureus (MRSA) infected endocarditis(IE)by using the ATCC43300 standard strains.
MethodsValve trauma was produced by introduction of an indwelling PE10 catheter into the aortic valve via the left carotid artery. After operation, the ATCC43300 standard strains were injected into the lateral tail vein within 24 hours, and the rats were sacrificed at day 1, 3, 5 and 7 post-infection, examined and removed vegetations from the valve as well as kidney and spleen for quantitative culture. The non surgical infection groups and non infection groups were also set in this experiment.
ResultsDay one after infection, there were different size of valvular vegetations around cardiac catheterization, and even the wall vegetations were found in the serious MRSA infectious rats. IE in the rats were even worse along with increase of the concentration. Log CFU/g of vegetation in infection groups of 103CFU/animal, 104CFU/animal and 105CFU/animal was 7.04 ± 1.38, 9.32 ± 1.22 and 9.78 ± 1.03, respectively. IE was most serious at day 3 post-infection, and the highest log CFU/g could reach 10.03 ± 0.71. Within 5 - 7 days, the degrees of IE varied in different groups, and log CFU/g of vegetation in infection groups of 103CFU/animal and 104CFU/animal declined to 6.87 ± 0.63 and 8.23 ± 1.05, respectively. The trends of infection in the spleen and kidney were roughly the same as in the heart, but the colony counts were all lower than those of the heart. There were no vegetations in non surgical infection groups and non infection groups.
ConclusionThe model established by this method has high maneuverability, simplicity, stability, repeatability and success rate. It shows promise in evaluating the predictive efficacy of antibiotics for MRSA infected endocarditis.
Author affiliation: Department of Pharmacology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
Corresponding Authors: WANG Xiu-kun, Email: xiukunwang@139.com; YOU Xue-fu, Email: xuefuyou@sohu.com
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):289-294
Establishment of MRSA infected endocarditis model in rats
BAI Yu, LI Xue, YANG Xin-yi, LI Cong-ran, LU Xi, HU Xin-xin, NIE Tong-ying, PANG Jing, WANG Xiu-kun, YOU Xue-fu
Methicillin-resistant staphylococcus aureus;Endocarditis, bacterial;Disease models, animal;Rats
10.3969/j.issn.1673-713X.2016.04.001
“十二五”国家科技重大专项(2012ZX09301002-001、2012ZX09301002-005、2014ZX09507009-012);北京市重点实验室科技创新基地培育与发展工程(Z141102004414065);高等学校博士学科点专项科研基金(20121106120027)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所药理室
王秀坤,Email:xiukunwang@139.com;游雪甫,Email:xuefuyou@sohu.com
2016-03-14

