布氏菌活疫苗滴鼻与皮下接种的免疫效果的比较
张凌男,陈成,李恪梅,王国治,魏东,董巧香
·论著·
布氏菌活疫苗滴鼻与皮下接种的免疫效果的比较
张凌男,陈成,李恪梅,王国治,魏东,董巧香
目的将布氏减毒活疫苗通过滴鼻和皮下注射两种方式免疫小鼠,比较两种方式的免疫效果。
方法采用两种方法免疫动物,免疫 4 周后分离血清、脾脏淋巴细胞及制备肺泡灌洗液。ELISA 法检测免疫动物血清中总 IgG 抗体;ELISA 法检测免疫动物肺泡灌洗液中总IgG、IgA 抗体;ELISPOT 法检测分泌 IFN-γ、IL-4 的脾脏淋巴细胞数目,以及用 ELISA 方法检测体外再刺激后小鼠脾细胞分泌细胞因子水平;流式细胞术对 T 细胞亚群进行分类;用羊布氏菌弱毒株 M5 通过滴鼻和皮下注射两种方式攻击免疫动物,通过脾脏布氏菌计数评价并比较两种免疫方法的保护效果。
结果ELISA、ELISPOT 和 T 淋巴细胞亚群分类结果显示,两种免疫途径均能诱导体液免疫、细胞免疫应答,两者间无显著差异。BALB/c 小鼠滴鼻攻击试验结果显示滴鼻免疫组和皮下免疫组脾脏中布氏菌数量的对数值均为 0,阴性组脾脏中布氏菌数量的对数值为 6.24 ± 0.07;皮下攻击试验显示滴鼻免疫组脾脏中布氏菌数量的对数值为 1.69 ± 0.07,皮下免疫组为 3.03 ± 0.03,阴性组为 5.29 ± 0.06。
结论两种免疫途径均能诱导体液免疫、细胞免疫应答,滴鼻免疫组的免疫保护作用显著优于皮下注射组,提示滴鼻免疫是一种高效的免疫途径。
布鲁杆菌菌苗;免疫,体液;免疫,黏膜;细胞免疫;接种
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):308-313
布氏杆菌是一种革兰阴性的不运动细菌,由苏格兰微生物学家 David Bruce 首次发现并分离[1]。因感染布氏杆菌引起的布病,是一种人畜共患性全身慢性传染病,主要侵害生殖系统,其病症类似于流行性感冒。家畜感染布氏杆菌后则极易引起流产或死胎,感染后的家畜所排出的分泌物中含有大量的布氏杆菌,具有一定的传染力。人接触了感染动物的分泌物,服用了污染的奶及灭菌不完全的畜肉,皆可遭受感染[2-4],但人传人的现象比较罕见。据调查,很多国家由于布氏杆菌病造成的经济损失是很严重的[5]。目前,接种疫苗是世界公认的能够降低布病发生和传播最有效、最经济的方法[6]。我国目前仍采用牛种弱毒株 104M 菌株为人用皮上划痕布氏菌活疫苗,而皮上划痕弊端是不能准确定量接种,接种复杂,常伴有异常反应,接种者皮肤会有损伤,而且划痕时皮肤伴有疼痛,皮肤遗留疤痕不易被接受,因此改善疫苗的免疫途径是疫苗研究的热点之一[7-9]。
本次主要采用滴鼻和皮下注射 2 种途径免疫小鼠,通过体液免疫、黏膜免疫、细胞免疫和免疫保护力 4 个方面的试验结果来考察不同免疫途径的免疫效果。
1 材料与方法
1.1主要材料
1.1.1实验动物无特定病原体级 BALB/c 小鼠,雌性,6 ~ 8 周,共 60 只,由中国食品药品检定研究院实验动物中心提供,实验动物生产许可证号:SCXK(京)2014-0013,饲养于中国食品药品检定研究院清洁级动物室。
1.1.2菌种滴鼻免疫用和皮下注射用布氏菌活疫苗(Br-PPD)及羊布氏菌 M5 弱毒株均由中检院结核病疫苗室提供。
1.1.3实验仪器酶标仪购自美国 Bio-Tek 公司;生物安全柜购自美国 Nuaire 公司;恒温培养箱购自德国 Binder 公司;高速离心机购自美国Beckman 公司;酶联斑点分析仪购于美国 CTL ImmunSpot;CO2培养箱购于美国 Thermo 公司;流式细胞仪购自美国 BD 公司;移液枪购于Gilson 公司。
1.1.4试剂耗材胎牛血清购自美国 Gemini 公司;ConA 和 pNPP 底物显色液购自美国 Sigma公司;ELISPOT 试剂盒 Mouse IFN-γ ELISPOT Kit购自美国 Therma 公司;淋巴细胞分离液、无血清培养基购自深圳汉科生物工程有限公司;IFN-γ 及IL-4 ELISA 预包被试剂盒、TSA 培养基均购自美国 BD 公司;戊巴比妥钠购自德国 Merck 公司;碱性磷酸酶标记羊抗小鼠 IgG 购自美国 Jackson Immuno Research 公司;辣根过氧化物酶标记羊抗小鼠 IgA 购自美国 Bethyl 公司;TMB 底物显色液购自美国 Amresco 公司。
1.2方法
1.2.1动物分组及免疫实验分为 3 组,分别为滴鼻组(5 × 107CFU/只),皮下注射组(5 × 107CFU/只),生理盐水对照组,每组随机分给 20 只小鼠。滴鼻组用 10 μl 移液枪对清醒状态下小鼠进行鼻腔免疫,体积为 10 μl/只(5 μl/鼻孔),皮下组即后肢皮下注射 0.2 ml。
1.2.2肺泡灌洗液制备免疫 4 周后,对每组5 只小鼠进行肺泡灌洗液制备,将每只小鼠腹腔注射 40 mg/ml 戊巴比妥钠溶液 0.15 ml,麻醉后剪开颈部皮肤,充分暴露气管,沿气管上端剪一楔形口,取 2 ml 注射器连接冲洗管,用 1.0 ml 生理盐水冲洗肺泡,反复抽吸 3 次后收集冲洗液于 1.5 ml 离心管中,离心收集上清,-70 ℃ 保存。
1.2.3动物血清和脾脏淋巴细胞的制备免疫4 周后,每组取 5 只小鼠摘眼球采血,分离血清,放置于 -20 ℃ 冰箱保存,用于抗体水平的检测。在无菌条件下,取小鼠脾脏置于筛网上,滴加淋巴细胞分离液,研磨,用巴氏吸管将研磨液吸入到15 ml 离心管中,滴加 10 滴左右的无血清培养基进行低速梯度离心,在 25 ℃ 条件下,800 × g 离心 30 min,吸出淋巴细胞层,加入 10 ml 1640 不完全培养基,颠倒洗涤,室温,250 × g 离心收集细胞,调浓度至 2.0 × 106个/ml、1.0 × 107个/ml,用于细胞免疫的检测。
1.2.4黏膜免疫检测
1.2.4.1间接 ELISA 法检测小鼠肺泡灌洗液IgG 的效价加入终浓度为 4 μg/ml 的 Br-PPD蛋白包被 96 孔酶标板,放置于 4 ℃ 冰箱,过夜;洗板,用 1% 的 BSA 封闭(200 μl/孔),37 ℃ 静置 2 h;每孔加入 100 μl 的 2 × 开始倍比稀释的待检肺泡灌洗液,37 ℃ 静置 1 h;洗板,每孔加入 100 μl 1∶2500 倍稀释碱性磷酸酶标记山羊抗小鼠 IgG,37 ℃ 静置 1 h;洗板,加入 pNPP 底物显色液(100 μl/孔),室温避光 60 min 后,加入终止液终止反应,检测吸光值 A405。
1.2.4.2间接 ELISA 法检测小鼠肺泡灌洗液IgA 的效价加入终浓度为 4 μg/ml 的 Br-PPD蛋白包被 96 孔酶标板,放置于 4 ℃ 冰箱,过夜;洗板,用 1% 的 BSA 封闭(200 μl/孔),37 ℃ 静置 2 h;每孔加入 100 μl 的 2 × 开始倍比稀释的待检肺泡灌洗液,37 ℃ 静置 1 h;洗板,每孔加入 100 μl 1∶2500 倍稀释辣根过氧化物酶标记山羊抗小鼠 IgA,37 ℃ 静置 1 h;洗板,加入 TMB 底物显色液(100 μl/孔),室温避光 30 min 后,加入终止液终止反应,检测吸光值 A450。
1.2.5体液免疫检测间接 ELISA 法检测小鼠血清 IgG 的滴度。加入终浓度为 4 μg/ml 的Br-PPD 蛋白包被 96 孔酶标板,放置于 4 ℃ 冰箱,过夜;洗板,用 1% 的 BSA 封闭(200 μl/孔),37 ℃ 静置 1 h;每孔加入 100 μl 的 50 × 开始倍比稀释的待检血清,37 ℃ 静置 1 h;洗板,每孔加入 100 μl 1∶2500 倍稀释碱性磷酸酶标记山羊抗小鼠 IgG,37 ℃ 静置 1 h;洗板,加入 pNPP 底物显色液(100 μl/孔),室温避光 60 min 后,加入终止液终止反应,检测吸光值 A405。
1.2.6细胞免疫检测
1.2.6.1分泌 IFN-γ、IL-4 的脾脏淋巴细胞的数目检测小鼠免疫 4 周后,分离小鼠脾脏淋巴细胞,取 96 孔细胞培养板,每孔中加混有 2.0 × 106个/ml 浓度细胞 100 μl,分别加入 100 μl 布氏Br-PPD 抗原(终浓度为 10 μg/ml)和灭活菌体抗原(终浓度为 1 × 107/ml)刺激,做复孔,用无血清培养液作阴性对照,终浓度为 5 μg/ml 的 ConA作阳性对照。37 ℃,放置 CO2培养箱中孵育 22 h,孵育完毕后,按试剂盒说明书操作步骤依次加入检测抗体等试剂,洗板,显色,超纯水冲洗终止显色反应,自然风干后计数。
1.2.6.2体外再刺激免疫小鼠脾细胞因子产生水平检测取 48 孔细胞培养板,每孔中加 2.0 × 106个/ml 浓度细胞 400 μl,再分别加入 50 μl 布氏 Br-PPD 抗原(终浓度为 10 μg/ml)和灭活菌体(终浓度为 1 × 107个/ml)刺激。ConA(终浓度为 5 μg/ml)为阳性对照,培养基为阴性对照。37 ℃,放置 CO2培养箱中孵育 22 h,孵育完毕后,对培养物进行离心,取各孔细胞培养液上清,根据ELISA 试剂盒说明书操作步骤检测体外不同刺激物刺激小鼠脾细胞分泌 IFN-γ 的水平。
1.2.7T 淋巴细胞亚群分类取 96 孔细胞培养板,每孔中加入 1.0 × 107个/ml 浓度细胞100 μl,分别加入 10 μl 的刺激物,刺激物为布氏 Br-PPD抗原(终浓度 10 μg/ml)和灭活菌体(终浓度为1 ×107个/ml),用 PMA/离子霉素作为阳性对照,培养基作为阴性对照,共同孵育 3 h 后,每孔加入10 μl 的阻断剂。12 h 后进行胞内 IFN-γ、IL-4 染色,胞外 CD3和 CD4染色,流式细胞仪测定后,用 Cellquest 软件进行分析。
1.2.8布氏菌活苗免疫保护力检测免疫 4 周后,对每组 5 只小鼠经后肢皮下攻击羊种布氏菌M5 弱毒株,剂量为 5.0 × 108CFU/只;每组 5 只小鼠麻醉后滴鼻攻击羊种布氏菌 M5 弱毒株,剂量为 5.0 × 108CFU/只。4 周后解剖小鼠,无菌取出脾脏,研磨脾脏并接种平皿,通过脾脏细菌计数评价布氏菌活苗两种免疫方式的保护效果。
1.3统计学处理
2 结果
2.1小鼠肺泡灌洗液中抗 Br-PPD IgG 水平
小鼠肺泡灌洗液用间接 ELISA 方法测抗体水平,结果显示,阴性组小鼠检测不到特性抗体,滴鼻组和皮下组小鼠均可检测出特异性抗体 IgG、IgA,滴鼻组和皮下组 IgG 抗体水平相近(t = 1.414,P = 0.159 > 0.05),差异无统计学意义,而滴鼻组 IgA 抗体水平高于皮下组(t = 2.489,P = 0.037 < 0.05),差异有统计学意义,结果见图 1。
2.2小鼠血清中抗 Br-PPD IgG 水平
小鼠血清用间接 ELISA 方法测抗体水平,结果显示,阴性组小鼠检测不到特性抗体,滴鼻组和皮下组小鼠均可检测出抗体,抗体滴度均为527.80,差异无统计学意义,结果见图 2。
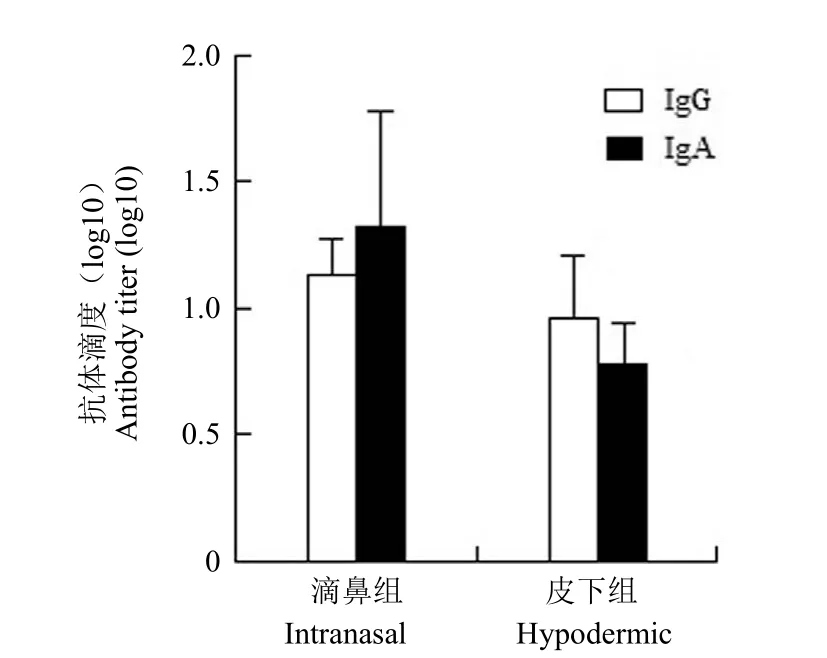
图1 肺泡灌洗液 IgG、IgA 抗体滴度Figure 1 The bronchoalveolar lavage fluid IgG、IgA antibody titer
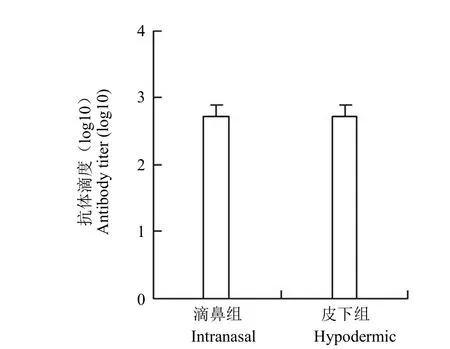
图2 血清 IgG 抗体滴度Figure 2 The serum IgG antibody titer
2.3分泌 IFN-γ、IL-4 的脾脏淋巴细胞数
检测结果显示,滴鼻组和皮下组在 Br-PPD 抗原和灭活菌体抗原刺激下分泌 IFN-γ 的脾脏淋巴细胞数明显多于阴性组,差异有统计学意义(P <0.05),滴鼻组和皮下组在 Br-PPD 抗原刺激下分泌 IFN-γ 的脾脏淋巴细胞数结果相当,差异无统计学意义(P = 0.9372),滴鼻组和皮下组在灭活菌体抗原刺激下分泌 IFN-γ 的脾脏淋巴细胞数结果相当,差异无统计学意义(P = 0.5309),结果见图 3,分泌 IL-4 的脾脏淋巴细胞数很低,没有统计学意义。
2.4体外再刺激免疫小鼠脾细胞因子检测结果
利用 ELISA 方法检测以 Br-PPD 抗原和灭活菌体抗原体外刺激小鼠脾细胞分泌 IFN-γ、IL-4 水平。结果显示,在 Br-PPD 抗原和灭活菌体抗原刺激下分泌的 IFN-γ 的含量明显高于阴性组,差异有统计学意义(P < 0.05),滴鼻组和皮下组在 Br-PPD抗原刺激下分泌 IFN-γ 的含量相当,差异无统计学意义(P = 0.9228),滴鼻组和皮下组在灭活菌体抗原刺激下分泌 IFN-γ 的含量相当,差异无统计学意义(P = 0.6643),结果见图 4。IL-4 含量很低,无统计学意义。
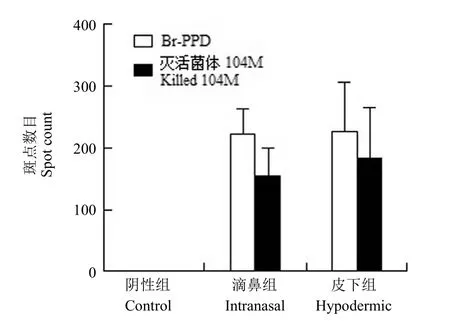
图3 脾脏淋巴细胞分泌 IFN-γ 斑点数目Figure 3 Different stimulator lymphocytes secreted IFN-γ spot number
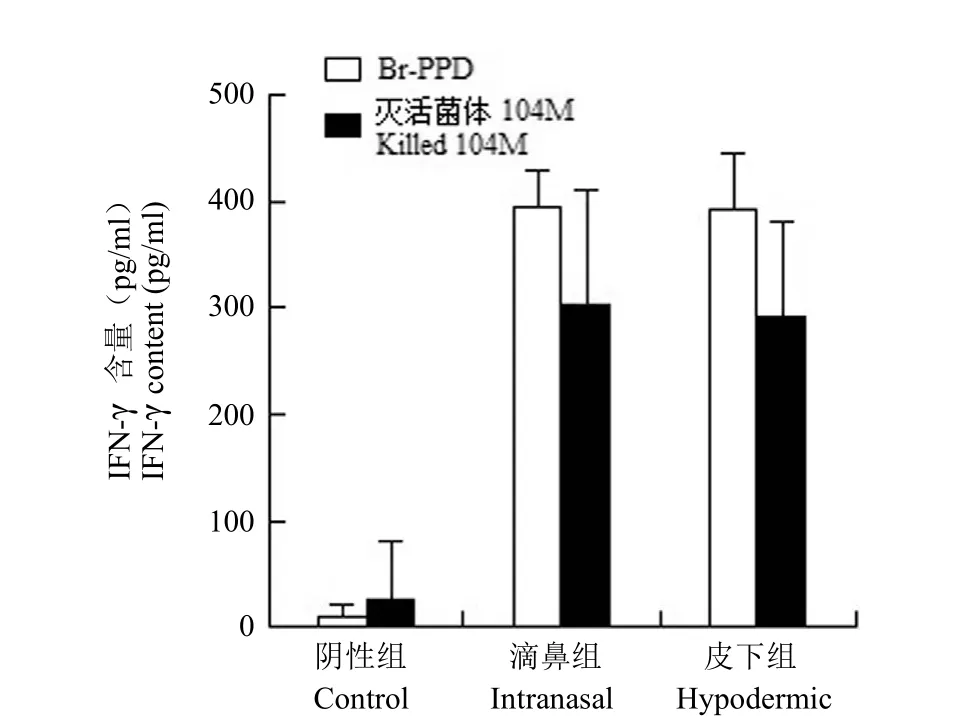
图4 脾脏脾细胞分泌 IFN-γ 的含量Figure 4 Different stimulator stimulated mouse spleen cells of IFN-γ secretion
2.5T 细胞亚群分类
从流式的结果看,在 Br-PPD 抗原和灭活菌体抗原刺激下,滴鼻组和皮下组小鼠的脾淋巴细胞中CD4+IFN-γ+细胞比例高于阴性组,差异有统计学意义(P < 0.05)。滴鼻组和皮下组在 Br-PPD 抗原刺激下小鼠的脾淋巴细胞中 CD4+IFN-γ+细胞比例结果相当,差异无统计学意义(P = 0.4413),滴鼻组和皮下组在灭活菌体抗原刺激下小鼠的脾淋巴细胞中CD4+IFN-γ+细胞比例结果相当,差异无统计学意义(P = 0.7824),结果见图 5。而小鼠的脾淋巴细胞中 CD4+IL-4+细胞比例很低,差异无统计学意义。
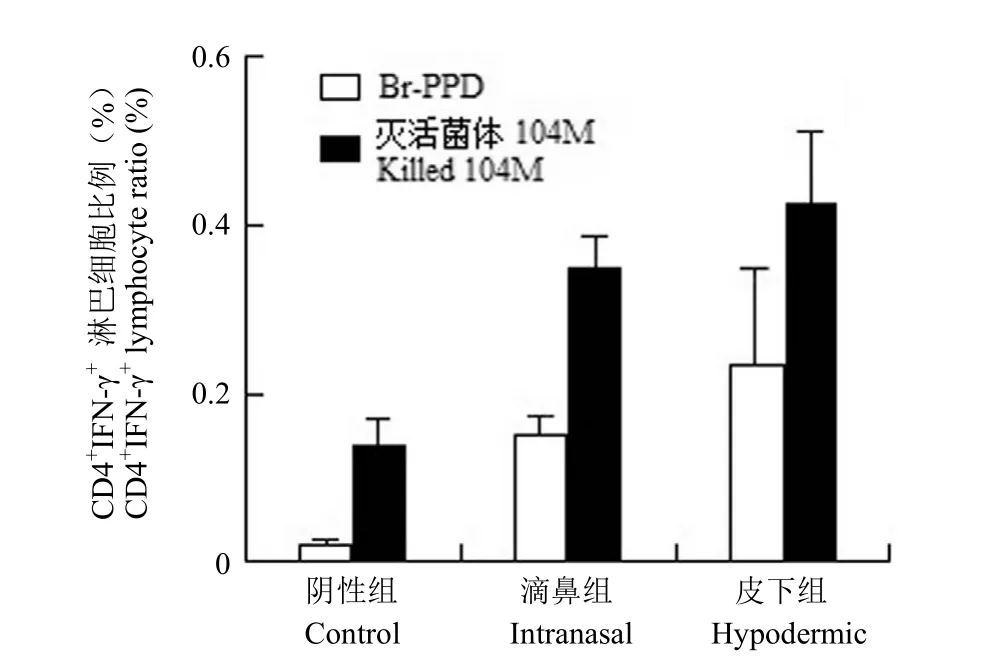
图5 脾脏淋巴细胞中 CD4+IFN-γ+比例Figure 5 Different stimulator stimulated mouse spleen cells of CD4+IFN-γ+proportion
2.6布氏菌活苗免疫保护力
为比较两种免疫方式的免疫保护力,用羊布氏菌 M5 弱毒株分别以皮下和滴鼻两种方式攻击免疫动物,以脾脏布氏菌分离数为指标。结果显示,滴鼻攻击小鼠滴鼻组和皮下组动物脾组织含菌量对数值均为 0,阴性组为 6.24 ± 0.07。皮下攻击试验中,阴性组脾脏含菌量对数值为 5.29 ± 0.06,滴鼻组为 1.69 ± 0.07(t = 36.51,P < 0.0001),两者差异有统计学意义;皮下组脾脏含菌量对数值为3.03 ± 0.03(t = 38.64,P < 0.0001),与对照组差异有统计学意义。滴鼻组脾脏含菌量对数值低于皮下组,两者差异有统计学意义(t = 21.45,P < 0.0001)。
3 讨论
本次试验用 ELISA 法检测免疫动物血清中总IgG 抗体,肺泡灌洗液中总 IgG、IgA 抗体的含量。结果显示,滴鼻组和皮下组血清 IgG 平均抗体滴度均为 527.80;滴鼻组和皮下组肺泡灌洗液 IgG平均抗体滴度分别为 13.93 和 9.19,IgA 平均抗体滴度分别为 21.11 和 6.06,说明滴鼻免疫和皮下免疫都能够诱导一定水平的体液免疫和黏膜免疫应答。同时,用 ELISPOT 法检测分泌 IFN-γ 的脾脏淋巴细胞数明显多于阴性对照组,而分泌 IL-4的脾脏淋巴细胞数与阴性对照组无差异。ELISA 方法检测体外刺激细胞因子检测显示,IFN-γ 的分泌水平远远高于 IL-4,说明 Th1 型细胞介导的细胞免疫为主,Th2 型细胞介导的体液免疫为辅,这与减毒活疫苗的作用机制相符。
疫苗的效力试验是评价疫苗免疫保护力最可靠指标。传统布氏疫苗的效力评价主要是使用豚鼠,效力试验用强毒株攻击,本次研究参照《中国药典》效力测定的方法[10],以小鼠为动物模型,使用羊布氏菌 M5 弱毒株攻击,大大提高了实验的经济性和安全性。结果显示,在皮下攻击时,皮下组免疫动物脾脏布氏菌数量的对数值为 3.03 ± 0.03,滴鼻组为 1.69 ± 0.07,而阴性组为 5.29 ± 0.06。在滴鼻攻击时,皮下组和滴鼻组免疫动物均没有分离出布氏菌,而阴性组动物脾脏布氏菌数量的对数值为 6.24 ± 0.07。数据说明,相同免疫剂量下,滴鼻免疫对皮下攻击的保护效果优于皮下免疫,滴鼻免疫是一种高效的免疫途径,为研究布氏活疫苗免疫途径奠定基础。
现有鼻腔攻击的保护力结果中,滴鼻免疫组和皮下注射组均能提供完全的保护,这可能与攻击用菌株数量及毒力有关,本课题组将应用布氏菌强毒株进行保护力研究,进一步比较两种免疫途径的保护效果。
[1] Clavareau C, Wellemans V, Walravens K, et al. Phenotypic and molecular characterization of a Brucella strain isolated from a minke whale (Balaenoptera acutorostrata). Microbiology, 1998, 144(Pt 12):3267-3273.
[2] Murphy EA, Sathiyaseelan J, Parent MA, et al. Interferon-gamma is crucial for surviving a Brucella abortus infection in both resistant C57BL/6 and susceptible BALB/c mice. Immunology, 2001, 103(4):511-518.
[3] Mense MG, Van De Verg LL, Bhattacharjee AK, et al. Bacteriologic and histologic features in mice after intranasal inoculation of Brucella melitensis. Am J Vet Res, 2001, 62(3):398-405.
[4] Olsen SC, Waters WR, Stoffregen WS. An aerosolized Brucella spp. challenge model for laboratory animals. Zoonoses Public Health, 2007,54(8):281-285.
[5] Sriranganathan N, Boyle SM, Schurig G, et al. Superoxide dismutases of virulent and avirulent strains of Brucella abortus. Vet Microbiol,1991, 26(4):359-366.
[6] Cutler SJ, Whatmore AM, Commander NJ. Brucellosis--new aspects of an old disease. J Appl Microbiol, 2005, 98(6):1270-1281.
[7] Pappas G, Akritidis N, Bosilkovski M, et al. Brucellosis. N Engl J Med, 2005, 352(22):2325-2336.
[8] Greenfield RA, Drevets DA, Machado LJ, et al. Bacterial pathogens as biological weapons and agents of bioterrorism. Am J Med Sci, 2002,323(6):299-315.
[9] Cheville NF, Olsen SC, Jensen AE, et al. Effects of age at vaccination on efficacy of Brucella abortus strain RB51 to protect cattle against brucellosis. Am J Vet Res, 1996, 57(8):1153-1156.
[10] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 3, 2015. Beijing: China Medical Science Press, 2015:112-114. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版三部. 北京: 中国医药科技出版社, 2015:112-114.
【Abstract】
ObjectiveTo evaluate the immune effects in the mice to be immunized by the Brucella vaccine through intranasal immunization and hypodermic injection respectively.
MethodsFour weeks post-immunization, blood and spleen lymphocytes and the bronchoalveolar lavage fluids were collected from each animal. Serum samples and the bronchoalveolar lavage fluids were examined for total IgG/IgA antibodies using ELISA. The number of spleen lymphocytes secreting IFN-γ, IL-4 were detected by ELISPOT and ELISA method was adopted for detection of spleen cells in vitro stimulated to secrete IFN-γ, IL-4 levels of cytokines. Immunized animals were infected with attenuated Brucella melitensis M5 strain through two routes of hypodermic injection and intranasal attacking and then evaluated the acquired immune protection of immunized animals through the bacteria count of spleen.
ResultsThe results from ELISA, ELISPOT and classification of T lymphocyte subsets showed that both of the two methods of immunization were able to induce humoral immunity and cellular immune responses in mice. There was no significant difference between two methods. The intranasal attacking test and the hypodermic attacking test showed that the Brucella number of logarithmic value in the spleen of the intranasal immunization group, hypodermic injection group and the negative group were 0, 0, 6.24 ± 0.07 and 1.69 ± 0.07, 3.03 ± 0.03, 5.29 ± 0.06, respectively.
ConclusionsTwo methods of immunization induces humoral immunity and cellular immune responses in mice. The protective effect of the intranasal immunization group is superior to that of hypodermic injection group, suggesting that Brucella vaccine forintranasal immunization may be an effective method.
Author Affiliations: Department of Enviromental and Public Health Biology Wenzhou Medical College, Wenzhou 325035, China (ZHANG Ling-nan, DONG Qiao-xiang); National Institutes for Food and Drug Control, Beijing 100050, China (CHEN Cheng,LI Ke-mei, WANG Guo-zhi, WEI Dong)
Corresponding Authors: DONG Qiao-xiang, Email: dqxdong@163.com; WEI Dong, Email: weidong1994@sina.com
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):308-313
Comparison of effect on intranasal immunization and hypodermic injection of Brucella vaccine
ZHANG Ling-nan, CHEN Cheng, LI Ke-mei, WANG Guo-zhi, WEI Dong, DONG Qiao-xiang
Brucella vaccine;Immunity, humoral;Immunity, mucosal;Cellular immunity;Vaccination
10.3969/j.issn.1673-713X.2016.04.004
“重大新药创制”科技重大专项(2014ZX09304311-002)
325035 温州医科大学环境与公共卫生学院(张凌男、董巧香);100050 北京,中国食品药品检定研究院结核病疫苗室(陈成、李恪梅、王国治、魏东)
董巧香,Email:dqxdong@163.com;魏东,Email:weidong 1994@sina.com
2016-04-19

