基于近红外及中红外光谱融合技术快速检测黄酒中的总酚含量及其抗氧化能力
焦爱权,徐学明,金征宇*
(1.江南大学 食品学院,江苏 无锡214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
基于近红外及中红外光谱融合技术快速检测黄酒中的总酚含量及其抗氧化能力
焦爱权1,2,徐学明1,金征宇*1,2
(1.江南大学 食品学院,江苏 无锡214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
为了实现对黄酒中总酚含量(TPC)及其抗氧化能力(TAC)的快速检测,探索了将傅立叶红外光谱技术应用于快速检测这两项重要指标的可行性。协同区间偏最小二乘算法(SiPLS)用于选出有效波长区间以提高模型的预测能力。支持向量机(SVM)和主成分分析(PCA)用来融合由SiPLS选出的中红外 (ATR-IR)和近红外 (FT-NIR)光谱的有效波段。实验结果表明基于SiPLS筛选的有效光谱变量而建立的偏最小二乘回归模型(PLS)的精度优于基于全光谱建立的经典PLS模型。基于ATR-IR建立的模型的效果略优于基于FT-NIR光谱建立的模型。此外,基于提取自ATR-IR合FT-NIR的有效区间而建立的SVM模型的预测能力要好于建立的PLS或SiPLS模型。因此,ATR-IR及FT-IR结合特征谱区筛选方法可以作为理化检测的替代手段实现对黄酒中的TAC和TPC的快速检测,同时基于两种光谱的融合技术可显著提高模型的预测精度。
黄酒;总抗氧化能力;总酚含量;数据融合;支持向量机
黄酒历史悠久,酒体柔和,颜色鲜亮,风味独特。黄酒的营养价值极高,含有19种氨基酸,其氨基酸总量比啤酒和葡萄酒要高出2~36倍,居各种酿造酒之首。黄酒不仅是一种富含营养的独特饮品,还经常在中药中使用[1-2]。随着生活水平的不断提高,人们健康饮酒的意识逐渐增强,崇尚低度健康、营养保健的全新饮酒价值理念正在形成。抗氧化能力(TAC)和总酚含量(TPC)逐渐成为评价黄酒质量(功能特性)的两项重要指标。准确的对黄酒中的TAC和TPC进行定量分析不论对于黄酒的营养价值,还是对酒质的控制都具有重要的意义。
目前,黄酒中TAC的检测主要是基于DPPH法、ABTS法、FRAP法等。TPC的检测方法则主要是酒石酸铁法和Folin-Ciocalteu法。高效液相色谱(HPLC)法检通常用来测定具体酚类组分的含量[3]。尽管这些传统分析方法通常非常精密,但往往需要昂贵的化学药品,且耗时耗力,难以适应现代化的大工业生产。因此,急需一种简单、有效的手段来快速测定黄酒中的TPC和TAC,从而降低成本、提高效率。
红外光谱技术是一种基于分子内部原子间的相对振动和分子转动等信息来确定物质分子结构和鉴别化合物的分析方法。其通常与化学计量学有机结合在一起通过建立数学模型以实现对特定组分或特性的分类或预测。近年来,因其快速、绿色、适用范围广和可在线检测等显著优点,FT-NIR和ATR-IR技术均已作为传统理化检测的替代手段被广泛应用于过程控制、品质鉴真和种类区分等诸多领域[4-7]。在TAC和TPC的检测方面,已有许多研究者成功地将红外光谱技术 (FT-NIR和ATR-IR)应用到可可豆、红酒和橄榄等食品中的TPC或TAC的检测中[8-10],然而,目前还没有采用 FT-NIR或ATR-IR技术对黄酒中的TAC和TPC进行快速检测的报道。而且其他研究者建立的模型往往是基于全波长的偏最小二乘模型(PLS)。全光谱中包含很多共线变量和无关变量。如果这些冗杂变量包含在建模变量中,模型的预测精度和稳定性将不可避免的受到影响。因此,波长选择就显得尤为重要。此外,之前的研究主要是基于单一的光谱分析技术(FT-NIR或ATR-IR),还没有关于两者比较的研究。同时,也未发现用两者融合的方法来建立模型的报道。
作者同时采用FT-NIR和ATR-IR技术来实现对黄酒中TPC和TAC的快速检测,并使用波长选择算法提高模型预测精度,同时对比两种技术的优劣,还采用了数据融合技术串联FT-NIR和ATRIR中的有效信息以期提高所建立的回归模型的稳健性。
1 材料与方法
1.1样品来源
黄酒样品:购自无锡本地的家乐福和欧尚超市,其中20个样品来自“古越龙山”,23个样品来自“会稽山”,23个样品来自“沙洲优黄”,27个样品来自“闽族红”,23个样品来自“石库门”,共计116个样本。
1.2仪器设备
Nicolet iS10傅立叶红外光谱仪,Thermo AntarisⅡ傅里叶近红外快速分析仪:美国赛默飞公司产品。
1.3实验方法
1.3.1TAC和TPC的测定参考Feliciano等[11]的方法。首先将25mL 300mmol/L的醋酸盐缓冲液与2.5 mL溶解在40 mmol/L HCl溶液中的Fe(Ⅱ)-TPTZ溶液 (10 mmol/L)混合,再加入2.5 mL 20 mmol/L的Fecl3·6H2O溶液,震荡均匀后与300μL的酒样混合。室温下静置10 min,于593 nm波长处测定吸光度。FRAP试剂作为空白对照。TAC采用Trolox当量表示(mg TEAC/L)。
TPC采用经典的Folin-Ciocalteu法测定。首先,黄酒样品适当稀释使其吸光度在0.20~0.80的范围内。然后取0.3 mL稀释后的黄酒样品与1.5 mL福林酚试剂(0.2 mol/L)混合。静置5min,加入1.2mL 0.7mol/L Na2CO3溶液。于室温暗处反应120min后在760 nm波长处测定吸光度。TPC含量采用没食子酸当量表示(mg/L)。
1.3.2FT-NIR光谱扫描光谱采集条件为:扫描范围4 200~10 000 cm-1,光源11.9W/7 V卤钨灯,扫描分辨率8 cm-1、工作电压6 V、扫描次数16次。每个样品采集3次光谱,以克服样品的不均匀性。数据采集使用RESULT 8.0软件。
1.3.3ATR-IR光谱扫描取100μL黄酒样品直接置于晶片上进行ATR-IR光谱扫描。光谱采集条件为:扫描范围800~4 000 cm-1,分辨率4 cm-1,扫描次数16,光谱间隔点1.93 cm。使用去离子水按照与样品相同的条件扫描作为空白对照。每次完成扫描后,使用去离子水清洗晶片,并用纸巾擦拭干净。数据采集使用OMINIC软件。
1.3.4多变量回归模型的建立模型建立前,所有光谱首先经过Savitzky-Golay 9点平滑处理,然后采用标准矢量归一化(SNV)、多元散射校正(MSC)、一阶导数(D1)、二阶导数(D2)及消除趋势(BC)5种预处理方法对FT-NIR和ATR-IR光谱进行处理以消除基线漂移或颗粒散射等影响造成的误差,从而能够的提取出光谱中的有效信息。依照PLS模型的交互验证均方根误差(RMSECV)的大小选出最佳的光谱预处理方法。通过比较,FT-NIR的最佳预处理是SNV,ATR-IR光谱的最适预处理方法是D1。SNV处理过的FT-NIR光谱和D1处理后的ATRIR光谱如图1(b)和(d)所示。
所有的116个黄酒样品划分为两组:校正组和验证组。校正组样本用于黄酒各指标红外模型的建立,验证组样本用于验证所建模型的准确度与可靠性。所有样品依照TAC(或TPC)的化学参考值的大小排序。然后连续4个样品为一个小组,4个样品中的任意3个分配到校正组中,剩余一下分配到验证组中。最终,校正组有87个样品,验证组包含29个样品。
作者采用了线性模型 (PLS)和非线性模型(SVM)两种模型。RMSECV、预测均方根误差(RMSEP)、交互验证相关系数(R2(cal))、预测相关系数(R2(pre))及残余预测偏差(RPD)被用来评价所建立的回归模型的预测性能。一般来说,R2和RPD的值越大,RMSECV和RMSEP值越小,模型的稳健性越好。R2和RPD评价模型的标准如表1所示。所有数据分析均在MATLAB 2010a软件(美国MathWorks公司产品)平台上完成。
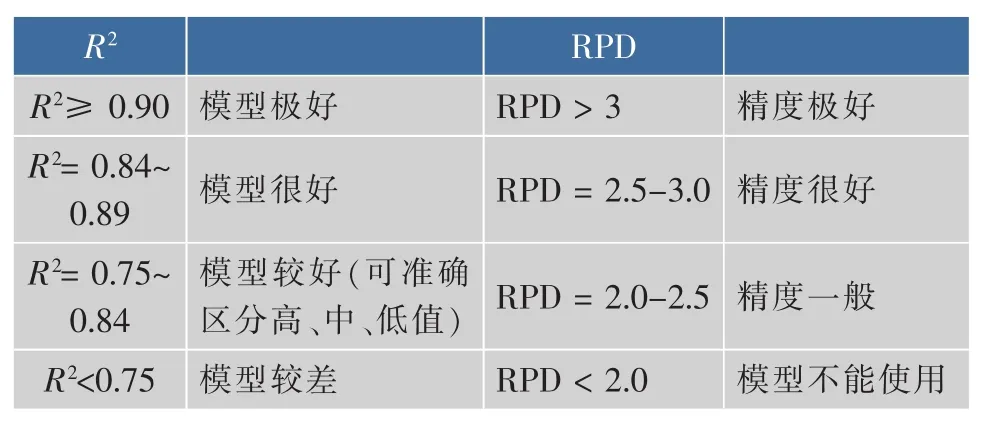
表1 校正模型的评价标准Table 1 Criteria used for the evaluation of the calibration models
2.1黄酒中的TAC和TPC化学参考值结果分析
测定校正组和验证组中样品的TAC和TPC的平均值、标准偏差、变化范围和变异系数。黄酒的TPC质量浓度在405.58~898.60mg/L之间,平均值则高达 668.92 mg/L。TAC质量浓度在 48.86~276.14mg/L之间,平均值为130.38mg/L。TAC和TPC的化学参考值范围均很宽,以校正组中数值为例,TAC和 TPC的 CV值分别高达 48.21%和20.55%。作者采用的黄酒样品取自不同的产地和厂家,各个酒厂采用的酿造技术和生产原料不同。此外,即使是出自同一厂家的同一品牌的黄酒样品,它们的生产日期也有不同。这些因素都可能导致黄酒TAC和TPC的差异。此外,校正组中TAC合TPC的化学参考值范围包含了整个验证组的范围,且两个子集的标准偏差基本相同,这说明,所有的黄酒样品被合理的分配到了两个子集中。
2.2黄酒的红外光谱(FT-NIR和ATR-IR)谱图解析
黄酒的红外光谱有着丰富的吸收峰。图1(a)所示为所有黄酒样品的FT-NIR光谱图。由图可以看出,FT-NIR的主要特征峰在6 896、5 100、4 453、4 338 cm-1附近。6 896、5 100 cm-1处的强峰分别与水和乙醇中O-H基团的伸缩振动和变形振动有关。本试验中,它们与目的指标(TAC或TPC)无关。位于4 453、4 338 cm-1附近的特征吸收峰则主要是由C-H基团的组频和O-H基团的伸缩振动引起。此外,分别位于5 917、5 586 cm-1处的两处小峰则主要归因于CH3基团的一级倍频和来自葡萄糖和蔗糖中的C-H基团和O-H基团的伸缩振动[12]。图1 (c)所示为所有样品的ATR-IR光谱图。与FT-NIR谱图类似,其吸收峰主要来自于水和乙醇,因为它们是黄酒中的主要化学成分。其中1 503~1 687、2 975~3 650 cm-1区域处的两个负的吸收峰是由水的伸缩振动产生的。乙醇的特征吸收峰则主要位于1 042、1 085 cm-1处。位于2 891~2 985 cm-1波段内负的吸收峰也与乙醇中的CH3和CH2中的C-H的伸缩振动有关。965~1 500 cm-1处的众多复杂的吸收峰则主要来源于糖类、有机酸和蛋白质的中的CHOH的伸缩振动[13]。不同黄酒样品吸收光谱波形相似,但又不完全重合,既显示了大样本群体的一致性,又体现出不同样品之间的差异。
2.3模型构建和评价
2.3.1基于PLS和SiPLS算法的回归模型黄酒的成分组成十分复杂,含有多种多样的化学成分,有些光谱区间所包含的信息与黄酒的TAC和TPC之间缺乏相关性,如果输入变量中包含这些波长信息,会严重影响模型的预测精度,因此需筛选出特征区间。为了避免全光谱中存在的大量的共线和无关变量,采用协同区间偏最小二乘算法(SiPLS)从全波段中筛选出与TAC或TPC最相关的特征谱区,以提高模型的可靠性。SiPLS将全波段等分成若干个子区间,然后组合其中的2个、3个或4个子区间建立基于局部区间的回归模型,对比各个模型得到的RMSECV,RESECV值最小的模型所对应的子区间组合即是最佳区间组合[14]。作者将整个光谱区划分为11~25个子区间。筛选结果如表2所示。
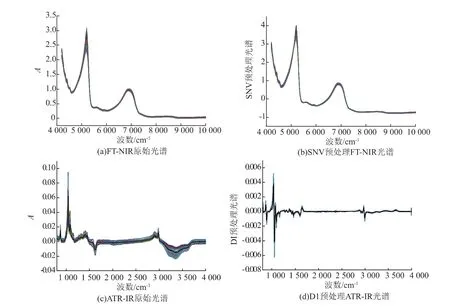
图1 样品的FT-NIR和ATR-IR光谱图Fig.1 FT-NIR and ATR-IR of all samples
基于FT-NIR和ATR-IR建立的黄酒中TAC 和TPC的校正模型的结果如表3所示。无论是基于FT-NIR还是基于ATR-IR所建立的SiPLS模型,均取得了令人满意的结果。TAC和TPC的SiPLS模型的R2(pre)均大于0.90,而RPD值则均在3.0之上。依照表1所列出的评价回归模型效果的标准,这些SiPLS模型均可用作黄酒中TAC和TPC的定量预测。值得注意的是TAC的RMSEP(%)较高,不管是基于FT-NIR还是基于ATR-IR建立的模型,即使经过SiPLS优化,其值仍大于10。这可能与其较宽的变化范围有关。一般来说,范围越宽,RMSEP(%)越大,反之亦然[15]。这也与表2中数据吻合:与TPC相比,TAC的CV值明显较大。
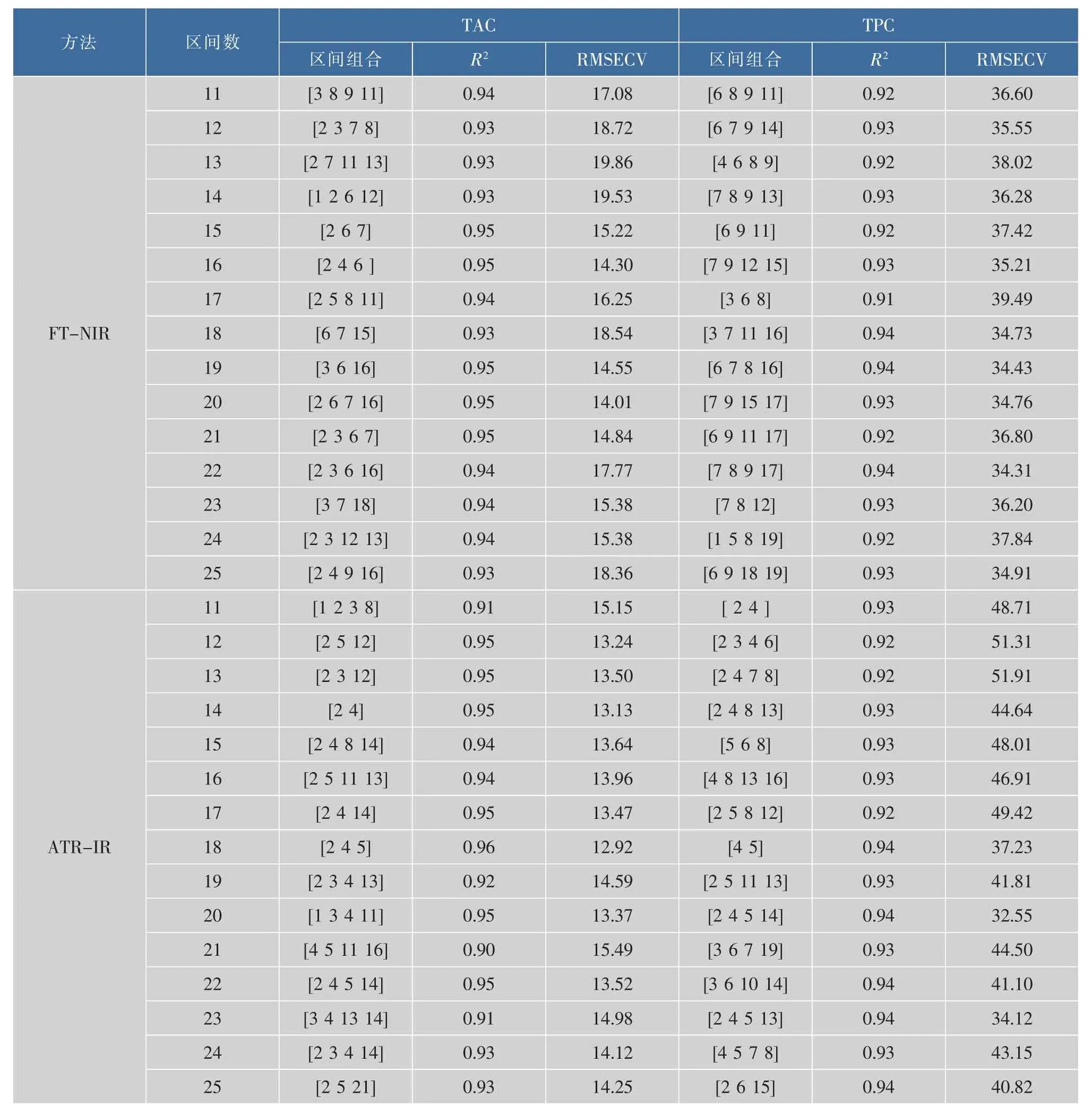
表2 17种氨基酸的最佳SiPLS参数Table 2 Optimal parameters of SiPLSmodels for 17 am ino acids
为突出SiPLS模型的优越性,本研究将SiPLS模型的结果与PLS模型的结果进行了对比。如表4所示,基于有效区间建立的SiPLS模型的效果明显好于基于全波段的经典PLS模型的效果。全光谱区内含有大量与TAC或TPC无关的冗余信息,特别是水的吸收,这些噪音信息和无关信息的加入无疑将会影响模型的可靠性。SiPLS模型是通过筛选出与目标变量最相关的几个光谱子区间而建立的模型,简化了模型的同时最大程度的保留了有效信息。因此,与PLS模型相比,SiPLS的性能有明显的提高。
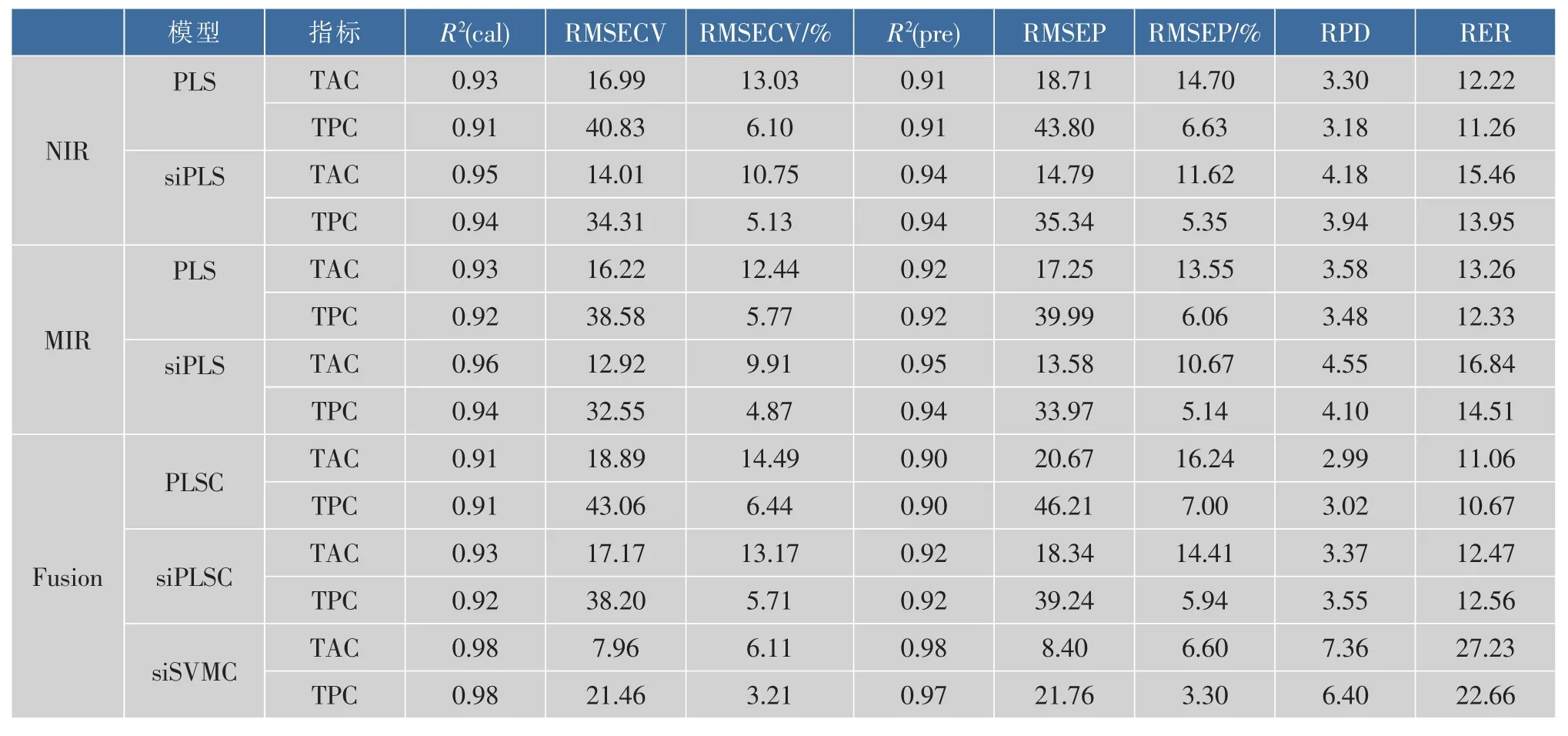
表3 不同校正模型的结果对比Table 3 Com parison of results of different calibration models
2.3.2基于FT-NIR和ATR-IR建立的模型的比较如表3所示,ATR-IR的模型精度略优于FT-NIR。与FT-NIR光谱相比,ATR-IR光谱反映的是分子振动的基频信息,其敏感性比FT-NIR高几个数量级,因此其吸收峰一般较为尖锐,重叠峰少,能够产生更多有效的特征吸收峰。此外,FT-NIR对水更加敏感,这将不可避免的影响模型的预测效果。因此,与FT-NIR相比,基于AIR-IR建立的模型能产生更好的效果。
2.3.3基于数据融合的回归模型ATR-IR和FTNIR光谱基于不同的光谱区间,探测的分子振动信息也不尽相同。FT-NIR趋向于探测倍频和组频信息,而ATR-IR则主要反映分子基频振动的信息。因此二者具有互补性。如果能够实现FT-NIR和ATR-IR光谱的融合,则会扩大信息的来源,提高回归模型预测黄酒中TAC和TPC的能力。
尝试建立了3种数据融合模型。第一种模型(PLSC)是FT-NIR和ATR-IR光谱数据的简单叠加。融合后的数列矩阵的行数等于样品的数量,列数为两种光谱数据的列数之和。如表3所示,无论对于TAC还是TPC,PLSC模型的效果均次于基于ATR-IR或FT-NIR建立的经典PLS模型的效果。这可能是由于两种来源的光谱数据的简单叠加反而增加了模型的复杂性,从而影响了建模效果。为了解决这个问题,作者又尝试通过提取来自两种光谱的特征信息建立第二和第三种模型。首先,采用SiPLS由FT-NIR和ATR-IR光谱中提取出目标变量(TAC或TPC)的最佳子区间组合,归一化后,采用主成分降维提取出前几个主成分,提取出的来自FT-NIR和ATR-IR的主成分融合在一起作为输入变量建立回归模型,建立的PLS模型称为SiPLSC,建立的SVM模型我们称之为SiSVMC。SiPLS模型的预测结果明显要好于PLSC的,但是又差于基于任何一种光谱(ATR-IR或FT-NIR)所建立的SiPLS模型。而SiSVMC模型则是所建立的模型中预测精度最好的。这是因为黄酒成分十分复杂,目标变量与光谱变量之间的关系趋于非线性。此外,来自不同信息源的数据的融合进一步增加了模型的非线性。因此,SiSVMC模型的效果要明显好过SiPLSC模型的效果。
较之基于全波段建立的经典PLS模型,SiSVMC模型的预测精度有显著提升。对于TAC来说,与基于 FT-NIR和 ATR-IR的经典 PLS模型相比,SiSVMC模型的R2(pre)分别提升7.22%和6.06%。对TPC来讲,则分别提高7.51%和6.45%。另外,通过建立的TAC和TPC的SiPLS和SiSVMC模型的参考值与预测值的散点图分析,与SiPLS模型相比,基于数据融合的SiSVMC模型表现出更好的拟合效果。
3 结语
以成品黄酒为研究目标,采用FT-NIR,ATRIR及二者的数据融合对黄酒酒中的TAC和TPC进行了定量检测,同时利用SiPLS对波长变量进行优选,以提高模型的稳定性和预测精度。结果显示,经波长筛选,建模所用的变量数大大减少,运算时间显著缩短,而且预测精度得到明显提高,表明了波长筛选的必要性。基于ATR-IR所建立的模型效果略好于基于FT-NIR建立的模型。此外,基于SVM的数据融合模型效果较基于单一光谱而建立的PLS 或SiPLS模型均有显著提高。总的来说,红外光谱技术结合有效的波长筛选技术可以作为一种经济、绿色的方法用于黄酒中TAC和TPC的快速检测。
[1]LiH Y,Jin ZY,Xu X M,etal.Design and optimization of an efficientenzymatic extrusion pretreatment for Chinese ricew ine fermentation[J].Food Control,2013,32(2):563-568.
[2]Que F,Mao L C,Zhu C G,etal.Antioxidant properties of Chinese yellow w ine,its concentrate and volatiles[J].LW T-Food Science and Technology,2006,39(2):111-117.
[3]Silva SD,Feliciano RP,Boas L V,etal.Application of FTIR-ATR to Moscateldessertw ines for prediction of totalphenolic and flavonoid contentsand antioxidantcapacity[J].Food Chem istry,2014,150(0):489-493.
[4]冯宇,顾小红,汤坚,等.中红外光谱与模式识别相结合鉴别茶叶种类[J].食品与生物技术学报,2007,26(2):7-11. FENG Yu,GU Xiaohong,TANG Jian,etal.Discrim ination of tea varieties bym id-infrared spectroscopy combined w ith pattern recognition[J].Journal of Food Science and Biotechnology,2007,26(2):7-11.(in Chinese)
[5]Wu Z Z,Xu E B,Long J,et al.Measurement of fermentation parameters of Chinese rice w ine using Raman spectroscopy combinedw ith linearand non-linear regressionmethods[J].Food Control,2015,56(0):95-102.
[6]杨丽君,李兆杰,王静,等.傅里叶变换红外光谱技术对三种李斯特氏菌的快速分类检测[J].食品与生物技术学报,2013,32 (2):169-173. YANG Lijun,LI Zhaojie,WANG Jing,et al.Rapid differentiation and identification of three species of Listeria by FT-IR spectroscopy[J].Journal of Food Science and Biotechnology,2013,32(2):169-173.(in Chinese)
[7]宫元娟,匡立学,冯叙桥.苹果近红外光谱无损检测技术的研究进展[J].食品与生物技术学报,2012,31(6):570-574. GONG Yuanjuan,KUANG Lixue,FENG Xuqiao.Advances on near-infrared nondestructive testing technology of apples[J]. Journal of Food Science and Biotechnology,2012,31(6):570-574.(in Chinese)
[8]Huang X Y,Teye E,Sam-Amoah L K,etal.Rapid measurementof total polyphenols content in cocoa beans by data fusion of NIR spectroscopy and electronic tongue[J].Analytical M ethods,2014,6(14):5008-5015.
[9]Fragoso S,Acena L,Guasch J,etal.Quantification of phenolic compounds during red w inemaking using FT-M IR spectroscopy and PLS-Regression,2011,59(20):10795-10802.
[10]Machado M,Machado N,Gouvinhas I,etal.Quantification of chem ical characteristics of olive fruitand oilof cv Cobrancosa in two ripening stages using M IR spectroscopy and chemometrics[J].Food Analytical Methods,2014,DOI 10.1007/ s12161-014-0017-2.
[11]Feliciano R,Bravo M,Pires M,et al.Phenolic content and antioxidant activity of moscatel dessert w ines from the Setúbal region in portugal[J].Food AnalyticalM ethods,2009,2(2):149-161.
[12]Yu H Y,Niu X Y,Ying Y B,etal.A feasibility study on on-line determination of ricew ine composition by Vis-NIR spectroscopy and least-squares supportvectormachines[J].Food Chem istry,2009,113(1):291-296.
[13]Wu Z Z,Xu E B,Long J,et al.Monitoring of fermentation process parameters of Chinese rice w ine using attenuated total reflectancem id-infrared spectroscopy[J].Food Control,2015,50(0):405-412.
[14]Teye E,Huang XY,Takrama J,etal.Integrating NIR spectroscopy and electronic tongue togetherw ith chemometric analysis for accurate classification of cocoa bean varieties[J].Journal of Food Process Engineering,2014,37(6):560-566.
[15]Shen F,Ying Y Y,Li B B,et al.Prediction of sugars and acids in Chinese ricew ine bymid-infrared spectroscopy[J].Food Research International,2011,44(5):1521-1527.
Com parison and Joint Use of FT-NIR and ATR-IR Spectroscopy for the Determ ination of Total Antioxidant Capacity and Total Phenolic Content of Chinese RiceW ine
JIAO Aiquan1,2,XU Xueming1,JIN Zhengyu*1,2
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In this study,Fourier-transform near infrared(FT-NIR)spectroscopy,attenuated total reflectance infrared(ATR-IR)spectroscopy and their combination for measurements of total antioxidant capacity(TAC)and total phenolic content(TPC)of Chinese ricew ine(CRW)were compared.Synergy intervalpartial least-squares(SiPLS)algorithm wasused to selectwavelengths to improve PLSmodels and support vectormachine(SVM)and principal component analysis(PCA)were applied to pre-process themerged data from two individual instruments.Itwas observed that modelsbased on the efficientspectrum intervalsselected by siPLSweremuch better than those based on the full spectra.Models from ATR-IR performed slightly better than those from FT-NIR. Moreover,SVM modelsbased on the combination of two spectroscopieswere superior to those from either FT-NIR or ATR-IR spectra,while PLSmodels based on the same information performed worse than those based on a single spectrum,whichmay be explained by some non-linearity in the data.Therefore,the integration of FT-NIR and ATR-IR was possible and could improve the prediction accuracy of TAC and TPC in Chinese ricew ine.
Chinese ricew ine,total antioxidant capacity,total phenolic content,data fusion,support vectormachine
TS 261.7
A
1673—1689(2016)04—0357—07
2015-01-09
国家“十二五”科技支撑计划项目(2012BAD37B02;2012BAD37B06)。
焦爱权(1982—),男,江苏泰州人,工学博士,副教授,硕士研究生导师,主要从事食品组分与物性研究。E-mail:jiaoaq@jiangnan.edu.cn
金征宇(1960—),男,江苏扬州人,工学博士,教授,博士研究生导师,主要从事食品组分与物性研究。E-mail:jinlab2008@yahoo.com

