尿酸酶多囊脂质体的酶学性质及其免疫原性
邓 雪,何 丹,周云莉,熊华蓉,张景勍
(1.重庆医科大学 药学院,重庆400016;2.重庆医科大学 药物高校工程研究中心/生物化学与分子药理学重点实验室,重庆400016)
尿酸酶多囊脂质体的酶学性质及其免疫原性
邓 雪,何 丹,周云莉,熊华蓉,张景勍*
(1.重庆医科大学 药学院,重庆400016;2.重庆医科大学 药物高校工程研究中心/生物化学与分子药理学重点实验室,重庆400016)
研究尿酸酶多囊脂质体(Uricase-multivesicular liposomes,UOMVLs)的酶学性质及其免疫原性。采用W/O/W复乳法制备UOMVLs,测定UOMVLs中尿酸酶(Uricase,UOX)的最适反应温度、最适反应pH值、热稳定性以及储存稳定性,并以其为抗原免疫SD大鼠,制备抗血清,通过间接ELISA法检测血清抗体效价。UOMVLs和UOX最适反应温度均为40℃;最适反应pH值分别为8.0和8.5;UOMVLs的稳定性明显高于UOX;UOMVLs和UOX的血清抗体效价分别为1∶500和1∶8 000。因此 UOMVLs的酶学性质明显优于游离UOX,免疫原性明显低于游离UOX,为该酶的临床应用提供了实验依据。
尿酸酶;多囊脂质体;酶学性质;免疫原性
尿酸酶(Uricase,UOX)催化嘌呤代谢产物尿酸[1]分解为过氧化氢和尿囊素,其广泛存在于植物、真菌、细菌及某些哺乳动物的组织中,是生物体内嘌呤降解途径中的一种重要的酶[2]。人体缺乏尿酸酶,尿酸是人体嘌呤分解代谢终产物。当尿酸生成增加或排泄减慢时,血中尿酸水平升高会形成高尿酸血症,继而引发痛风综合征等一系列疾病[3-4]。UOX专一性强,催化效率高,是治疗高尿酸血症的候选药物[5]。然而,UOX存在体内稳定性差、体内循环半衰期短、生物利用度低等缺点[6],只能通过频繁给药维持有效的血药浓度从而限制了尿酸酶的大范围的、持续的应用。
采用多囊脂质体(Multivesicular liposomes,MVLs)作为UOX的载体,以改善UOX的缺点。MVLs是采用贮库泡沫技术的一种新型脂质体[7],它由 Kim[8]于1983年通过改进细胞大小的单室脂质体的制备方法首先制得并命名,主要用于运输大分子物质和亲水性物质[9]。多囊脂质体具有包封率高、包封容积大、突释少、生物相容性和生物可降解性良好等优点[10],可以弥补现有技术难以实现的对大分子药物的高包封和低渗漏[11]。作者成功制备了尿酸酶多囊脂质体 (Uricase-multivesicular liposomes,UOMVLs),并对其酶学性质及免疫原性进行分析,希望克服UOX的缺点,扩大其临床应用。
1 材料与方法
1.1材料和仪器
1.1.1主要材料、试剂尿酸酶、异硫氰酸荧光素购自美国Sigma公司;卵磷脂购自德国Lucas Meyer公司;三油酸甘油酯购自国药集团化学试剂有限公司;胆固醇购自广州天马精细化工厂;泊洛沙姆407购自南京威尔化工有限公司;泊洛沙姆188购自德国巴斯夫公司;L-赖氨酸购自北京鼎国生物技术有限公司;含HRP的羊抗鼠工IgG购自北京中杉金桥生物技术有限公司;牛血清白蛋白BSA购自国药集团化学试剂有限公司;TMB(3,3',5,5'-四甲基联苯胺)购自研域(上海)化学试剂有限公司;乙醚购自重庆川东化工集团有限公司。
1.1.2主要仪器与动物AB204S电子分析天平购自瑞士Mettler Toledo仪器公司;RE 52 AA旋转蒸发器购自上海亚荣生化仪器厂;QL-901型旋涡混合器购自海门市其林贝尔仪器制造有限公司;TGL-16B台式高速离心机购自上海安亭科学仪器厂;TCS-SP2激光扫描共聚焦显微镜购自德国Leica公司。清洁级SD大鼠,(230±20)g,由重庆医科大学实验动物中心提供,动物合格证书为SCXK渝2012-0001。
1.2试验方法
1.2.1UOMVLs的制备采用W/O/W复乳法制备UOMVLs[12-13],取处方量的卵磷脂、胆固醇、三油酸甘油酯溶于乙醚作为油相(O),取处方量的泊洛沙姆407、泊洛沙姆188溶于质量分数3%葡萄糖溶液中作为内水相(W1),将UOX溶于内水相。内水相与油相等体积混合后,涡旋8 min制得 W/O型初乳。将初乳快速注入到含L-赖氨酸与质量分数4%葡萄糖的外水相(W2)中,初乳与外水相的体积比为1∶3,高速分散均质机剪切制成 W/O/W型复乳,室温下减压旋转蒸发除去有机溶剂,即得UOMVLs。
1.2.2UOMVLs的包封率的测定UOMVLs包封率的测定采用间接法[14-15]测定UOMVLs的包封率。吸取适量UOMVLs,离心5min后取上清液,加入氯仿混合均匀。取水层溶液,并用0.45μm的微孔滤膜过滤。取续滤液,加入考马斯亮蓝G-250,放置2 min后在595 nm波长处测定吸收度值,计算样品中游离UOX的浓度。另取UOMVLs,直接用氯仿破乳后同法操作取续滤液,并用所得吸收度值计算UOMVLs中的药物总浓度。重复3次,计算包封率。包封率按下式计算:包封率(%)=(投药质量-游离药质量)/投药质量×100%
1.2.3UOMVLs和UOX最适反应温度的测定取UOMVLs和UOX样品液,分别于20~70℃的水浴,pH8.5的硼酸缓冲液条件下测定UOMVLs及游离UOX的活性,绘制温度—活性曲线图。具体方法按照参考文献[16]。
1.2.4UOMVLs和UOX最适反应pH值的测定取UOMVLs和游离UOX样品液,在酶的最适反应温度下,分别于pH 6.5~9.5的硼酸缓冲体系中测定UOMVLs及游离UOX的活性,绘制pH—活性曲线图。
1.2.5UOMVLs和UOX储存稳定性的测定按照张敉[17]等人的方法,将UOMVLs及游离UOX放置于4℃的冰箱中,分别于第 0,1,2,4,7,10,14,20,28 d时测定UOMVLs及游离UOX的活性,绘制时间—活性曲线图。
1.2.6UOMVLs和UOX热稳定性的测定将UOMVLs及游离UOX置于55℃的水浴中,分别于0、1、2、3、4、5 h测定UOMVLs及游离UOX的活性,绘制活性—时间曲线图。
1.2.7UOX活性的测定UOX活性单位的定义:每分钟催化1μmol底物尿酸转化为产物所需的UOX的量。具体方法按照参考文献[18]。在pH 8.5的硼砂缓冲液中,以75μmol/L尿酸为底物,加入20 μL浓度为0.1mg/mL的酶样品溶液,加酶后迅速用手轻轻振摇5秒,25℃条件下反应,于0,10,20,30,40,50,60 s测定A293nm值。
1.2.8UOX与脂质膜的相互作用检测分别取空白MVL、空白MVL与UOX的混合液及UOX样品液各980μL,再加入20μL浓度为5.14μmol/L的异硫氰酸荧光素溶液[19],黑暗处孵化5 min,荧光分光光度计扫描,1 mL的比色皿中检测其荧光强度。
1.2.9UOMVLs和UOX免疫原性的检测将SD大鼠分为4组(n=6),分别为UOMVLs组,UOX组和阳性对照组、阴性对照组。分别静脉注射UOMVLs、UOX、卵白蛋白及生理盐水,给药剂量为0.5mg/kg,每周1次,连续6周。每周给药24 h后采血,分离血清,采用间接ELISA法[20-21]测定血清抗体效价:将抗原包被用pH 9.6碳酸-重碳酸盐缓冲液稀释为10μg/mL,加入孔板,100μL/孔,4℃静置过夜;弃去孔内液,洗板液洗涤3次,然后加入3%的BSA 100μL,37℃孵育1.5 h;洗涤,待测血清用质量分数0.5%的BSA稀释100倍,待阴性对照组及阳性对照组血清加样后37℃孵育1 h;洗涤,加入含HRP的羊抗鼠工IgG,100μL/孔;洗涤,每孔加新配制的反应液TMB反应10 min后终止反应,用酶标仪测定A450nm。最后一次免疫2周后取各组血清按照1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000稀释后,计算各组的抗血清效价。
2 结果与讨论
2.1UOMVLs的包封率
经检测,UOMVLs的平均包封率为 (63.75± 3.65)%。
2.2UOMVLs和U0X的最适反应温度
测定结果显示,UOMVLs和UOX的最适反应温度均为40℃,见图1。
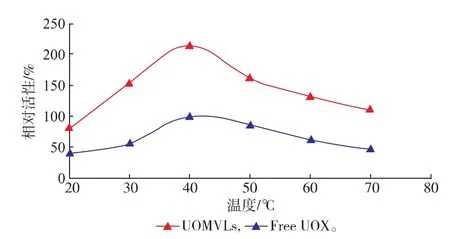
图1 UOMVLs和游离UOX的最适温度(n=3)Fig.1 Optimal tem perature of UOMVLs and free UOX,(n=3)
2.3UOMVLs和U0X的的最适反应pH值
测定结果显示,UOMVLs的最适反应pH值为8.0,UOX的最适反应pH值为8.5(见图2)。在最适温度下,UOMVLs的最适pH值为8.0,这种转变可能是在制备过程中UOX的构象发生改变所致。
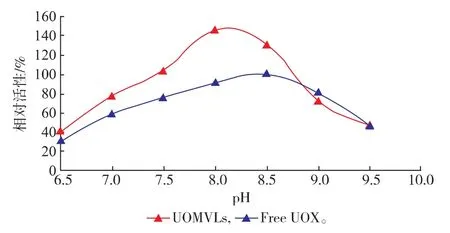
图2 UOMVLs和游离UOX的最适pH(n=3)Fig.2 OptimalpH valuesofUOM VLsand free UOX(n=3)
2.4UOMVLs和UOX储存稳定性的测定
由图3可知,在4℃贮存条件下中,28 h时UOMVLs中酶活性随时间变化保持在90%以上,UOX的活性由100%下降到34.5%。说明,UOMVLs提高了酶的稳定性。
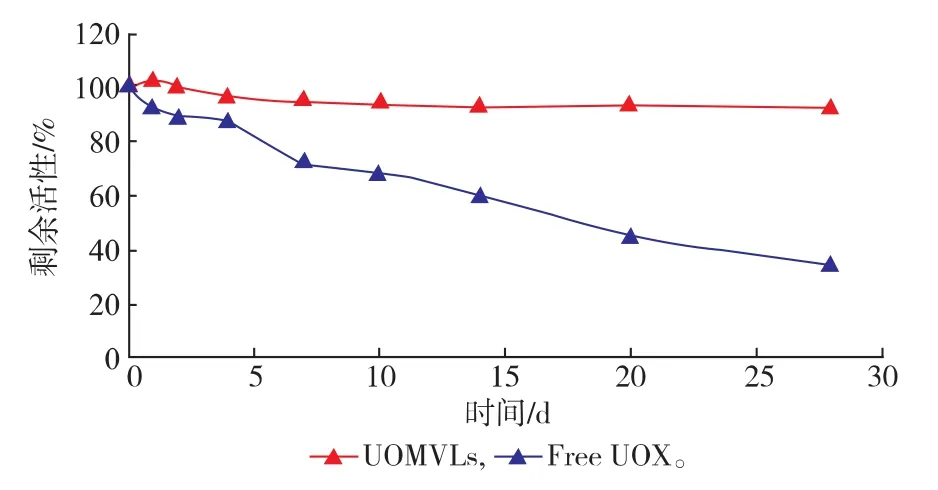
图3 4℃条件下UOMVLs和UOX的稳定性(n=3)Fig.3 Stability of UOMVLs and free UOX incubated at 4℃(n=3)
2.5UOMVLs和UOX热稳定性的测定
图4显示,0~5 h内,UOMVLs在55℃水浴条件下酶活性随时间变化保持在90%以上,游离UOX的酶活性由100%下降到39.71%。
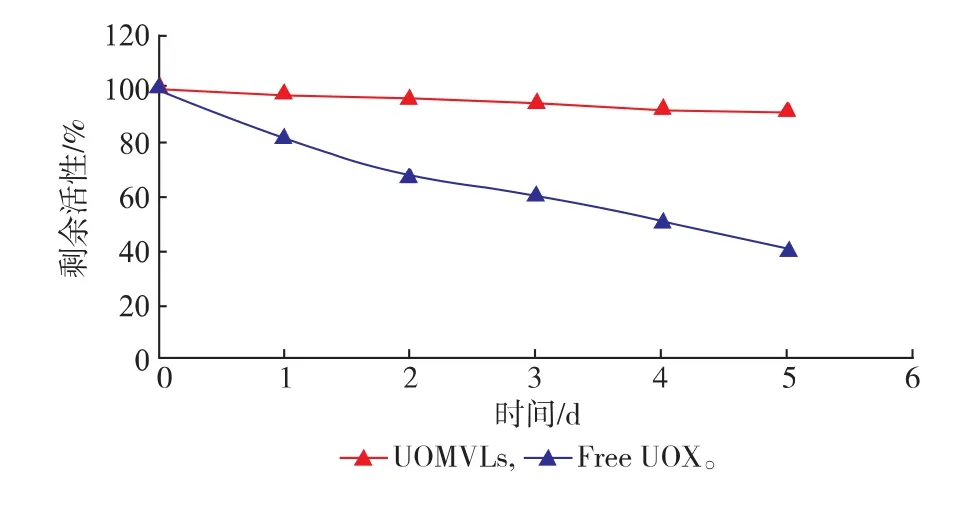
图4 55℃条件下UOMVLs和UOX的稳定性(n=3)Fig.4 Stability of UOMVLs and free UOX incubated at55℃(n=3)
2.6UOX与脂质膜的相互作用
FITC与一定量游离酶结合后会有一定值的荧光强度,而当体系中的游离酶与脂质体膜结合后,与FITC结合的游离酶相应减少,使荧光强度减弱[22-23]。如图5所示,MVLs的荧光强度最小,UOX与MVLs混合溶液的荧光强度增加,而UOX的荧光强度最大。UOMVLs较MVLs荧光强度增加,表明UOX与异硫氰酸荧光素竞争性结合脂质体膜,据此推断,UOX与MVLs发生相互作用。
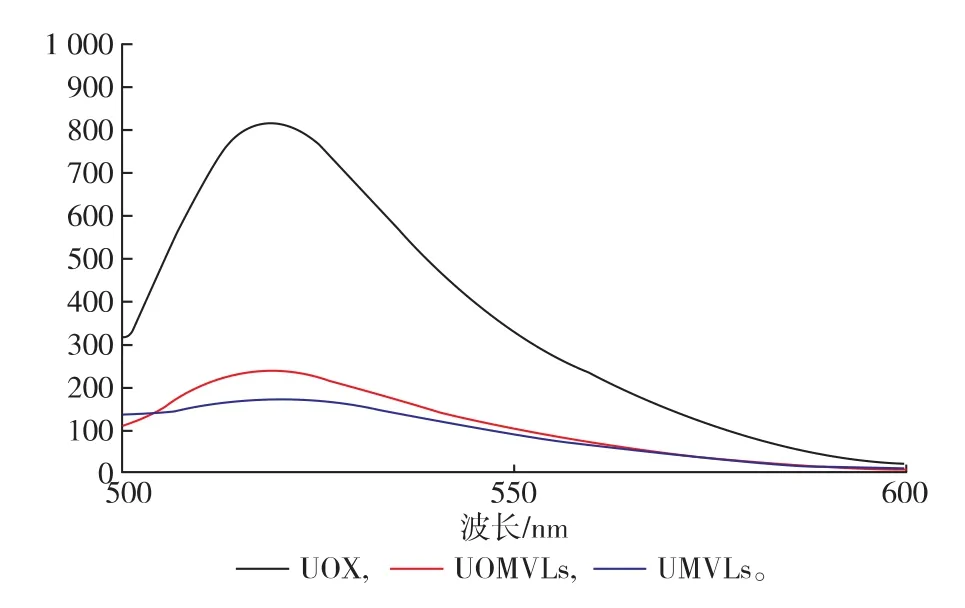
图5 荧光图谱Fig.5 FITC fluorescence spectra
2.7UOMVLs和UOX的免疫原性
ELISA结果显示,UOMVLs的抗血清效价为1∶500,UOX的抗血清效价为1∶8 000,表明UOMVLs有效降低了其免疫原性。
3 结语
UOX氧化尿酸为可溶性的尿囊素,可用于痛风的临床诊断和治疗[24]。但由于蛋白质与多肽的水溶性极好,制备普通脂质体无法达到理想的包封率,药物渗漏与突释现象也使得药物释放不甚理想[25]。作者成功制备了UOMVLs,从包封率、最适反应温度、最适反应pH、热稳定性、贮存稳定性、免疫原性对UOMVLs和游离UOX进行了研究,包封率达到了(63.75±3.65)%,克服了普通脂质体对UOX包封率低的缺点。
从最适温度的实验结果(图1)可看出UOMVLs 和UOX的最适反应温度均为40℃,此条件下UOMVLs的活性为UOX的213%。从最适pH的实验结果(图2)可看出UOMVLs和UOX的最适反应pH分别为8.0和8.5。当pH8.0时,UOMVLs的活性为UOX的160.44%;pH8.5时,UOMVLs的活性为UOX的131.00%。pH 6.5~9.5条件下,UOMVLs的活性均高UOX。
UOMVLs的稳定性是其质量控制的关键因素,良好的稳定性是大规模生产和应用于临床实现的关键[26]。由图3和图4的结果可知,在加热条件(55℃)和贮存条件(4℃)下,UOMVLs均能很好的保持UOX的活性,这说明UOX被MVLs包封在脂质膜内部后有更好的对抗外界温度变化的能力。作为一种新型制剂,UOMVLs不仅提高了UOX的贮存稳定性和热稳定性,实验证明UOMVLs还有效降低了UOX的免疫原性。
因此,UOMVLs有增强UOX活性、提高UOX体外稳定性、降低UOX免疫原性的优点。大鼠体内静脉注射UOMVLs和UOX的药代动力学结果显示,UOMVLs较UOX半衰期延长,达峰时间延后,峰浓度提高,UOMVLs的相对生物利用度约为UOX 的1 751%,UOMVLs可提高尿酸酶的生物利用度,为尿酸酶的临床应用提供了实验依据。
[1]张玉然,辛瑜,杨海麟,等.黄嘌呤氧化酶酶学性质及共价交联固定化[J].食品与生物技术学报,2014,33(1):16-21. ZHANG Yuran,XIN Yu,YANG Hailin,et al.Enzymatic properties of xanthine oxidase and its covalent immobilization on differentsupports[J].Journal of Food Science and Biotechnology,2014,33(1):16-21.(in Chinese)
[2]TamakiH,Matsuoka T,Yasuda Y,etal.A novel laccasew ith urate oxidation activity from Lysobacter sp T-15[J].J Biochem,2010,148(4):481-489.
[3]Nanda P,Babu PE.Isolation,screening and production studies of producing bacteria from poultry sources[J].Prep Biochem Biotechnol,2014,44(8):811-821.
[4]SakaiH,Tsutamoto T,Tsutsui T,eta1.Sermn levelof uric acid,partly secreted from the failing heart is a prognosticmarker in patientsw ith congestive hean failure[J].Circulation Journal,2006,70(1):1006-1011.
[5]GliozziM,Malara N,MuscoliS,etal.The treatmentofhyperuricemia[J].Int JCardiol,2015(10):10-16.
[6]周云莉,杨林,吴建勇,等.尿酸酶复合脂质体中尿酸酶的药动学考察[J].中国医院药学杂志,2014,34(21):1805-1808. ZHOU Yunli,YANG Lin,WU Jianyong,et al.Primarily study on pharmacokinetics of uricase in uricase-catalase liposome[J]. Chinese Journal of Hospital Pharmacy,2014,34(21):1805-1808.(in Chinese)
[7]VafaeiSY,Dinarvand R,EsmaeiliM,etal.Controlled-release drug delivery system based on fluocinolone acetonide-cyclodextrin inclusion complex incorporated inmultivesicular liposomes[J].Pharm Dev Technol,2014,26:1-7.
[8]Kim S,TurkerM S,ChiEY,etal.Preparation ofmultivesicular liposomes[J].Biochim Biophys Acta,1983,28(3):339-348.
[9]何盛江,张现涛,宋力,等.曲马多缓释多囊泡脂质体的制备和释放度影响因素研究[J].海峡药学,2014,26(2):19-24. HEShengjiang,ZHANG Xiantao,SONG Li,etal.Studieson preparation and the factorseffecting the releasing rate of Tra-madol PEG-coatedmultivesicular liposomes[J].Strait Pharmaceutical Journal,2014,26(2):19-24.(in Chinese)
[10]Zuo J,Gong T,Sun X,et al.Multivesicular liposomes for the sustained release of thymopentin:stability,pharmacokinetics and pharmacodynamics[J].Pharmazie,2012,67(6):507-12.
[11]李晗,梅兴国.多囊脂质体递送蛋白质/多肽类药物的研究进展[J].中国药学杂志,2014,49(2):94-98. LIHan,MEIXingguo.Research progresses ofmultivesicular liposomes in delivery of protein and peptide drugs[J].Chinese Pharmaceutical Journal,2014,49(2):94-98.(in Chinese)
[12]Chen C,Han D,Zhang Y,etal.The freeze-thawed and freeze-dried stability of cytarabine-encapsulated multivesicular liposomes [J].Int J Pharm,2010,387(1-2):147-153.
[13]Chen C,Han D,Zhang Y,etal.The freeze-thawed and freeze-dried stability of cytarabine-encapsulatedmultivesicular liposomes [J].Int JPharm,2010,387(1-2):147-153.
[14]Ramprasad M P,Am ini A,Kararli T,et al.The sustained granulopoietic effect of progenipoietin encapsulated inmultivesicular liposomes[J].Iant JPharm,2003Aug 11;261(1-2):93-103.
[15]林爱华,刘奕明,平其能.甘草酸表面修饰阿霉素壳聚糖纳米粒的制备及特性研究 [J].中国药科大学学报,2007,38(6):507-511. LINAihua,LIUYim ing,PINGQineng.Preparation and characterization of adriamycin-loaded chitosan nanoparticles surface-modifiedw ith glycyrrhizin[J].Journal of China Pharmaceutical University,2007,38(6):507-511.(in Chinese)
[16]周云莉,杨林,晏子俊,等.硼酸盐缓冲液制备尿酸酶复合脂质体及尿酸酶的特性 [J].南方医科大学学报,2015,35(2):268-271. ZHOU Yunli,YANG Lin,YAN Zijun,et al.Preparation and characterization of uricase in uricase-catalase liposomes prepared using borate buffer[J].Journal of Southern M edical University,2015,35(2):268-271.(in Chinese)
[17]张敉,杨林,周云莉,等.脂质纳米粒提高尿酸氧化酶体外稳定性的初步研究 [J].重庆医科大学学报,2014,39(10):1452-1456. ZHANG M i,YANG Lin,ZHOU Yunli,etal.Prelim inary study on the stability of urate oxidase loaded in lipid nanoparticles[J]. Journal of Chongqing M edical University,2014,39(10):1452-1456.(in Chinese)
[18]Tan Q Y,Zhang JQ,Wang N,etal.Uricase from Bacillus fastidious loaded in alkaline enzymosomes:Enhanced biochem icaland pharmacologicalcharacteristics in hypouricemic rats[J].Eur J Pharm Biopharm,2012,82(2012):43-48.
[19]Fan F,Chen C C,Zhang J,et al.Fluorescence dilution technique formeasurement of album in reflection coefficient in isolated glomeruli[J].Am J Physiol Renal Physiol,2015,doi:10.1152/ajprenal.
[20]王娜,谭群友,徐美玲,等.产朊假丝酵母尿酸酶脂质体的酶学性质及其免疫原性[J].中国生物制品学杂志,2011,24(5):547-553. WANG Na,TAN Qunyou,XU Meiling,etal.Enzymatic property and immunogenicity of uricase liposome of candida utilis[J]. Chinese Journal of Bilogicals,2011,24(5):547-553.(in Chinese)
[21]Pittman PR,Reisler R B,Lindsey C Y,etal.Safety and immunogenicity of ricin vaccine,RVEcTM,in a Phase 1 clinical trial[J]. Vaccine,2015,doi:10.1016/j.
[22]Tan Q Y,Wang N,Yang H,etal.Characterization,stabilization and activity of uricase loaded in lipid vesicles[J].International Journal of Pharmaceutics,2009,384(2010):165-172.
[23]Domenech O,Redondo L,Mom tero M T,et al.Specific adsorption of cytochrome C on cardiolipin-glycerophospholipid monolayersand bilayers[J].Langmuir,2007,23(10):5651-5656.
[24]TiwariS,Dw ivediH,Kymonil K M,etal.Urate crystal degradation for treatmentof gout:a nanoparticulate combination therapy approach[J].Drug Deliv Transl Res,2015,5(3):219-230.
[25]LayekB,Mukherjee B.Tamoxifencitrate encapsulatedsustainedrelease liposomes:preparationandevaluationof physicochem icalproperties[J].Sci Pharm,2010,78(3):507-515.
[26]戴传云,刘火安,傅亚,等.多囊脂质体-海藻酸钠微球的理化性质及初步稳定性研究 [J].中国药房,2008,19(28):2203-2205. DAI Chuanyun,LIU Huoan,FU Ya,et al.Physicochemical property and stability of MVLs-Alg microspheres[J].China Pharmacy,2008,19(28):2203-2205.(in Chinese)
Enzymology and Immunogenicity of Uricase-M ultivesicular Liposomes
DENG Xue,HE Dan,ZHOU Yunli,XIONG Huarong,ZHANG Jingqing*
(1.College of Pharmacy,Chongqing Medical University,Chongqing 400016,China;2.Engineering Research Center in University/Chongqing Key Laboratory of Biochemical&Molecular Pharmacology,Chongqing Medical University,Chongqing 400016,China)
This study aimed to investigate the enzymatic property and immunogenicity of uricase-multivesicular liposomes(UOMVLs).UOMVLs were prepared by a double emulsion method,and optimal temperatures,pH values,storage and thermal stabilities of UOMVLs and uricase (UOX)were determ ined.SD rats were immunized using UOMVLs as antigens,and their serum antibody titerswere determ ined.Results showed that the optimal temperatures for UOMVLs and U0X were both 40℃,while the optimal pH valueswere 8.0 and 8.5,respectively.The stability of UOMVLswas significantly higher than thatof U0X.The serum antibody titers of rats immunized w ith UOMVLsand UOX were 1∶500 and 1∶8 000,respectively.Therefore,the enzymatic property of UOMVLswas significantly better and the immunogenicity was obviously lower than UOX,which provided an experimentalbasis for the clinicalapplication of UOX.
uricase,multivesicular liposome,enzymatic property,immunogenicity
Q 556;R 392-33
A
1673—1689(2016)04—0364—06
2014-11-25
国家自然科学基金项目(30973645);重庆市首批高等学校优秀人才资助计划。
张景勍(1973—),女,重庆人,理学博士,教授,博士研究生导师,主要从事药物新剂型与新技术研究。E-mail:zjqrae01@163.com

