重组大肠杆菌产耐高温Fe-SOD(H 29A)的发酵条件优化
陈 伟,李 伟,朱 虎,曲剑波,刘建国
(中国石油大学 化学工程学院,山东 青岛 266580)
重组大肠杆菌产耐高温Fe-SOD(H 29A)的发酵条件优化
陈 伟,李 伟,朱 虎,曲剑波,刘建国*
(中国石油大学 化学工程学院,山东 青岛 266580)
超氧化物歧化酶在药物和化妆品等工业中具有重要的应用价值。为了提高超氧化物歧化酶的产量,作者运用E.coli BL21(DE3)/pET28a(+)-SOD重组表达系统,采用单因素实验和正交实验相结合的方法,研究了诱导表达条件和发酵培养基对重组大肠杆菌产超氧化物歧化酶的影响。实验结果表明,在培养基中添加1.20 g/L亮氨酸,30 g/L酵母粉且碳氮质量比为3,诱导剂浓度0.20mmol/L,诱导温度37℃,诱导时间8 h的条件下,菌体生长量达到最高并且Fe-SOD (H29A)的产量达到全菌体蛋白的49.37%,表达量是LB培养基发酵的1.45倍。
超氧化物歧化酶;重组大肠杆菌;发酵;优化
对于SOD研究较早的是日本和美国,其中日本主要研究溶液环境对SOD的修饰及改变[1-3],美国集中于研究SOD金属特异性及反应机理[4]。随着对SOD研究的不断深入,其在医药[5],食品以及化妆品[6]等领域的应用越来越广泛,尤其是在抗衰老,防辐射以及消炎方面的作用被广泛认可。
作者由嗜热栖热菌 T.thermophilus HB27的Mn-SOD基因片段通过聚合酶链式反应对第29位脱氧核糖核苷酸进行定点突变,然后经过基因重组并导入到E.coli BL21(DE3)中得到,经过诱导可以表达耐高温Fe-SOD(H29A),但是该重组菌的SOD表达量还较低[7]。因此,为了提高Fe-SOD(H29A)的表达量,对培养基成份和发酵条件进行优化。最终显著提高了重组大肠杆菌的产酶水平。
1 材料与方法
1.1菌种
BL21(DE3)/pET28a(+)-SO:由作者所在实验室构建并保存,具体构建方法参见文献[7]。
1.2培养基
LB培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,p H调为7.0。
LB固体培养基:每升培养基中加入20 g琼脂。
以上培养基均在120℃灭菌20 min,添加经过滤除菌的卡那霉素至终质量浓度为0.05 g/L。
在培养基优化过程中,需对培养基的成分进行替换及增加,以考察不同营养物质配比下菌体生长及目的蛋白Fe-SOD(H29A)的表达量。
1.3培养方法
摇瓶种子培养:由平板上挑取单菌落接种于LB培养基中,150 r/min、37℃条件下培养12 h。
摇瓶发酵方法:将摇瓶种子液以4%接种量接入100 mL LB培养基中,150 r/min、37℃条件下培养至对数生长期(A600nm为0.6~0.8),添加IPTG进行诱导。
1.4测定方法
1.4.1菌体浓度测定发酵液经过适当稀释后,利用紫外分光光度计(UV2450,岛津)在A600nm下测定吸光度。A600nm=读数×稀释倍数
1.4.2菌体干重测定取菌液15 mL于已称重的离心管中,于12 000 r/min下离心10 min,弃去上清液,再以超纯水清洗菌体,放置于90℃干燥箱中烘干至恒重,称重[8]。DWG=(烘干质量-离心管质量)× 1 000/15。由此得到A600nm-DCW关系的标准曲线,经过分析得y=0.541 9x+0.306 1(R2=0.994 4),其中y为菌体干重,x为A600nm。
1.4.3目的蛋白表达量测定发酵液在4℃10 000 r/min离心20 min,弃去上清液,以TE缓冲液重悬菌体。选定超声破碎仪功率400W,破碎时间4 s,间隔时间2 s,破碎次数99次,离心管放置于冰浴中。将破碎液在4℃10 000 r/min下离心10min,取上清液,用质量分数15%SDS-PAGE检测目的蛋白表达量。
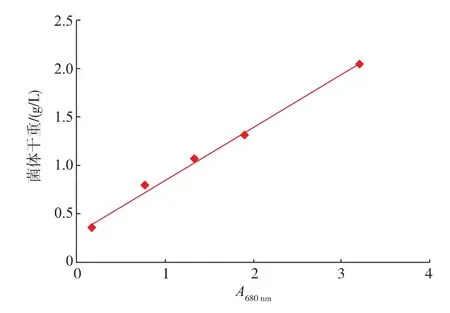
图1 DWG与A680 nm关系的标准曲线Fig.1 Standard curve of dry cellweight vs.A600 nm
电泳结束后,将凝胶用Tanon 1600凝胶成像系统分析计算表达量。
2 结果与讨论
2.1培养基优化
2.1.1氨基酸种类对菌体生长及Fe-SOD(H29A)产量的影响培养基中添加适当的氨基酸可以提供重组蛋白合成所需的原料,从而使重组蛋白正常表达。另外,还可以减少产物在细菌里的降解,促进稳定。本试验中所添加的氨基酸是Fe-SOD(H29A)所含数量最多的3种,分别为:甘氨酸(Gly)、丙氨酸(Ala)、亮氨酸(Leu),实验结果如图2所示。
实验结果表明,添加氨基酸对于菌体的生长影响并不明显,菌体密度基本维持在一个相对稳定的水平。但不同氨基酸对Fe-SOD(H29A)表达量的影响存在一定的差别。添加甘氨酸及丙氨酸对表达量提升作用不明显,而添加亮氨酸至0.4 g/L时对Fe-SOD(H29A)表达量提升促进作用较明显,因此,考察不同亮氨酸浓度对产酶水平的影响。
图3表明,当添加亮氨酸时,Fe-SOD(H29A)的表达水平逐步提高,当亮氨酸质量浓度达到1.00 g/L时,Fe-SOD(H29A)的表达量达到了较高的水平,说明亮氨酸对产酶水平有促进作用,因此确定亮氨酸加入质量浓度为1.00 g/L。

图2 不同氨基酸对菌体生长及Fe-SOD(H29A)产量的影响Fig.2 Effects of different kinds of am ino acids on the grow th of recombinant E.coli and the yield of Fe-SOD(H 29A)
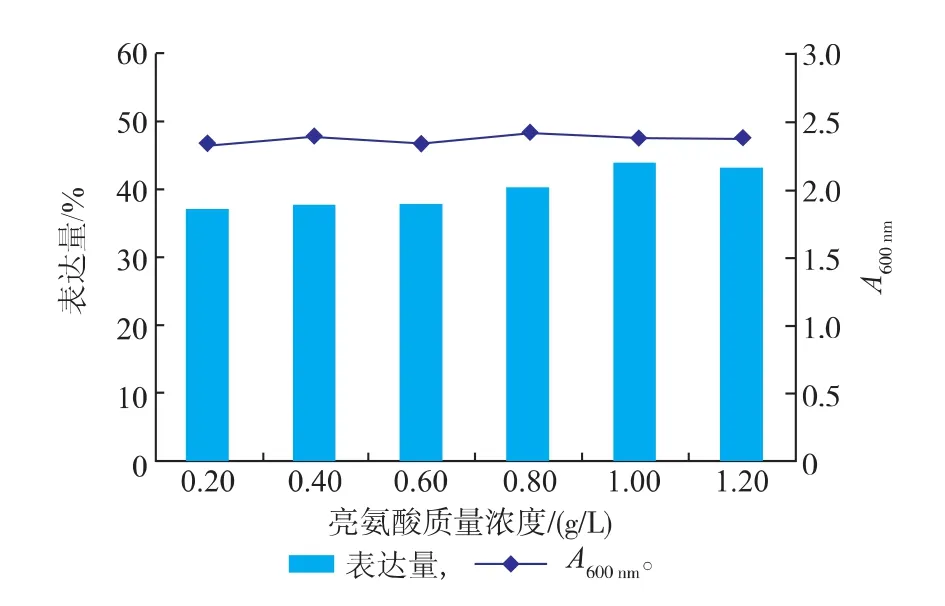
图3 亮氨酸对菌体生长及Fe-SOD(H29A)产量的影响Fig.3 Effects of Leu concentration on the grow th of recombinant E.coli and the yield of Fe-SOD (H29A)
2.1.2有机氮源对菌体生长及Fe-SOD(H29A)产量的影响有机氮源可以直接提供细菌在生长代谢过程中所需要的营养物质。但是,不同的细菌代谢过程对有机氮源的需求不尽相同,所以,选择合适配比的有机氮源是保证细菌良好生长并表达外源蛋白的基础。选定总有机氮含量为1.5 g/L,通过改变酵母粉(Y.E)和蛋白胨(T)的配比,考察了有机氮源配比对Fe-SOD(H29A)表达水平的影响(图4)。
结果表明,当培养基完全为酵母粉时菌体密度最高,说明酵母粉有利于重组菌的生长,而蛋白胨含量增加时,菌体密度呈现逐步下降的趋势。目的蛋白的表达量在氮源完全为酵母粉或蛋白胨时最高,在混合氮源时较低,虽然完全由蛋白胨作为氮源时,Fe-SOD(H29A)表达量较高,但是此时菌体密度较低,总产酶量并不高,相比较之下在纯酵母培养基中,由于细菌密度可以达到较高的水平,所产目的蛋白多于添加蛋白胨的培养基,所以确定优化条件为酵母粉30 g/L。
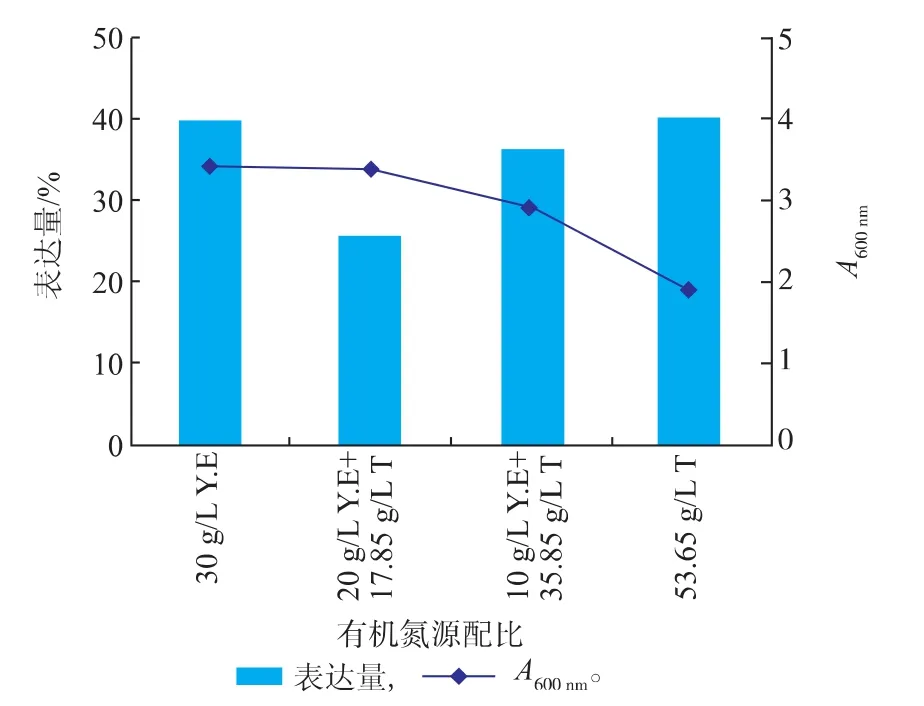
图4 有机氮源配比对菌体生长及Fe-SOD(H29A)产量的影响Fig.4 Effects of organic nitrogen ratios on the grow th of recombinant E.coli and the yield of Fe-SOD (H 29A)
2.1.3不同碳氮质量比对菌体生长及 Fe-SOD (H29A)产量的影响重组细菌在生长过程中需要消耗碳以维持正常的生理机能,在各种碳源中,葡萄糖廉价易得,检测手段简单,成为发酵过程主要的碳源。通过调整葡萄糖的加入量可以调节碳氮质量比,从而影响重组菌的生长情况。如碳氮质量比过低,则重组菌生长受到抑制,不能充分表达;而碳氮质量比过高,则重组菌代谢过于旺盛,副产物增加,同样不利于目的蛋白的表达,因此需要考察不同的碳氮质量比对Fe-SOD(H29A)表达水平的影响。
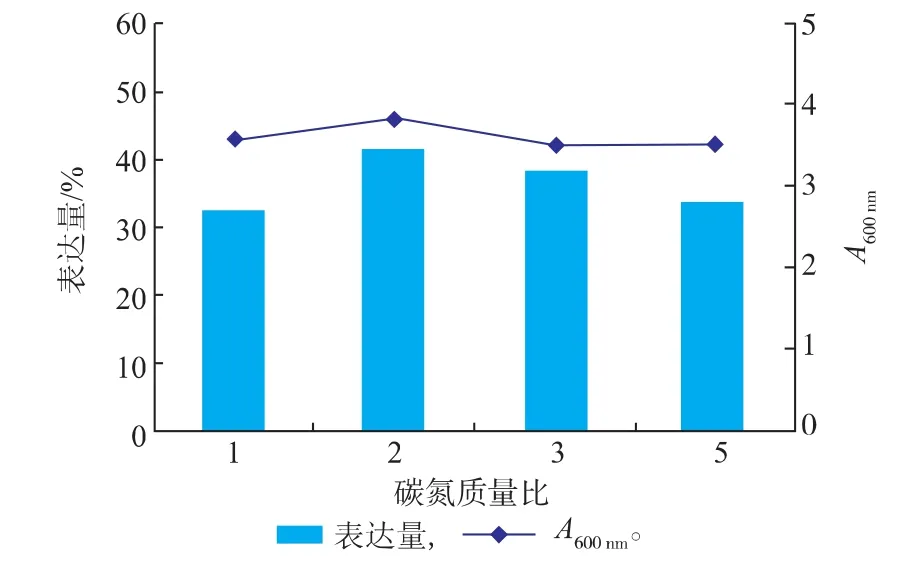
图5 碳氮质量比对菌体生长及Fe-SOD(H 29A)产量的影响Fig.5 Effect of different C/N on the grow th of recombinant E.coli and the yield of Fe-SOD(H 29A)
如图5所示,当碳氮质量比为2时,菌体生长密度相对较高,并且目的蛋白表达量也较高,而当碳氮质量比高于2时,菌体密度有所下降,可能是重组菌代谢活跃,产生的副产物抑制了重组菌的生长,并造成杂蛋白表达,与目的蛋白竞争营养物质,不利于目的蛋白的形成。因此,确定碳氮质量比为2。
2.2诱导条件优化
2.2.1诱导剂浓度对菌体生长及Fe-SOD(H29A)产量的影响IPTG是较常用的一种诱导剂,由于其本身具有毒性,当其浓度过高时,就会对菌体生长产生明显的抑制作用,进而降低目的蛋白的表达量。因此,作者考察了IPTG浓度对重组菌的生长及目的蛋白表达量的影响(图6)。

图6 IPTG浓度对菌体生长及Fe-SOD(H29A)产量的影响Fig.6 Effects of IPTG concentrations on the grow th of recombinant E.coli and the yield of Fe-SOD (H29A)
实验结果表明IPTG对重组菌的生长会产生抑制作用,当IPTG浓度增加时,重组菌生长密度呈逐步下降趋势。因此,在选定诱导剂浓度时不宜浓度过高。Fe-SOD(H29A)表达量随IPTG浓度的增加呈先升高后降低的趋势。这可能是因为IPTG对重组菌生长的抑制作用,影响了Fe-SOD(H29A)的表达,导致了表达量在IPTG浓度达到0.20mmol/L时达到最高值,然后随IPTG浓度升高逐步下降,因此确定最优IPTG浓度为0.20mmol/L。
2.2.2诱导温度对菌体生长及Fe-SOD(H29A)产量的影响温度是影响发酵过程的一个重要因素,它不仅可以影响重组菌体的生长状况,还可以影响重组酶的活性,因此选定了18、30、37、45℃来考察温度对重组菌生长及Fe-SOD(H29A)表达的影响,见图7。
实验结果表明菌体密度在37℃前随温度升高而升高,而45℃时,菌体密度明显下降,可能是因为温度过高,使得重组菌提前进入了衰亡期;Fe-SOD(H29A)表达量在30~37℃之间达到较高水平,而45℃时表达量明显下降,由于目的蛋白具有耐高温特性,因此排除45℃下酶失活的可能,据此推测可能是菌体代谢旺盛,增强了杂蛋白的表达过程,从而抑制了Fe-SOD(H29A)的表达。最终确定重组菌的诱导温度为37℃。
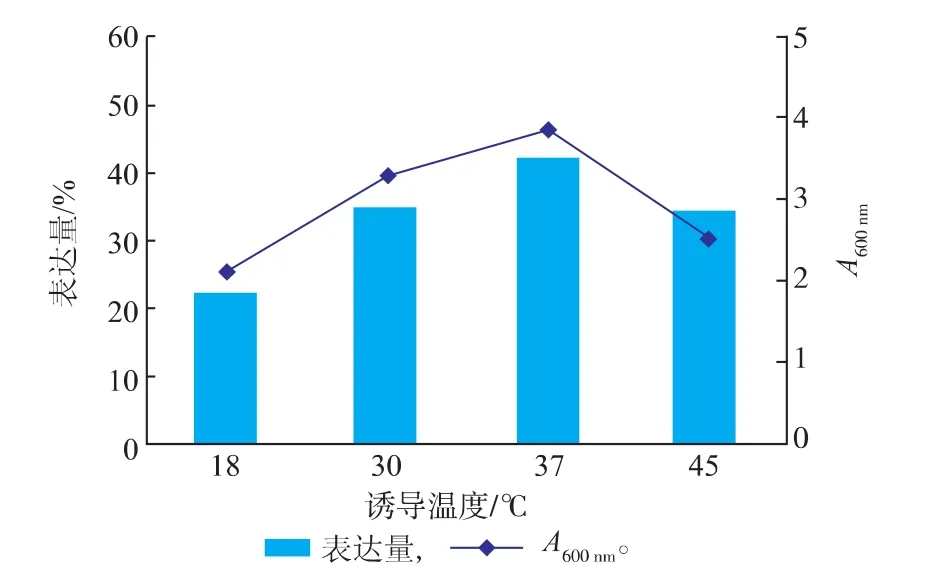
图7 诱导温度对菌体生长及Fe-SOD(H 29A)产量的影响Fig.7 Effects of induction temperatures on the grow th of recombinant E.coli and the yield of Fe-SOD (H 29A)
2.2.3诱导时间对菌体生长及Fe-SOD(H29A)产量的影响选择恰当的诱导时间不仅可以使重组菌高效生长,还影响着目的蛋白的产量,因此诱导时间是决定发酵周期长短的因素之一。为了确定重组菌E.coli BL21(DE3)的最适诱导时间,对发酵过程进行了24 h诱导试验,结果如图8所示。
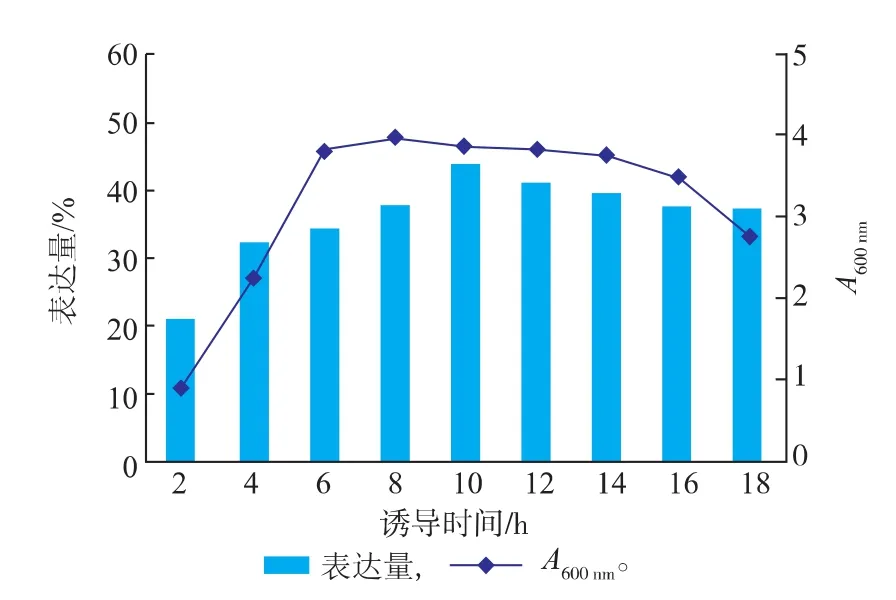
图8 诱导时间对菌体生长及Fe-SOD(H 29A)产量的影响Fig.8 Effect of induction times on the grow th of recombinant E.coli and the yield of Fe-SOD (H 29A)
实验结果表明当诱导时间为8 h时,菌体密度达到最大值,然后进入衰亡期,菌体密度逐渐开始下降。目的蛋白表达量在诱导前10 h内逐步增加,诱导10 h时达到最大值,随后有所降低,这可能是因为培养基性质的变化,引起了目的蛋白发生降解,从而导致了表达量的降低。因此,确定诱导时间为10 h。
2.3正交试验
在单因素优化的基础上,进行了正交试验分析,设计因素包括A亮氨酸质量浓度(g/L)、B碳氮质量比、C诱导剂质量浓度 (mmol/L)、D诱导时间(h)的L9(34)正交试验,设计表见表1。
通过对实验结果进行极差分析,可知C>A>D>B,即各因素对目的蛋白表达的影响显著性次序为诱导剂浓度>亮氨酸浓度>诱导时间>碳氮质量比。最佳实验方案为A3B3C2D1,即当亮氨酸质量浓度为1.20 g/L,碳氮质量比为3,诱导剂质量浓度为0.20mmol/L,诱导时间为8 h时重组蛋白的表达量达到最大,为49.37%,相对于未经过发酵优化的LB培养基发酵提高了45.21%,并且菌体生长模式也有明显变化,结果见图9。

表1 因素水平表L9(34)Table 1 Factors and levels graph L9(34)

表2 正交试验结果Table 2 Resut of orthogonal test
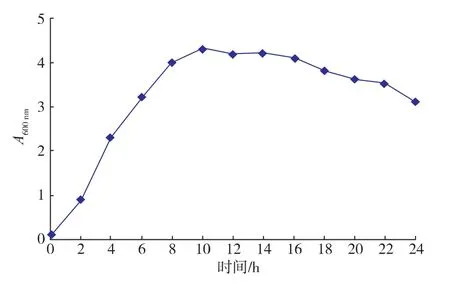
图9 重组菌生长曲线Fig.9 Grow th curve of recombinant E.coli
3 结语
作者针对产耐高温Fe-SOD(H29A)重组大肠杆菌E.coli BL21(DE3)的摇瓶发酵过程进行了优化,主要包括培养基优化和诱导条件优化。通过单因子优化方法确定了添加亮氨酸时可以有效提高目的蛋白表达量,说明亮氨酸是目的蛋白表达过程中的关键氨基酸,适当添加亮氨酸既可以提高产率,又可以避免原材料的浪费。此外,蛋白胨虽然可以提高目的蛋白的表达量,但是对重组菌体的生长不利,这与文献报道的结论一致[9],酵母粉作为氮源不仅使目的蛋白有较高的表达量,而且有利于菌体生长,酶的产量也高于蛋白胨。适当的碳氮质量比会促进细菌的生长及目的蛋白表达,但是过高的碳氮质量比会导致重组菌生长过于旺盛,从而可能产生不利于重组菌生长的副产物,并且杂蛋白的表达量也会提高,使目的蛋白表达量降低。此外在诱导条件的优化过程中,作者发现IPTG在一定浓度范围内会促进Fe-SOD(H29A)的表达,浓度过高则会抑制重组细菌的正常生长,从而不利于目的蛋白表达。诱导温度过高则会使重组菌代谢活动旺盛,提前进入衰亡期,并且使杂蛋白表达量增加。最终通过正交优化实验确定了培养基添加1.20 g/L亮氨酸,有机氮源为30 g/L酵母粉,碳氮质量比为3,诱导剂浓度为0.20 mmol/L,诱导温度为37℃,诱导时间为8 h,可使最终表达量达到49.37%,是LB培养基表达量的1.45倍,达到了较高的水平,为后续研究Fe-SOD(H29A)奠定了基础。
[1]Vance C K,M iller A F.Spectroscopic comparisons of the pH dependencies of Fe-substituted(Mn)superoxide dismutase and Fe-superoxide dismutase[J].Biochem istry,1998,37:5518-5527.
[2]陈祥娥,凌沛学,张天民.超氧化物歧化酶的应用[J].食品与药品,2013,15(4):283-285. CHEN Xiange,LING Peixue,ZHANG Tianm in.Application of superoxide dismutase[J].Food and Drug,2013,15(4):283-285.(in Chinese)
[3]Yamakura F,Kobayashi K,Ue H,et al.The pH-dependent changes of the enzym ic activity and spectroscopic properties of iron-substituted manganese superoxide dismutase.A study on themetal-specific activity of Mn-containing superoxide dismutase [J].Eur J Biochem,1995,227(3):700-706.
[4]M iller A F.Redox tuning overalmost1 V in a structurally conserved active site:lessons from Fe-containing superoxide dismutase [J].Accounts of Chem ical Research,2008,41(4):501-510.
[5]王君明,崔瑛,王峥涛,等.超氧化物歧化酶参与肝损伤的研究进展[J].中国实验方剂学杂志,2011,17(7):265-269. WANG M ingjun,CUIYing,WANG Zhengtao,et al.Research progress of superoxide dismutase involved in liver injury[J]. Chinese Journal of Experimental TraditionalM edical Formulae,2011,17(7):265-269.(in Chinese)
[6]董亮,何永志,王远亮,等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报,2013,15(5):53-58. DONG Liang,HE Yongzhi,WANG Yuanliang,et al.Research progress on application of superoxide dismutase(SOD)[J]. Journal of Agricultural Science and Technology,2013,15(5):53-58.(in Chinese)
[7]宁守娇.生物信息学方法指导改变超氧化物歧化酶金属结合类型的研究[D].青岛:中国石油大学(华东),化学工程学院. 2012.
[8]乔宇,丁宏标,闫俊艳,等.重组大肠杆菌产普鲁兰酶的高密度发酵工艺研究[J].生物技术进展,2012(3),2(3):195-200. QIAO Yu,DING Hongbiao,YAN Junyan,et al.Production of pullulanase by high cell density cultivation of recombinant Escherichia coli[J].Current Biotechnology,2012(03),2(3):195-200.(in Chinese)
[9]杨海麟,王长城,张玲,等.产胆固醇氧化酶重组大肠杆菌的发酵培养基和诱导条件的优化 [J].食品与生物技术学报,2009,28(5):670-674. YANG Hailin,WANG Changcheng,ZHANG Ling,etal.Optim ization of culture conditions forproduction of cholesteroloxidase using recombinant E.coli[J].Journal of Food Science and Biotechnology,2009,28(5):670-674.(in Chinese)
Optim ization of Fermentation Process for a Hyperthermostable Fe-Superoxide Dismutase(H 29A)Expressed in Recombinant E.coli BL21(DE3)
CHENWei,LIWei,ZHU Hu,QU Jianbo,LIU Jianguo*
(College of Chemical Engineering,China University of Petroleum,Qingdao 266580,China)
Superoxide dismutase(SOD)is an important antioxidant enzyme which has been generally applied in pharmaceuticaland cosmetics industries.A combination of single factormethod and orthogonal design was utilized to study the effect of induction expression conditions and the fermentationmedium on SOD production expressed in a recombinant E.coli BL21(DE3)/pET28a(+)-SOD and improve the production of SOD.The optimalexpression levelof49.37%and 1.45 timesof that in LB medium were achieved under the follow ing condition including 1.20 g/L of leucine,30 g/L of yeastextract,the carbon to nitrogen(C∶N)ratio of 3∶1,0.20mmol/L IPTG,induce temperature at37℃and induction timeover8 h.
superoxide dismutase,recombinant E.coli,fermentation,optim ization
Q 819
A
1673—1689(2016)04—0381—06
2014-07-03
国家自然科学基金项目(21276280);中国石油大学(华东)自主创新科研计划项目(13CX02062A,24720142056A)。
刘建国(1976—),男,山东临清人,理学博士,教授,硕士研究生导师,主要从事生物发酵工程及分离工程研究。E-mail:jianguoliu@upc.edu.cn

