Mdr1反义寡核苷酸联合磁性载药微球逆转胰腺癌耐药实验研究
赵会庚 权广前 潘耀振 尹家俊
·基础研究·
Mdr1反义寡核苷酸联合磁性载药微球逆转胰腺癌耐药实验研究
赵会庚权广前潘耀振尹家俊
目的探讨辐射促细胞转染的多药耐药(multidrug resistance,MDR)基因Mdr1反义寡核苷酸(ASON)逆转肿瘤细胞SW1990/Fu的耐药效果。方法应用 RT-PCR方法和流式细胞仪,检测2种不同的转染方法对SW1990/Fu细胞的Mdr1-mRNA及其表达产物P-糖蛋白(P-gp)的调控情况。结果反转录RT-PCR和流式细胞仪的结果显示,联合辐射的阳性脂质体介导ASON组的SW1990/Fu细胞Mdr1-mRNA的表达水平及细胞膜糖蛋白(P-gp)的阳性率均明显低于反义寡核苷酸(ASON)组(P<0.01)。结论辐射促转染的Mdr1ASON联合磁性载药微球对肿瘤细胞具有较好的耐药逆转作用。
电离辐射;反义寡核苷酸;转染;多药耐;PEG-5-FU-MAMS
DOI:10.3969/j.issn.1001-5930.2016.07.001
(ThePracticalJournalofCancer,2016,31:1045~1049)
胰腺癌是临床上常见的消化系统恶性肿瘤之一,其发病隐匿,病情进展较快,病死率较高,西方国家的发病率为12.5/10万,患者病死率超过97%[1]。在我国,胰腺癌呈上升趋势,胰腺已成为癌症死亡率中高居第五位的恶性肿瘤。目前,对胰腺癌的治疗仍采取手术切除联合化疗的综合治疗。此外,胰腺癌的根治手术切除率仅15%~20%左右[2-3],五年的生存率也仅在4%左右[4-5]。临床也表明单纯的根治手术常伴有较高的复发率和转移率,另需术后进一步辅助化疗来提高患者的生存率。反义寡核苷酸(ASON)将成为治疗恶性肿瘤的新型基因药物,作为一种治疗肿瘤的基因逆转药物,反义寡核苷酸(ASON)主要是通过碱基配对原则与靶基因结合,特异性与靶基因mRNA结合,阻断其mRNA的翻译,使该蛋白表达受阻。由于经硫代修饰的反义寡核苷酸(ASON)在体内有稳定而较长的半衰期,能主动代谢,保持与Mdr1竞争结合,能提高化疗的疗效,从而达到治疗肿瘤的目的[6]。
本课题是探讨辐射及多药耐药(Mdr1)基因逆转剂反义寡核苷酸(ASON)与新型磁性载药微球化疗药物联合作用治疗胰腺癌,观察其对胰腺癌疗效。通过探讨该方法的应用,观察胰腺癌能否减少耐药的产生以及药物的毒性和不良反应,为临床治疗胰腺癌提供新的思路。
1 材料与方法
1.1细胞系
人胰腺癌sw1990/Fu,自制。
1.2主要试剂及仪器
5-FU(Acros,Belgium),转染质粒(Mdr1反义寡核苷酸)(上海生工生物工程有限公司),磁性载药微球(天津市倍思乐公司),2xTaq PCR Master Mix (北京博迈德生物公司),脂质体LIPOFECTAMINE2000(Invitrogen coporation,USA),Anti-Human P-Glycoprotein(P-gp)(上海新肽生物科技有限公司),CO2恒温培养箱(Baxter,USA),多功能倒置显微镜(尼康,日本)FACS Calibur型流式细胞仪(美国B.D公司)。
1.3实验方法
构建人胰腺癌细胞株SW1990用DMEM培养基(含10%胎牛血清),待细胞至生长对数期,细胞消化,传代。连续传代3次后,当细胞生长至瓶壁约80%面积时,改用含5-Fu的培养基培养,起始浓度为30 nmom/L,24 h后更换无药物的细胞培养液,去除死亡的大部分细胞,以后每2天更换细胞培养基,待细胞与含药物的培养基中稳定的生长并铺满整个培养瓶,以0.25%胰蛋白酶消化传代,一瓶在含原浓度的5-Fu培养基继续传代培养,另一瓶逐渐增加5-Fu浓度至60 nmom/L。继续如上培养,连续6个月左右,最后建立耐200 nmom/L的5-Fu的胰腺癌细胞株模型表示为SW1990/Fu。
实验分组:磁性载药微球微球的药物浓度依次为3 μg/ml、6.25 μg/ml、12.5 μg/ml 25 μg/ml、50 μg/ml、100 μg/ml、200 μg/ml。
1.3.1对照组对数生长期的人胰腺癌细胞sw1990/Fu细胞经胰酶消化后,离心、收集细胞用PBS重悬,1 500 rpm室温离心5 min,弃上清,再次用PBS重悬后离心收集细胞,台盼蓝排斥实验检测活细胞力,细胞活力大于99%时稀释成单细胞悬液,调整细胞浓度为1×107/ml,sw1990/Fu细胞按2×105个/瓶接种于25 cm2细胞培养瓶中,置于37 ℃饱和相对湿度的5% CO2培养箱中培养18 h后,每组实验条件重复4个平行样品,于48 h后收集细胞,提取细胞总的RNA。
1.3.2辐射组按对照组的方法重复4个平行样品,2 Gy60Coγ照射后与48 h后收集细胞,提取细胞总的RNA。
1.3.3转染组质粒(Mdr1反义寡核苷酸)全硫代修饰碱基序列5′-CATCCCGACCTCGCGCTC-3′转染步骤:按对照组的方法重复4个平行样品,将Lipofectamine 2000转染试剂轻轻混匀,每瓶细胞用无血清培养基OPTI-MEM I 230 μl稀释20 μl Lipofectamine 2000转染试剂,轻轻混匀,室温孵育5 min。用无血清培养基OPTI-MEM I 250 μl稀释8.0 μg Mdr1反义寡义苷酸,轻轻混匀.混合稀释Lipofectamine 2000和稀释的Mdr1反义寡核苷酸,轻轻混匀,室温放置20 min使Mdr1反义寡核苷酸-Lipofectamine 2000复合物的形成。将培养瓶中的旧培养基吸出,用无血清培养基OPTI-MEM I洗两次。逐滴加入500 μl脂质体/DNA混合物到细胞培养瓶中,边加边轻轻混匀,置于37 ℃饱和相对湿度的5%CO2培养箱中培养6 h。6 h后,更换含有血清的培养基,置于37 ℃饱和相对湿度的5%CO2培养箱中培养48 h。在48 h后收集细胞,提取细胞总的RNA。
1.3.4联合组按对照组的方法重复4个平行样品,2 Gy60Coγ照射后2 h后进行细胞转染,其细胞的转染方法同上说明。在48 h后收集细胞,提取细胞总的RNA。
1.4TRIZola方法提取细胞中总的RNA
向细胞培养瓶中加1 ml的Trizol后,室温放置5 min,使其充分裂。转入1.5 ml Eppedndorf管中(RNase-free)12 000 rpm 离心5 min,弃沉淀。向Eppedndorf管中加入200 μl氯仿,震荡均匀后室温放置15 min(禁用漩涡振荡器,避免基因断裂);4 ℃,12 000 rmp离心15 min。吸取上层水相至另一新的Eppedndorf管中(RNase-free),加入0.5 ml的异丙醇,使之充分混匀,常温下放置10 min。4 ℃,12 000 rmp离心10 min,弃上清,RNA沉于管底。加入1 ml的75%乙醇(高压的DEPC水配制),温和震荡离心管悬浮沉淀。4 ℃,5 000 rmp离心5 min,弃上清。室温晾干。溶于20 μlDEPC水中测OD值定量RNA的浓度。
1.5RT-PCR
在冰浴的无RNase得离心管加入以下成分:Total RNA 1 μg,Oligo(dT)182 μl;离心后向离心管中加入下列各组成分:5×M-MLV Buffer 4 μl,dNTPs 1 μl,Rnasin 0.5 μl,M-MLV 1 μl。42 ℃温浴60 min;95 ℃加热5 min 终止反应;-20 ℃保存(或直接PCR)。Mdr1基因引物(扩增片段 bp310)上游引物序列:5-ˊCCC ATC ATT GCA ATA GCA GG-3ˊ;下游引物序列:5-ˊGTT CAA ACT TCT GCT CCT GA-3ˊ。内参β2MG基因引物(扩增片段bp120)上游引物序列:5-ˊCCA CTG AAA AAG ATG AGT AT-3ˊ下游引物序列 5-ˊCTT CAA CCT CCA TGA TGC TG-3ˊ10×PCR Buffer 10 μl。上游引物1 μl;下游引物1 μl;内参上游引物 1 μl;内参下游引物1 μl;RT反应产物 2 μl;Taq Polymerase 1 ul;ddH2O 3 μl;Total Volume 20 μl。PCR的反应条件:95 ℃ 5 min 50 ℃ 30sec 72 ℃ 1 min 反应后,混匀后稍离心,进行30个循环,然后72 ℃10 min完后4 ℃保温。
1.6电泳鉴定
10×TAE(电泳缓冲液)取200 ml,溶解0.2 g琼脂糖,电炉上煮沸后加入少量的EB(溴化乙锭),使溶液颜色稍变浅红即可。用透明胶封闭电泳板,待琼脂糖溶液冷却至温热时,倒入带有梳子的电泳版中,冷却后,拔出梳子。加样:①PCR Marker II 5 μl 加入孔中;②PCR样品1 μl样品DNA;4 μl 10×Loading Buffer 混合均匀后依次加入相应的孔中;接通电源,电压110 V 20 min进行电泳;凝胶成像仪成像检测、拍照、定量。
1.7流式细胞仪检测细胞膜糖蛋白(P-gp)阳性百分率
取出收集好的sw1990/Fu细胞,在显微镜下作细胞计数取出1×107个细胞于试管中;用台盼蓝染色计活细胞数,要求活细胞数>90%~95%;加入用PE标记的荧光素的抗体(P-gp)来标记细胞膜上的抗原,工作浓度是(1∶50),同时加上阴性sw1990/FU细胞作对照管,混匀,室温孵育20 min PBS洗涤2次,1 500 rpm 3 min,弃上清;用PBS洗涤两次,弃上清用300 μl PBS重悬细胞,上机检测计算阳性率。
1.8统计学分析

2 结果
2.1电泳分析
对实验各组细胞中Mdr1的mRNA RT-PCR结果进行电泳分析,见图1。
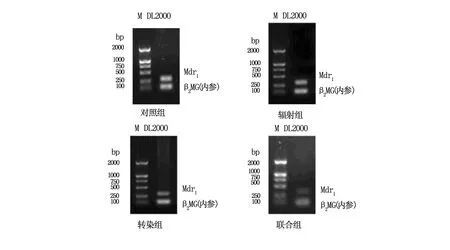
图1 电泳图
2.2Mdr1的mRNA RT-PCR结果定量实验结果
经凝胶成像系统对各实验组中的Mdr1的mRNA RT-PCR 结果进行分析显示:①空白对照A组中Mdr1mRNA 的相对表达量为1.94±0.04;②实验B组中Mdr1mRNA的相对表达量为1.83±0.07;③实验联合D组Mdr1mRNA 的相对表达量为0.68±0.10;④试验转染C组中Mdr1mRNA 的相对表达量为1.22±0.11。实验联合D组与对照A组相比,Mdr1mRNA的相对表达量降低了34.92% ;实验转染C组与对照组A组相比,Mdr1mRNA的相对表达量降低了56.78% 。单纯对照组A与转染C组、联合D组之间差异有非常显著,具有统计学意义(t=20.49,P<0.01、t=13.4,P<0.01);而转染C组与联合组D之间,差异也有显著性(t=15.15,P<0.05)。
2.3实验各组细胞膜表面糖蛋白(P-gp)表达阳性率比较(图2)
实验各组细胞膜表面糖蛋白(P-gp)阳性率流式细胞仪检测显示,对照组、辐射组、联合组、转染组中各组细胞表面膜蛋白(P-gp)阳性率分别为(41.66±1.49)%、(38.41±1.95)%、(13.83±1.89)%、(23.16±1.7)% 。可以看出,对照组与转染组间差异有非常显著性,具有统计学意义(χ2=57.44 ,P<0.01);对照组与联合组间差异也有显著性(χ2=106.79,P<0.05);转染组与联合组间差异亦有显著性(χ2=66.66 ,P<0.05)。而对照组与辐射组之间差异无显著性(χ2=92.99,P>0.05)。

图2 实验各组细胞表面P-gp阳性百分率比较
3 讨论
近年来,通过肿瘤体外药物敏感性实验指导抗癌药物的个体化治疗愈来愈受到重视,此外由于单纯的化疗药物常常引起病人全身严重的毒性反应,同时又出现肿瘤细胞的耐药性,从而影响到肿瘤治疗的效果。肿瘤的多药耐药是指肿瘤细胞在接触某1种抗癌化疗药物产生耐药的同时,也对其它结构和功能不同的药物产生交叉性耐药。在人类中,耐药主要含有Mdr1和mdr22个基因,但只有Mdr1基因产生Mdr1[7],介导多要耐药。Mdr1基因编码的糖蛋白(P-gp)是ATP结合转运蛋白(ATP binding cassette,ABC)超家族成员之一,该膜蛋白嵌插于细胞膜上,跨膜区作为膜通道有利于物质转运,具有能量依赖的跨膜药物外输功能,可以将细胞内药物包括多种抗肿瘤药物泵出胞外,使细胞内药物积聚浓度下降,产生耐药[8],大多数肿瘤以此为主要机制。Mdr1首先转录为mRNA后在经过修饰后翻译为具有活性的功能蛋白糖蛋白(P-gp),在这个过程中mRNA是个关键,阻断这个环节可以减少翻译为糖蛋白(P-gp)蛋白的绝对数量。大量的研究认为Mdr1及表达产物糖蛋白(P-gp)不但介导肿瘤细胞的多药耐药,而且还是临床评价恶性肿瘤程度的一个生物学指标。Hirfumi等[9]在研究胰腺导管腺癌后认为糖蛋白(P-gp)表达不仅与肿瘤的生物侵袭性负相关,而且也是预后较好的一个独立指标,因此检测Mdr1及其表达蛋白糖蛋白(P-gp)具有重要意义。研究表明[10]Mdr1基因表达量越高,耐药性越强,疗效越差。随着分子生物学的发展,检测手段的增加,目前检测Mdr1的方法主要是通过检测Mdr1耐药基因和mRNA及其表达的糖蛋白(P-gp)来确定。Mdr1基因检测最常用的方法是Southern blot分子杂交技术,多数认为Mdr1基因扩增局限与体外药物的筛选的耐药细胞株,但由于Mdr1基因在体内具有表达基因低、组织分布不均、表达的个体差异性等特点,降低了检测Mdr1扩增程度的应用价值。而mRNA检测最常用的方法是原位杂交(insitu hybridization,ISH)及RT-PCR。ISH可检测Mdr1阳性细胞在肿瘤组织中的定位并可准确定量[11],其缺点是操作复杂及费用昂贵。此外由于mRNA 极易降解很难检测,但随着转录技术的发展,反转录RT-PCR(revese-tanscripition,PCR) 中文译为逆转录聚合酶链反应,此方法被广泛应用科研及临床。该技术是在PCR 技术基础上设计出的新技术,该方法先将RNA 逆转录合成cDNA,再用聚合酶扩增,就能检出少许细胞的总RNA稀少的mRNA,RT-PCR技术与其它方法相比,具有特异性高、准确性好、稳定性强、灵敏度高及简便快速的特点[12],是目前检测多药耐药(MDR)基因较理想手段。此外检测细胞膜糖蛋白(P-gp)可分为对其表达和功能进行评价,Western和免疫组化分析可用来评价糖蛋白(P-gp)的表达程度,以提高检测敏感性和特异性。常用的抗体有MRK-16、MRK-17、UIC2及JBS-1等,但所有MAbs均存在不同的缺点,目前尚未制备出用于检测P-gp表达的理想MAbs。通常流式细胞仪是检测细胞膜糖蛋白(P-gp)及功能的主要方法,但多适合于血液系统组织标本,很难适合对实体肿瘤进行检测。
本实验检测PEG-5-FU-MAMS新型化疗药物及其在恒定磁场,辐射、逆转染剂在体外实验通过对人胰腺癌sw1990/Fu mRNA表达的半定量分析及细胞膜糖蛋白(P-gp)在细胞内的蛋白表达水平,探讨各种实验方法对多药耐药基因(Mdr1)及其表达的糖蛋白(P-gp)的有效性,从而为将来的胰腺癌的临床治疗与诊断提供有效的治疗途径。其中Mdr1mRNA表达丰度的半定量是根据同一细胞株中Mdr1与B-actin基因的RT-PCR产物进行比较,判断Mdr1mRNA在细胞中表达丰度的高低[13],在某种程度上反应多药耐药基因(Mdr1)转录为mRNA量的变化。药耐药基因(Mdr1)表达的产物细胞膜上的糖蛋白(P-gp)的检测我们主要通过流式细胞仪检测其含量。
通过mRNA的RT-PCR的半定量分析以及细胞膜上表达的糖蛋白(P-gp)的分析表明:多药耐药基因(Mdr1)逆转剂反义寡核苷酸(ASON)联合低剂量辐射及磁性载药微球在一定的磁场下能显著地减低多药耐药基因的表达,为临床诊断治疗胰腺癌多药耐药机制及逆转剂和新型化疗药物提供有效依据。目前,基因逆转剂反义寡核苷酸(ASON)及新型化疗药物磁性载药微球在体外研究的较多,对于肿瘤的治疗已经得到证实,但两者的联合应用还未见报道,本实验是通过两者的联合应用,在体外实验观察对应于胰腺癌耐药细胞株SW1990/Fu的治疗效果,辐射及反义寡核苷酸(ASON)与新型化疗药物的作用机理不尽相同,潘耀振等认为辐射也能促进转染,辐射产生的氧自由基,可引起一系列细胞膜脂质过氧化作用,不断使细胞膜的膜磷脂平衡改变,使细胞膜的流动性、通透性增加、转运功能异常。反义寡核苷酸(ASON)是通过阳性脂质体介导作用,把反义寡核苷酸(ASON)片段转染到细胞内,与多药耐药(Mdr1)基因碱基序列互补,阻断其多药耐药(Mdr1)基因细胞膜蛋白(P-gp)的表达[14],由于细胞膜蛋白(P-gp)具有外排泵的活性,在一定程度上也阻断细胞内化疗药物的外排,使肿瘤细胞内化疗药物浓度相对增加,从而达到化疗药物杀伤肿瘤细胞的作用,两者的相互作用,使脂质体介导的反义寡核苷酸片段(ASON)更易进入细胞内,与DNA或RNA结合,效率增加,两者具有一定的协同作用,相互促尽,提高了治疗效果,使细胞膜蛋白(P-gp)的表达相对降低,我们通过逆转录(RT-PCR)方法对多药耐药基因(Mdr1)转录为mRNA量的表达来检测,细胞膜糖蛋白(P-gp)的表达通过流式细胞仪检测得到证实,联合治疗能明显降低两者的相对表达量。这一结果为进一步动物实验提供理论依据,也为临床用药提供一定的实验理论依据,具有重要的应用前景。
[1]朱玲,丛林,赵玉沛.胰腺癌的放射治疗进展〔J〕.中
华肝胆外科杂志,2011,17(11):944-947.
[2]Pmpmito D,Santoro R,Manclni B Galling S,et al.Palliative procedures in the treatment of non-resectable pneteatie tumors.〔J〕.Ann Ital Chic,1998,68(2):185-193.
[3]延龄.胰腺癌的辅助化疗〔J〕.中国实用外科杂志,2002,22(5):260-261.
[4]桂霞,流水熊,曾狄闻.胰腺癌治疗进展〔J〕.中华实用外科杂志,2002,22(5):260-261.
[5]Hiroki Y,Masaji T,Hironobu O,et al.Locoregional chemotherapy for patients with pancreatic cancer intra-arterial adjuvant chemotherapy after ancreatectomy with portal vein resection〔J〕.Pancreas,2002,25(4):366-372
[6]Feng J,Zou J,Li L,et al.Antissense oligodeoxynucleotides targeting ATM strengthen apoptosis of laryngeal squamous cell carcinoma gorown in nude mice〔J〕.J Exp Clin Cancer Res,2011,30:43
[7]Tatsumi M,Yabe M.Application of rapid colorimetric assay to several functional assays of monkey lymphocytes〔J〕.Nippon Juigaku Zasshi,1986,48(3):453-460.
[8]Gerlier D,Thomasset N.Use of MTT colorimetric assay to measure cell activation〔J〕. Immunol Methods,1986,94(1-2):57-63.
[9]杨浩.梁哲,农艺,等.体外培养脊髓神经元过程中关于提高细胞产率以及活性的技术探讨〔J〕.解剖学杂志,l997,20(3):239-242.
[10]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays〔J〕.J Immunol Methods,1983,65(1-2):55-63.
[11]Wu B,Zhu JS,Zhang Y,et al.Predictive value of MTT asssy as an in virto chemosensitivity testing for gastri cancer:one institution's experience 〔J〕.World Gastroenterol,2008,14(19):3064-3068.
[12]Cole SP,Bhardwaj G,Gerlach JH,et al.Overxpression of a transporter gene in a multidrug resistant human lung cancer cell line 〔J〕.Science,1992,258(5088):1650-1654.
[13]Skrypek N,Vasseur R,Vincent A,et al.The oncogenic receptor ErbB2 modulates gemcitabine andirinotecan/SN-38 chemoresistance of human pancreatic cancer cells via hCNT1 transporter and multidrug-resistance associated protein MRP-2 〔J〕.Oncotarget,2015,6(13):10853-10866.
[14]Song B,Liu XS,Rice SJ,et al.Plk1 phosphorylation of Orc2 and Hbo1 contributes to gemcitabine resistance in pancreatic cancer〔J〕.Mol Cancer Ther,2013,12(1):58-68.
(编辑:吴小红)
Reversal of Multidrug Resistance Antisense Oligodeoxynucletedes and PEG-5-FU-MAMS Towards Human Pancreatic Cell Line
ZHAOHuigeng,QUANGuangqian,PANYaozhen,etal.
AffiliatedZhongshanHospitalofDalianUniversity,Dalian,116001
ObjectiveTo investigate the reversal the multidrug resisitance(MDR) by MDR gene mdrl antisense oligodeoxynucletdes(ASON) and Polyethylene Glycol modified 5-Fluorouracil magnetic albumin miscrospheres(PEG-5-FU-MAMS) in the human pancreatic cancer cell line in SW1990/Fu.MethodsThe expression of Mdr1at mRNA level was examined by RT-PCR.Flow cytometry was used to demonstrated the positive rate the Mdr1gene product P-glucopretein(P-gp) in lipo-ASON treated cells with 2 different methods.ResultsThe inhibitory efficiency of lipo-ASON and ionizing radiation plus Polye-Thylene Glycol modified 5-Fluorouracil magnetic albumin miscrospheres(PEG-5-FU-MAMS) was higher than that without ionizing radiation(P<0.01).The IC50,The Mdr1RNA expression level,and P-gp positive rate of irradiated sw1990/Fu cells were all significantly lower than those of unirradiated cells(P<0.05).ConclusionThe reversal effect of Mdr1ASON and ionizing radiation plus Polyethy-lene Glycol modified 5-Fluorouracil magnetic albumin miscrospheres(PEG-5-FU-MAMS) is stronger on resistant cell than that of Mdr1ASON and Polyethylene Glycol modified 5-Fluorouracil magnetic albumin miscrospheres(PEG-5-FU-MAMS) alone.
Lonizing radition;Multidrug resistance;Antisense oligodeoxynuce-letides;Gene transfection;PEG-5-FU-MAMS;The pancreatic cancer
辽宁省自然科学基金项目(编号:201102006)
116001大连大学附属中山医院
尹家俊
R735.9
A
1001-5930(2016)07-1045-05
2015-08-21
2016-01-27)

