化疗后肝癌侵袭转移潜能的变化及其机理的实验研究
刘 俊 孙秋实
化疗后肝癌侵袭转移潜能的变化及其机理的实验研究
刘俊孙秋实
目的探讨化疗后肝癌侵袭转移潜能的变化及其机理。方法运用基因芯片的方法筛查出人肝癌的相关因子,在筛查出的因子中进一步用免疫组化进行验证,化疗前和化疗后进行比较。由于化疗后肿瘤侵袭转移能力减弱,所以进一步检测其侵袭转移变化,通过免疫荧光检测进行确认。染色指标为LYVE-1(标记微淋巴管)和VEGF,检测样本化疗后组织,化疗前组织。结果检测临床样本中相关因子的表达,在检测结果中发现在化疗后VEGF低表达,为了确定这一结果,采用免疫组化进一步确定了这一结果,发现化疗前高表达VEGF,P<0.05。免疫荧光结果显示在低表达VEGF时的癌组织中淋巴管的表达也降低(相比于癌旁组织和正常组织)。结论化疗后VEGF可以通过调节淋巴内皮细胞进行抑制肝癌细胞的侵袭转移。
血管表皮生长因子;肝癌;淋巴管;化疗
DOI:10.3969/j.issn.1001-5930.2016.07.002
(ThePracticalJournalofCancer,2016,31:1050~1052)
在西方国家中,肝癌在肿瘤疾病中处于第二难治愈肿瘤。肝癌的发病率和死亡率在恶性肿瘤中上升至第三位,我国和全世界范围的发病率和死亡率仍处于上升趋势[1-2]。尽管预防措施和治疗手段不断改进,但肝癌转移患者5年的生存率仍低于10%[3-4],及时控制肿瘤的发生发展和抑制转移是提高生存率的有效手段。肝癌的扩散有很多方式,淋巴管的浸润和转移是其最为常见的方式[5-6]。
表皮生长因子刺激增殖,促进淋巴管的生成和血管新生。据研究表明,VEGF在肿瘤组织中的表达和淋巴结的转移呈正相关。早期的研究表明VEGF家族和其受体在肝癌中会引起肝癌细胞的浸润,而且有学者证实VEGF的高表达是促进了其肿瘤相关的淋巴管扩张,因此在肝癌转移中抑制淋巴管的生成成为一个很有效的方式[7]。所以我们需要证实在化疗后肝癌中VEGF是否会引起淋巴管和血管的变化,进而引起化疗后肝肿瘤的变化。
1 材料与方法
1.1模型构造
收集我院肿瘤科化疗后肝癌患者样本22例和化疗前肝癌组织的样本22例进行对照,患者各类临床资料均良好保存。
1.2方法
1.2.1RT-PCR试剂及方法逆转录试剂盒购自TaKaRa公司,称取等量组织或血清,加入同等比例的Trizol,12 000 r/min,4 ℃离心10 min;吸取上清液至一新的EP管中,静置5 min,使之充分裂解;加入200 μL氯仿,剧烈震荡15 s,然后放置3 min;12 000 r/min,4 ℃离心15 min,离完后分为3层,取最上层(中间一层为蛋白)至一新的EP管中,加入等体积异丙醇,颠倒数次,室温沉淀10 min;12 000 r/min,4 ℃离心10 min,弃上清液;加入75%乙醇(DEPC水溶解),颠倒数次混匀;7 500 r/min,4 ℃ 5 min,弃上清液,小心吸尽液体(此时可以看到白色沉淀即为RNA);RNA略干后加入20 μL DEPC水。采用(Ambion公司)小分子分离试剂盒分理处小分子RNA,基因芯片购自于Affymetrix Human Geome公司。
1.2.2免疫组化①脱蜡:按照常规脱蜡方法,在二甲苯,无水乙醇,95%乙醇,90%乙醇,85%乙醇,80%乙醇脱蜡,大约每次时间为10 min。②抗原修复:PBS洗后,加入3%H2O2,37 ℃浸泡10 min,从而除去内源性的过氧化氢酶,PBS洗,再加入柠檬酸缓冲液,高温高压修复5 min,冷却至室温。③血清封闭: PBS洗,5 min,洗3次,擦干组织周围的PBS液,然后10%BSA封闭,放入37 ℃温箱中1 h。④加一抗:将温箱中的载玻片取出,用吸水纸擦干载玻片反面和正面组织周围的血清,加一抗,加完一抗(VEGF,购自于santa)后于4 ℃冰箱中保存过夜。⑤加二抗:将载玻片从冰箱中取出,放入PBS中洗3次,每次5 min,擦干组织周围的PBS后加上二抗,然后置于37 ℃温箱中1 h。⑥加显色剂:将片子从温箱中取出,放入PBS中洗3次,每次5 min,擦干组织周围的PBS后加上DAB显色剂。
1.2.3免疫荧光染色组织经过固定后,蔗糖梯度脱水,冰冻切片,切片厚度为6 μm,高温修复5 min,待其冷却后,PBS洗涤(3次,每次5 min),10%BSA封闭50 min,然后进行一抗染色,过夜,第2天复温40 min,PBS洗涤(3次,每次5 min),然后进行荧光二抗染色,一抗为VEGF(抗兔),购自于santa,1∶100,标记血管内皮细胞,LYVE-1(抗羊),购自于santa,1∶100,二抗分别选用,抗兔(595 nm),抗山羊(488 nm)。
1.3统计学处理
用SPSS 11.0统计软件包处理,统计学方法采用t检验,Pearson相关分析,χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1血管表皮生长因子在化疗后肝癌中低表达
在我们的研究中发现我们所提取的RNA纯度较高,且未出现降解等情况。采取28 s和18 s的比例,28 s和18 s是真核生物rRNA(核糖体RNA)的2个主要亚基,在体内含量较多。28 s/18 s即为衡量提取的RNA完整性的指标,如果28 s/18 s为1.8~2.0表明所提取RNA完整性较好,基本无降解发生。电泳条带上应是28 s在上,18 s在下,且亮度为28 s是18 s的2倍[8]。详细结果见图1。将化疗前肝癌组织和化疗后肝癌组织进行基因芯片的筛选,在筛选中我们发现VEGF在化疗后肝癌中低表达。如图2所示。

图1 提取RNA中18 s与28 s的含量
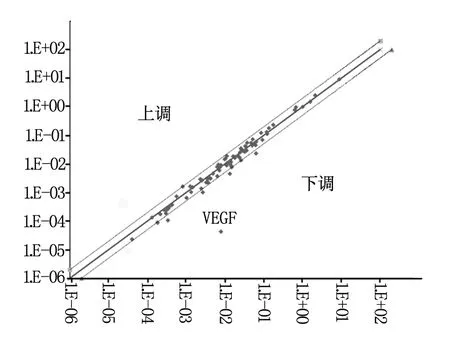
图2 基因芯片筛选出VEGF在化疗的肝癌组织中低表达
2.2化疗前后癌组织中VEGF的表达
为了进一步验证VEGF在化疗前后肝癌组织中的表达情况,我们进一步进行了验证,在化疗前后肝癌组织中我们检测VEGF的表达,在检测中我们发现22例化疗后VEGF低表达,与化疗前比较,差异具有统计学意义,P<0.05。见图3。
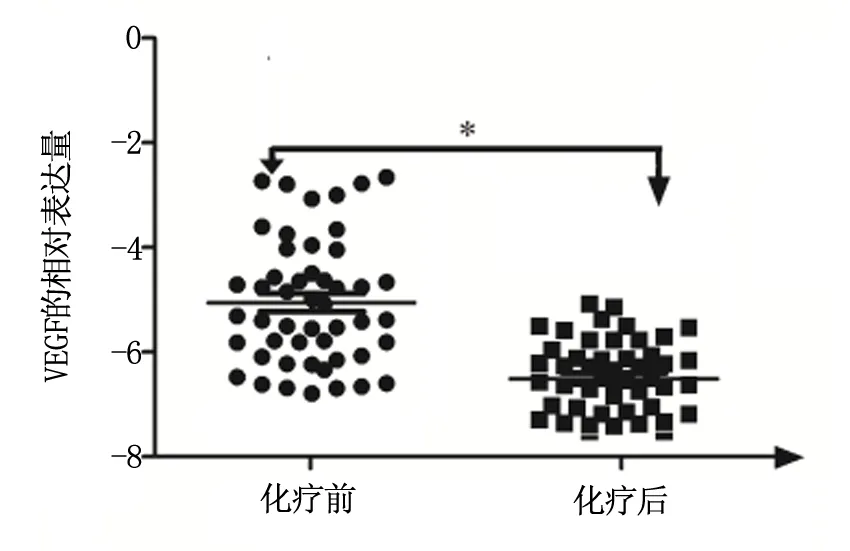
图3 VEGF在化疗前后肝癌中的表达情况
2.3组织中LYVE-1和VEGF的检测
在检测出VEGF在化疗后肝癌组织中低表达后,我们进一步探讨VEGF对化疗后肝癌细胞侵袭转移的机制。在前人报道中我们知道淋巴管的生长与侵袭转移有着密切的关系,因此我们选取化疗后肝癌组织和未化疗的肝癌组织进行研究(此两种细胞中癌细胞的数量逐渐增加),根据前人的研究,我们猜测VEGF影响淋巴管的生成进而影响肿瘤细胞的生长。为了验证猜测结果我们对2种组织进行免疫荧光标记,发现在未化疗肝癌组织中高表达VEGF时其淋巴管和血管内均增高(相比于化疗组),为了证实这种结果是VEGF造成的,我们看到在化疗后肝癌组织中VEGF低表达(相比于未化疗组),果然在低表达VEGF时其相对未化疗癌组织,淋巴管和血管内均降低。
3 讨论
肝癌是人类疾病中恶性程度较高的一类疾病,其主要特点是易发生转移,特别是淋巴结的转移。转移的肿瘤通过血液,淋巴管,进而形成多种其他肿瘤,淋巴管的转移包括一系列的复杂过程,包括:①原位癌恶性肿瘤细胞扩散至旁边淋巴管;②肿瘤细胞通过淋巴管转运至邻近的淋巴结;③肿瘤细胞在淋巴结中的着落;④转移性的肿瘤在淋巴结中的扩散[9-10]。
最近的研究多集中在VEGF家族在肝癌中的作用,特别是VEGF-C。VEGF-C是在1996年从人前列腺癌PC-3细胞株中分离出来,其位于染色体4q34,在其编码外端有7个外显子,是人类第1个发现的具有促进淋巴管生成的基因[11-12]。VEGF具有诱导淋巴管生成和血管新生的潜能,且能调节生理性的和病理性的血管新生,因此VEGF在肿瘤发生发展和肿瘤侵袭转移中发挥着重要作用[13]。VEGF主要在血管中表达,它的主要作用就是集中在促进血管新生方面,在肿瘤区域,血管新生是肿瘤发生发展的一个重要原因,所以研究VEGF在化疗后肝癌中的研究就显得尤为重要。
基于本研究展开在化疗后进行VEGF的研究,检测结果发现未化疗肝癌组织中高表达VEGF时其淋巴管和血管内均增高(相比于正常组时),且有统计学差异(分别为P<0.001和P<0.05),为了证实这种结果是VEGF造成的,我们看到在化疗后肝癌旁组织中VEGF低表达(相比于癌组织),果然在低表达VEGF时其相对癌组织,淋巴管和血管内均降低,所以我们得出结果VEGF可以通过调节淋巴内皮细胞进行减少化疗后肝癌的侵袭转移。通过今后研究愈加深入,VEGF极有可能成为抑制肝癌侵袭转移的靶向药物。
[1]Milanizadeh S,Khanyaghma M,Haghighi MM,et al.Molecular analysis of imperativepolymorphisms of MLH1 gene in sporadic colorectal cancer〔J〕.Cancer Biomark,2013,13(6):427-432.
[2]Abdel-Wahab M,El-Ghawalby N,Mostafa M,et al.Epidemiology of hepatocellular carcinoma in lower Egypt,Mansoura Gastroenterology Center〔J〕.Hepatogastroenterology,2007,54(73):157-162.
[3]丁光伟,徐秋霞,杨玉秀,等.肝硬化和肝癌差异基因表达的对比研究〔J〕.胃肠病学和肝病学杂志,2006,15(3):260-263.
[4]Kojiro M,Kawabata K,Kawano Y,et al.Hepatocellular carcinoma presenting as intrabile duct tumor growth:aclinicopathologic study of 24 cases〔J〕.Cancer,1982,49(10):2144-2147.
[5]Huang J,Deng Q,Wang Q,et al.Exome sequencing ofhepatitis B virus-associated hepatocellular carcinoma〔J〕.Nat Genet,2012,44(10):1117-1121.
[6]黄力文,马曾辰.原发性肝癌的根治性切除标准〔J〕.中华肝胆外科杂志,2003,9(1):8-9.
[7]Gargalionis AN,Basdra EK.Insights in microRNAs biology〔J〕.Curr Top Med Chem,2013,13(13):1493-1502.
[8]Ronald JA,Katzenberg R,Nielsen CH,et al.MicroRNA-regulated non-viral vectors with improved tumor specificity in an orthotopic rat model of hepatocellular carcinoma〔J〕.Gene Ther,2013,20(10):1006-1013.
[9]Liu SG,Qin XG,Zhao BS,et al.Differential expression of miRNAs in esophageal cancer tissue〔J〕.Oncol Lett,2013,5(5):1639-1642.
[10]Gui J,Tian Y,Wen X,et al.Serum microRNA characterization identifies miR-885-5p as a potential marker for detecting liver pathologies〔J〕.Clin Sci(Lond),2011,120(5):183-193.
[11]Chen Q,Ge X,Zhang Y,et al.Plasma miR-122 and miR-192 as potential novel biomarkers for the early detection of distant metastasis of gastric cancer〔J〕.Oncol Rep,2014,31(4):1863-1870.
[12]Hansen TB,Jensen TI,Clausen BH,et al.Natural RNA circles function as efficient microRNA sponges〔J〕.Nature,2013,495(7441):384-388.
[13]Wang L,Yao M,Dong Z,et al.Circulating specific biomarkers in diagnosis of hepatocellular carcinoma and its metastasis monitoring〔J〕.Tumour Biol,2014,35(1):9-20.
(编辑:甘艳)
The Mechanism of Potential Invasion and Metastasis in HCC after Chemotherapy
LIUJun,SUNQiushi.
XiantaoFirstPeople'sHospital,Xiantao,433000
ObjectiveTo study the mechanism of potential invasion and metastasis in HCC after chemotherapy.MethodsRelated gene from HCC tissues were screened by gene array,verificated by IHC,and compared after chemotherapy and before chemotherapy.Because of the decrease of potential invasion and metastasis after chemotherapy,the endothelial lymphatic were detected by IF,LYVE-1,the marker of lymphatic endothelial cell and VEGF was the marker of vascular endothelial cells.Results P<0.05,low expression of VEGF showed low lymph-vessel in cancer tissues.ConclusionVEGF can regulate the endothelial lymphatic to inhibit invasion and metastasis in HCC.
VEGF;HCC;Lymph-vessel;Chemotherapy
433000 湖北省仙桃市第一人民医院(刘俊);441021 湖北省襄阳市中心医院(孙秋实)
孙秋实
R735.7
A
1001-5930(2016)07-1050-03
2015-08-10
2015-12-21)

