273.15 K下四元体系Li+,Mg2+∥Cl-,SO42--H2O相平衡研究*
任效京,黄雪莉(新疆煤炭洁净转化与化工过程重点实验室,新疆大学化学化工学院,新疆乌鲁木齐830046)
273.15 K下四元体系Li+,Mg2+∥Cl-,SO42--H2O相平衡研究*
任效京,黄雪莉
(新疆煤炭洁净转化与化工过程重点实验室,新疆大学化学化工学院,新疆乌鲁木齐830046)
采用等温溶解平衡法研究了273.15 K下四元体系Li+,Mg2+∥Cl-,SO42--H2O的相平衡关系。测定了该体系各种盐类的溶解度及溶液密度,并绘制相图。研究结果表明:273.15 K下四元体系Li+,Mg2+∥Cl-,SO42--H2O等温相图有5个单盐结晶区(Li2SO4·H2O,MgSO4·7H2O,LiCl·2H2O,LiCl·MgCl2·7H2O,MgCl2·6H2O);7条单变量线和3个共饱点。与该体系下298.15 K相图相比,MgSO4·7H2O结晶区变大;Li2SO4·H2O和MgCl2·6H2O结晶区明显减小;LiCl· MgCl2·7H2O和LiCl·2H2O结晶区比较小,减小不明显。温度对硫酸盐结晶区的影响较大。
锂;溶解度;相平衡
中国盐湖资源常位于干旱少雨地区,冬季寒冷漫长,因此开发利用冬季冷能的低温工艺很有意义。在开发低温工艺时需要低温相图的理论指导,现有相图大多数为常温及高温下的,低温度下的相图较少。本实验室前期研究工作表明,一些水盐体系相图中,低温下一些复盐结晶区消失,相图结构变得简单,这有利于简化生产工艺,提高目标产品质量。例如,对于 Na+,K+∥Cl-,SO42-,NO3--H2O体系[1-3],298.15 K相图中存在的钠硝矾、钾芒硝的结晶区在258.15 K的相图中均消失[3]。对于K+,Na+,Mg2+∥Cl-,SO42--H2O体系[1]也有类似情况,随着温度降低,298.15 K相图中存在的钾镁矾、白钠镁矾、软钾镁矾、钾盐镁矾、钾芒硝等5种复盐结晶区缩小至消失。对于Li+,Na+∥Cl-,SO42--H2O体系[1,3],和298.15K时的相图相比,273.15 K的相图中Li2SO4·Na2SO4结晶区大大缩小,3Na2SO4·Li2SO4·12H2O结晶区消失,使相图得以简化。对于硫酸盐型富钾锂卤水体系,如果存在同样的规律,使得相关系简单化,将极其有利于卤水有效成分的分离。文献中含锂体系低温相平衡数据较少,本文拟进行Li+,Mg2+∥Cl-,SO42--H2O四元交互体系的相图研究。该体系273.15 K时的溶解度数据不全[1,5],且当时测定的实验条件不够完善[5],需要进一步研究,确定低温对Li2SO4·H2O,MgSO4· 7H2O,MgCl2·6H2O等结晶区变化的影响,本工作将有助于硫酸盐型富钾锂卤水体系低温相平衡的研究。
1 实验部分
1.1试剂和仪器
试剂:LiCl·H2O、Li2SO4·H2O、MgSO4·7H2O、MgCl2·6H2O,均是分析纯。仪器:低温搅拌反应浴(DHJF-4010型,控温精度为±0.2℃);754紫外-可见分光光度计;X射线衍射仪;体视显微镜等。
1.2实验过程
体系溶解度的测定采用等温溶解平衡法[4],实验装置见文献[4]。经实验测定,本研究所涉及的水盐体系平衡时间为36 h。根据文献中273.15 K下相关三元体系中两盐共饱点数据[1],加入第三种盐,计算配制合适的实验体系所需要的盐和水量;将配制的样品置于低温(恒温)搅拌反应浴中,连续搅拌36 h以上,静止沉降12 h后取液相分析,并鉴定固相;通过不断减少加入样品的水量,使体系的平衡液相组成逐渐靠近三盐共饱点,最终得出四元体系273.15 K相平衡关系。
1.3化学分析方法[6]
Cl-:硝酸银容量法;SO42-:浓度高时采用BaSO4重量法,浓度低时用硫酸钡比浊法[7];Mg2+:由于Li+大量存在对Mg2+的分析测定有明显干扰,采用文献[8]所述方法;Li+用差减法。平衡液相密度采用比重瓶法测定。固相采用体式显微镜、X射线晶体衍射法综合鉴定。
2 结果与讨论
四元体系Li+,Mg2+∥Cl-,SO42--H2O在273.15 K时的平衡液相组成和密度数据分别列于表1中,同时列出相应的Jänecke指数。
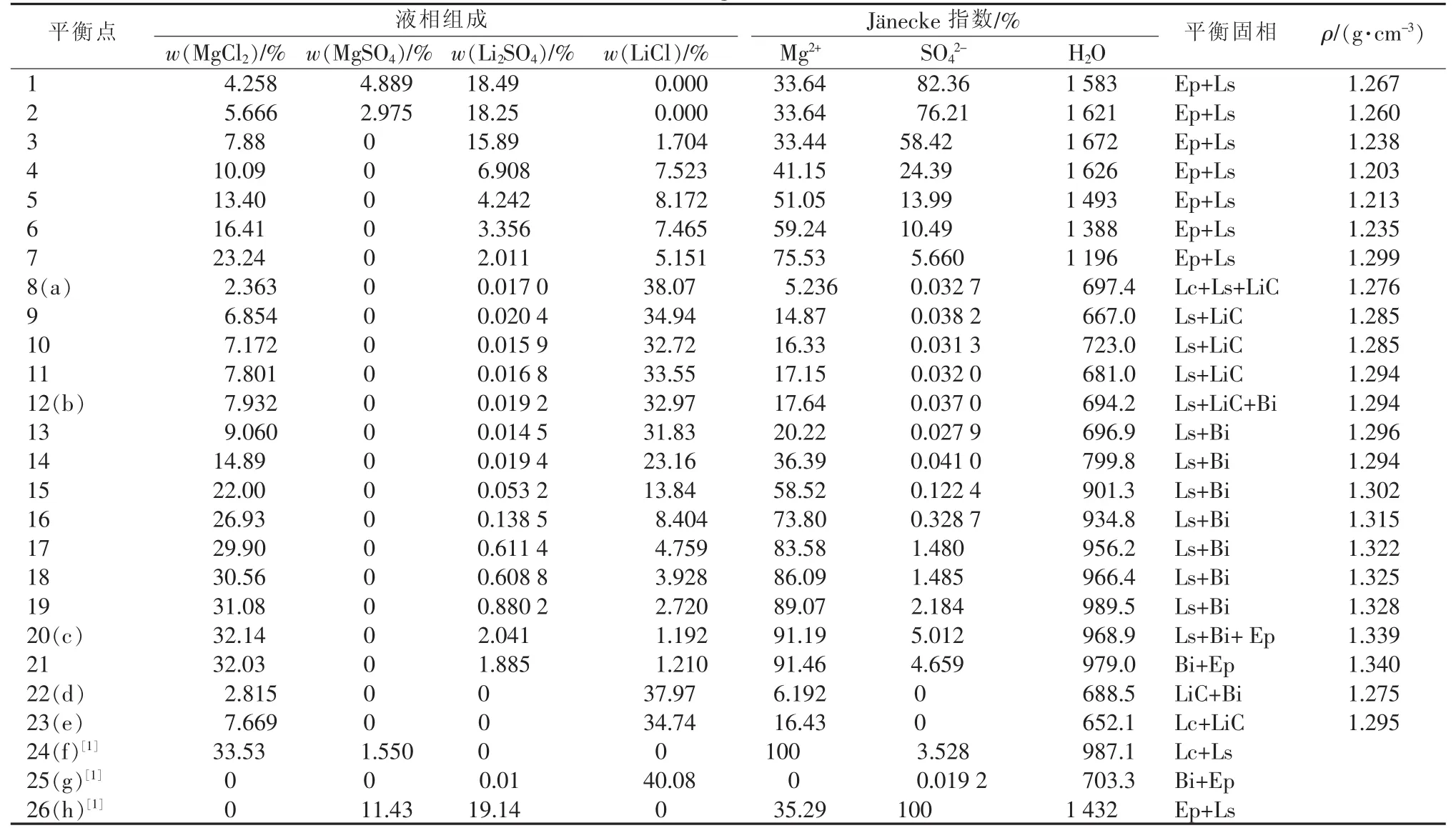
表1 273.15 K时四元体系Li+,Mg2+∥Cl-,SO42--H2O的溶解度及密度
由表1数据作出273.15 K下干盐相图,见图1。为了比较,根据文献[1,5]数据,同时作出298.15 K下的干盐相图。图1中LiCl·2H2O和LiCl·MgCl2· 7H2O结晶区很小,故作出其局部放大图见图2。
由表1、图1和图2可见,该四元体系273.15 K时等温相图有5个单盐结晶区,7条单变量线和3个共饱点。5个单盐结晶区分别对应平衡固相LiCl· MgCl2·7H2O(d-a-b-e)、MgCl2·6H2O(e-b-c-f)、Li2SO4· H2O(h-c-b-a-g)、MgSO4·7H2O(h-c-f)、LiCl·2H2O(g-a-d);3个共饱点为图1、2中的a、b、c点,平衡固相分别对应:LiCl·2H2O+Li2SO4·H2O+LiCl·MgCl2· 7H2O;Li2SO4·H2O+LiCl·MgCl2·7H2O+MgCl2·6H2O;Li2SO4·H2O+MgCl2·6H2O+MgSO4·7H2O。该体系273.15 K和298.15 K均没有硫酸盐型复盐,硫酸盐只有Li2SO4·H2O和MgSO4·7H2O。
图1中MgSO4·7H2O结晶区最大,溶解度最小。由图1和图2可见,该四元体系273.15 K与298.15 K相比,MgSO4·7H2O结晶区变大,Li2SO4·H2O和MgCl2·6H2O结晶区明显减小;LiCl·2H2O和LiCl· MgCl2·7H2O结晶区减小,但变化不明显。经分析相图变化原因为温度变化对各种盐类溶解度均有影响,但温度对LiCl溶解度影响较MgSO4小。

图1 273.15、298.15 K时Li+,Mg2+∥Cl-,SO42--H2O体系干盐相图
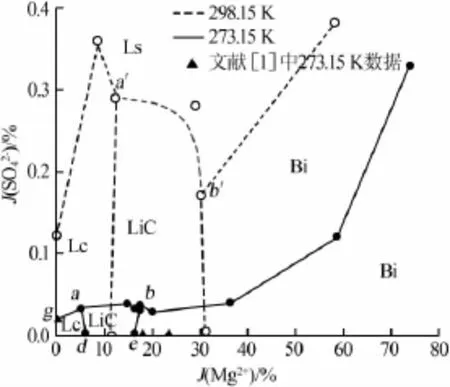
图2 273.15、298.15 K时局部放大图
根据表1及文献[1]数据,做出273.15 K时Li+,Mg2+∥Cl-,SO42--H2O体系水图及273.15、298.15 K时体系密度-组成比较图,见图3、4。

图3 273.15 K时Li+,Mg2+∥Cl-,SO42--H2O体系水图

图4 273.15、298.15 K时体系密度-组成图比较
由图4和图1分析,273.15 K的密度总体上随Mg2+含量增加而增加,但在结晶区 Li2SO4·H2O和MgSO4·7H2O的单变量线上,密度随硫酸根的含量减小而减小,当硫酸根的Jänecke指数低于24.39%时,密度随着Mg2+含量增加而增大。273.15 K时的密度普遍低于298.15 K。结合表1,序号4点水含量比较高,其密度最低,这是由于它所对应的平衡固相为Li2SO4·H2O+MgSO4·7H2O,SO42-含量已经减小很多,而含水量比较高使密度最低;序号21点水含量较低,其密度最高,这是由于其所对应的平衡固相为MgSO4·7H2O+MgCl2·6H2O,MgSO4·7H2O和 MgCl2· 6H2O溶解度均较高。
本实验体系中,随着温度降低,硫酸盐结晶区扩大,其他文献中也表明了这一点,对于Na+∥Cl-,SO42-,NO3--H2O体系[9],随着温度的降低Na2SO4·10H2O结晶区不断扩大。而其他文献表明,温度降低硫酸盐型复盐结晶区减小,并有可能消失[3]。但非硫酸盐型复盐的情况不同,温度降低,非硫酸盐型复盐结晶区减小不明显,并有可能几乎不变。如本文中273.15 K 与298.15 K的相图相比:LiCl·MgCl2·7H2O结晶区减小不明显;对于K+,Mg2+∥Cl-,SO42--H2O体系[10],273.15 K与298.15 K的相图相比较,复盐光卤石结晶区几乎没变化等。
3 结论
1)获得了273.15 K下四元交互体系Li+,Mg2+∥Cl-,SO42--H2O平衡溶解度和密度数据,绘制了273.15 K与 298.15 K下该体系相图及密度图。273.15 K等温相图有5个单盐结晶区Li2SO4·H2O,MgSO4·7H2O,LiCl·2H2O,MgCl2·6H2O,LiCl·MgCl2·7H2O;7条单变量线和3个共饱点。该体系没有硫酸盐型复盐。2)四元交互体系Li+,Mg2+∥Cl-,SO42--H2O 的273.15 K与298.15 K相图相比,273.15 K相图中MgSO4·7H2O结晶区变大,Li2SO4·H2O和 MgCl2· 6H2O结晶区明显减小;273.15 K时 LiCl·2H2O和LiCl·MgCl2·7H2O结晶区很小,与298.15 K的相比减小不明显。3)随着温度降低,硫酸盐结晶区扩大;硫酸盐型复盐结晶区减小,并有可能消失;非硫酸盐型复盐的情况不同,温度降低,结晶区减小不明显。
[1]Дод реДаκции А Д.Иедьшь,ЗКСВЕРИМЕНТАДЬНЬIХ ДАННЫХХОРАСТВОРИМОСТИМНОГОКОМПОНЕНТНЫХ ВОДНО-СОЛЕВЫХСИСТЕМ[M].ЛенингРадское:ЛенингРадское отделение ИЗДАТЕДЬ-СТВО,1975.
[2]李亚文,韩蔚田.Na+,K+∥Cl-,SO42-,NO3-—H2O五元体系的卤水—矿物平衡研究[J].科学通报,1998,43(19):2089-2091.
[3]廖玲,黄雪莉,朱巧丽.低温对水盐体系相平衡的影响及应用[J].无机盐工业,2015,47(8):19-22.
[4]张霞.新疆含硝酸盐卤水低温相平衡研究[D].新疆:新疆大学,2014.
[5]任开武,宋彭生.四元交互体系Li+,Mg2+∥Cl-,SO42--H2O 25℃相平衡及物化性质研究[J].无机化学学报,1994,10(1):69-73.
[6]中国科学院青海盐湖研究所分析室.卤水和盐的分析方法[M]. 2版.北京:科学出版社,1988.
[7]GB/T 5750.5—2006生活饮用水标准检验方法无机非金属指标[S].
[8]李红霞,姚燕,曾德文.水盐体系中有干扰Li+离子存在下测定Mg2+浓度的掩蔽法研究[J].盐湖研究,2012,20(2):24-30.
[9]张霞,黄雪莉.低温下Na+∥Cl-,SO42-,NO3-,H2O体系相平衡研究[J].化学通报,2015,78(4):337-341.
[10]牛自得,程芳琴.水盐体系相图及其应用[M].天津:天津大学出版社,2002:261-263.
联系方式:xuelih@163.com
Phase equilibria in the quatemary system of Li+,Mg2+∥Cl-,SO42--H2O at 273.15 K
Ren Xiaojing,Huang Xueli
(Key Laboratory of Xinjiang Coal Clean Conversion and Chemical Process,College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 830046,China)
The liquid-solid phase equilibria of the quaternary system Li+,Mg2+∥Cl-,SO42--H2O were investigated by isothermal method at 273.15 K.Solubilities and densities of the quaternary system were determined experimentally.Then the equilibrium phase diagrams were plotted.Results showed that there were five crystalline regions with one salt corresponding to Li2SO4· H2O,MgSO4·7H2O,LiCl·2H2O,LiCl·MgCl2·7H2O,and MgCl2·6H2O;seven univariate curves with two salts and three invariant points with three salts.Compared with the phase diagram of the quaternary system at 298.15 K,the crystalline region of MgSO4·7H2O became larger,the crystalline regions of Li2SO4·H2O and MgCl2·6H2O became smaller obviously;the crystalline regions of LiCl·2H2O and LiCl·MgCl2·7H2O were small,and little reduced.The effect of temperature on the crystalline region of sulfates was great.
lithium;solubility;phase equilibrium
O642.42
A
1006-4990(2016)07-0013-03
国家自然科学基金资助项目(21166022)。
2016-01-11
任效京(1991—),男,硕士研究生,研究方向为化工热力学。
黄雪莉

