脑桥外髓鞘溶解症合并中央型肺癌1例
杨洋陶涛黄骏李小刚
脑桥外髓鞘溶解症合并中央型肺癌1例
杨洋*陶涛*黄骏*李小刚*
脑桥外髓鞘溶解症中央型肺癌中枢神经系统脱髓鞘
脑桥外髓鞘溶解症(extrapontine myelinolysis,EPM)是一种少见的中枢神经系统脱髓鞘疾病,与脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)合称为渗透性髓鞘溶解综合征(osmotic demyelination syndrome,ODS)。ODS多发生于快速纠正缓慢形成的低钠血症的过程,可单独发生CPM或EPM,也可二者合并发生,目前其发生机制尚不完全明确。该病在临床中较为少见,重在预防,一旦发生无特效治疗。现将我院收治的1例患者报道如下。
1资料
患者,男,49岁,因“精神行为异常12 d”入院。15 d前患者无明显诱因出现恶心,呕吐,当地医院就诊建议行胃镜检查并予以口服药治疗,症状缓解。12 d前出现情绪兴奋,言语增多,活动增多,不能安静休息,当晚突发意识障碍,双眼凝视,牙关紧闭,口吐白沫,双上肢屈曲强直,持续约1~2 min,缓解后精神欠佳,吐词清晰,言语仍较多,当地医院就诊发现血钠:104 mmol/L,予以镇静补钠治疗。约30 h后血钠为:124.2 mmol/L,持续补钠治疗。病程中患者出现不言语,四肢活动减少。3 d前患者出现四肢肌张力增高,频繁强哭遂就诊于我院。入院查体:神清,不言语,双瞳等大形圆,光敏,眼球居中不活动,有强哭,持续性张口,不能正常闭合,咀嚼和吞咽运动减弱,不能伸舌,四肢不活动,肌张力明显增高,右侧肢体震颤,睡眠时消失,腱反射(++),双侧病理征(-)。入院辅查:血钠:119.6 mmol/ L,血氯:87.5 mmol/L;甲功全套:游离三碘甲状腺原氨酸1.53 pg/mL,游离甲状腺素:0.35 ng/dL,促甲状腺素:44.874 mIU/L。皮质醇8点、16点、24点分别为:5.05;5.85;1.88µg/dL。脑脊液检查:葡萄糖2.36 mmol/L,蛋白浓度:0.751 g/L,氯:107.0 mmol/L,细胞数:6×106/L;干扰素释放试验(-);胸片:考虑右肺上叶中央型肺癌伴右肺上叶肺不张;胸部增强CT:双侧胸腔少量积液,肺部恶性肿瘤;脑电图无明显异常。头颅MR示:双侧基底节区见对称性异常信号。考虑诊断:脑桥外髓鞘溶解症,中央型肺癌,甲状腺功能减低。嘱患者限水,予以抗感染,脱水,补钠,地塞米松抗炎,美多巴及替扎尼定缓解肌张力,左甲状腺素钠替代治疗。入院12 d后患者开始言语,声音低沉,吐词欠清,可按指令张口、伸舌、活动四肢,四肢肌张力较前减低,血清钠维持在正常水平。15 d后,患者精神明显好转,对答切题,可自行行走,四肢肌张力正常。入院19 d后,患者再次出现恶心、呕吐,血钠:114.0 mmol/L,继续缓慢补钠及相关对症支持治疗,5 d后血钠:123.0 mmol/L,患者神经系统症状明显缓解,拒绝进一步治疗自动出院。
该患者头颅MR表现如下:
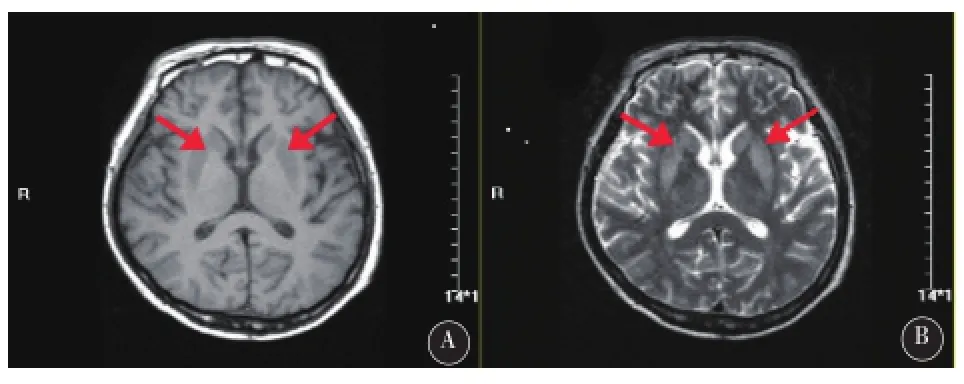
图1 患者入院时头颅MRI影像A.T1像双侧基底节区对称低信号影(红色箭头),B.T2像双侧基底节区对称高信号影(红色箭头)
2讨论
自1959年Adams等[1]首次命名了脑桥中央髓鞘溶解症(CPM)之后,不少学者认为髓鞘溶解同样可发生在有髓纤维比较集中的其他部位(如大脑白质,基底节,丘脑,下丘脑和小脑),于是提出了脑桥外髓鞘溶解症(EPM),二者合称为渗透性脱髓鞘综合征(ODS)[2]。EPM多发生于快速纠正缓慢形成的低钠血症的过程,尤其是伴有酒精中毒晚期、器官移植(尤其多见于肝移植)、长期营养不良、恶液质、糖尿病酮症酸中毒、肺部疾患、慢性肾功能衰竭、化疗、腺垂体功能减退及使用垂体后叶素治疗的患者[3-4]。
目前ODS发生机制尚不完全明确。比较缓慢形成的低钠血症是发生中枢髓鞘溶解的关键。可能的机制为:①低血钠促使水沿渗透压梯度进入脑细胞形成脑水肿,而脑细胞通过产生一些有机小分子如肌醇等进行适应性保护,从而抵消脑细胞内外的渗透压失衡。快速纠正血钠过程中,脑细胞外渗透压骤增,上述平衡被打破,引发脑细胞急速脱水、皱缩,少突胶质细胞对这种渗透压的改变更为敏感,因而导致髓鞘脱失、溶解[5]。②血管内皮细胞脱水、皱缩,导致BBB的破坏,使循环免疫复合物等进入中枢神经系统,介导或恶化少突胶质细胞损伤引起脱髓鞘。有学者认为,如果快速纠正快速形成的低钠血症,则不会发生中枢髓鞘溶解[6]。
典型的EPM病变部位主要累及基底节区、小脑白质、大脑皮质深部及附近白质,故其主要临床表现为精神行为异常及各种运动障碍,如谵妄、躁动、强哭强笑、运动不能缄默症和木僵症、帕金森综合症及肌张力障碍等。头颅磁共振(MRI)的典型表现是诊断EPM的关键,主要表现为双侧基底节区、下丘脑或小脑等部位出现对称性长T1长T2信号(如图1),而CPM主要表现为脑桥基底部特征性的“蝙蝠翅”或“三叉戟”样长T1长T2信号[7]。但影像学表现一般滞后临床表现10 d左右,故早期影像学正常又高度怀疑该疾病时应高度警惕该疾病的可能。
低钠血症常继发于消化系统疾病、肾脏疾病、垂体前叶病变、恶性肿瘤(尤其是肺部肿瘤)等,小细胞肺癌是最易合并抗利尿激素分泌异位综合征(SIADH)而致低钠血症的肺部恶性肿瘤[8],部分肺癌患者甚至以低钠血症为首发症状[9]。该患者既往无头部手术及腺垂体功能减退的病史,无明显诱因出现顽固性低钠血症,且补钠困难,考虑其低钠血症与中央型肺癌有关。基于患者病情及家属意见,原发的肺部肿瘤未进一步诊治。
EPM是一种较为罕见的疾病,该病重在预防,一旦发生无特效治疗方法。临床中遇到低钠血症时,应积极寻找病因,常规完善胸部CT检查、追问头部手术史,女性患者应特别警惕产后大出血及内分泌疾病史,积极治疗原发病;改善低钠血症,切忌快速纠正血钠,建议补钠每24 h不超过8mmol/L[10],严格限制液体量,酌情予以利尿剂辅助治疗并密切监测血钠值,防止髓鞘溶解的发生;纠正血钠过程中应严密观察患者神经系统临床表现及体征,一旦出现EPM或CPM典型临床表现,及时完善头颅MRI寻找相关证据,早期予以激素、高压氧、免疫球蛋白等治疗[11],可改善其预后。
[1]ADAMS RD,VICTOR M,MANCALL EL.Central pontine myelin⁃olysis:a hithertor undescribed disease occurring in alcoholic and malnourished patients[J].Arch Neurol Psychiatry,1959,81:154-156.
[2]GOCHT A,COLMANT HJ.Central pontine and extrapontine my⁃elinolysis:a report of 58 cases[J].Clin Neuropath,1987,6:262-270.
[3]JHA AA,BEHERA V,JAIRAM A,et al.Osmotic demyelination syndrome in a normonatremic patient of chronic kidney disease [J].
Indian Journal of Critical Care Medicine,2014,18(9):609-611.
[4]ZHUANG L,XU Z,LI Y,et al.Extrapontine myelinolysis associ⁃ated with pituitrin:case report and literature review[J].BMC Neu⁃rol,2014,14:189.
[5]张怀彬,张锦,崔志堂.脑桥外髓鞘溶解症的临床特点和MRI表现[J].齐齐哈尔医学院学报,2008,29(23):2860-2861.
[6]ALDER S,VERBALIS JG,WILLIAMS D.Effect of rapid correc⁃tion of hyponatremia on the blood-brain barrie of rats[J].Brain Res,1995,679(1):135-43.
[7]胡琦,张存泰,刘建,等.脑桥外髓鞘溶解症的影像学特征[J].华中科技大学学报(医学版),2013,42(2):203-206.
[8]申姗姗,张青立.以抗利尿激素分泌不当综合征表现的肺部疾病68例分析[J].现代医药卫生,2013,29(14):2168-2169.
[9]李东华,方向明,温庆泽.以低钠血症性脑病为首发症状的小细胞肺癌1例报告[J].吉林医学,2014,35(11):2495.
[10]PEARCE JM.Central pontine myelinolysis[J].Eur Neurol,2008,61(1):59-62.
[11]TAKASHI M,YOSHIHISA S,SEIKO T,et al.Mechnanisms and Therapy of Osmotic Demyelination[J].The American Journal of Medicine,2006,119(7A):s69-s73.
10.3969/j.issn.1002-0152.2016.05.015
*西南医科大学附属医院神经内科(泸州646000)
(E-mail:lixg5948@163.com)
R744(
2015-03-25)
A(责任编辑:李立)

