替加环素相关急性胰腺炎国外文献分析
周艳玲(广西玉林市第三人民医院药剂科,广西 玉林537000)
替加环素相关急性胰腺炎国外文献分析
周艳玲
(广西玉林市第三人民医院药剂科,广西 玉林537000)
【摘要】目的:调查替加环素引起急性胰腺炎的临床特征和发生原因及提供可能的治疗措施。方法:以“tigecycline”AND“pancreatitis”为关键词,检索PubMed数据库,收集2005-2013年国外报道的替加环素引起胰腺炎的文献,对患者的一般情况、用药情况、急性胰腺炎的临床表现、用药关联性、治疗与转归等进行分析。结果:共有9例患者因使用替加环素引起急性胰腺炎。其中5名男性和3名女性,1例性别不详。替加环素引起急性胰腺炎,症状出现与胰腺酶的升高均为用药7~ 14天,停药后,症状消除约在停药后5~ 6天,胰腺酶恢复约在停药后7~ 12天。替加环素的平均每日总剂量为107~ 150 mg。停药和对症治疗后,9例患者均好转。替加环素目前引起胰腺炎的机制尚不清楚,但由于替加环素与四环素的结构之间的相似性,替加环素可能有着与四环素引起急性胰腺炎发作的相同的机制。结论:在使用替加环素的治疗过程中,如临床表现疑似急性胰腺炎,应高度警惕腹部疼痛的症状和严密监测血清淀粉酶和脂肪酶浓度水平,一旦出现急性胰腺炎,应立即停药,给予禁食、体液复苏、止痛等对症治疗。
【关键词】替加环素;急性胰腺炎;四环素;不良反应
替加环素(原名 GAR-936,tygacyl)为甘氨酰环素类(glycyclines)抗生素的首个药物,其化学结构、药代动力学特征及不良反应均与四环素类药物相似。于2005年6月被美国食品药品监督管理局(FDA)批准上市,已批准用于复杂性皮肤软组织感染(cSSSI),复杂性腹腔内感染(CIAI)以及社区获得性肺炎。替加环素对革兰阳性菌、革兰阴性菌以及厌氧菌和非典型病原体具有广谱抗菌活性,替加环素主要由胆道排出体外,药物组织浓度高,该药不受β-内酰胺酶(包括超广谱β-内酰胺酶)、靶位修饰、外排泵或酶靶位改变(拓扑异构酶)等耐药机制的影响,总体来说,替加环素为抑菌剂[1-2]。目前多重耐药、广泛耐药、全耐药鲍曼不动杆菌已呈世界性流行,《中国鲍曼不动杆菌感染诊治与防控专家共识》推荐对于泛耐药鲍曼不动杆菌导致的院内获得性肺炎和机械通气相关性肺炎可选用替加环素或联合其他药物治疗[3-4]。近年资料表明,替加环素致急性胰腺炎有所增加,临床表现主要为恶心、呕吐、腹痛、腹胀以及血清脂肪酶和淀粉酶水平升高。替加环素致胰腺炎的机制尚不明确,但由于替加环素的结构与四环素结构相似,推测替加环素是通过与四环素致胰腺炎同样的机制引起急性胰腺炎。为更好地了解替加环素在使用中所致胰腺炎的情况,本文对2005-2013年替加环素引起急性胰腺炎的病例报告进行分析和探讨,旨在为临床安全合理应用替加环素提供参考。
1 资料与方法
以“tigecycline”AND“pancreatitis”为关键词,检索PubMed数据库,收集2005-2013年国外报道的替加环素引起急性胰腺炎的文献,剔除综述性文献及重复病例报告等,共检索到替加环素引起胰腺炎文献8篇,均为个案报道。对患者的一般情况、既往病史、急性胰腺炎的临床表现、用法用量与急性胰腺炎出现时间、恢复时间、联合用药、用药关联性评价、治疗与转归及发病机制等进行分析。
2 结果
从数据库中共检索到符合纳入标准的文献8篇,涉及病例9例。
2.1患者的性别及年龄分布
9例患者中,男性 5例(占 55.56%),女性 3例(占33.33%),不详1例(占11.11%),年龄最大69岁,最小9岁。
2.2原患疾病
骨、关节感染(急性、慢性感染)5例,肺部感染2例,糖尿病神经病变1例,感染性休克1例,手术切口感染(腹股沟)1例,败血症1例。
2.3患者既往病史
9例患者既往均无胰腺炎或腹腔感染病史、入院查体腹膜刺激征检查均为阴性,临床无腹痛、恶心呕吐等相关症状,同时均没有引起急性胰腺炎的常见因素,如内镜逆行胆胰管造影(ERCP)、肝胆结石、高三酰甘油血症和高钙血症、创伤、酗酒或全胃肠外营养的使用。
2.4替加环素引起急性胰腺炎患者临床表现
9例患者主要的临床表现为严重的腹痛,伴随恶心和呕吐等现象,血清脂肪酶、淀粉酶均不同程度升高,具体见表1。
2.5患者联合用药及平均日剂量与用药时间及治疗时间
具体见表2。
2.6替加环素相关急性胰腺炎的联合用药、关联性评价、治疗与转归
9例患者的联合用药,均为正常抗感染联合用药方案,大部分药物为停用替加环素后,仍然继续使用,未发现有加重胰腺炎证据,但其中丙泊酚是唯一可能会引起胰腺炎的联合用药方案。在某些情况下,丙泊酚可增加三酰甘油的水平,从而引起急性胰腺炎,但该例患者没有出现血脂异常并且之前用过2次丙泊酚均没有出现胰腺炎[13]。使用替加环素引起急性胰腺炎的患者,经过对症治疗,临床症状及血清脂肪酶、淀粉酶恢复正常后,没有出现严重的后遗症。9例患者均没有再次使用替加环素,所引起的急性胰腺炎均没有再次复发,所以9例替加环素相关急性胰腺炎均很可能为替加环素引起。9例患者停用替加环素后,给予禁食、体液复苏、止痛等对症治疗后,症状均逐渐好转,血清脂肪酶和淀粉酶水平恢复正常。
2.7替加环素相关急性胰腺炎的发病机制
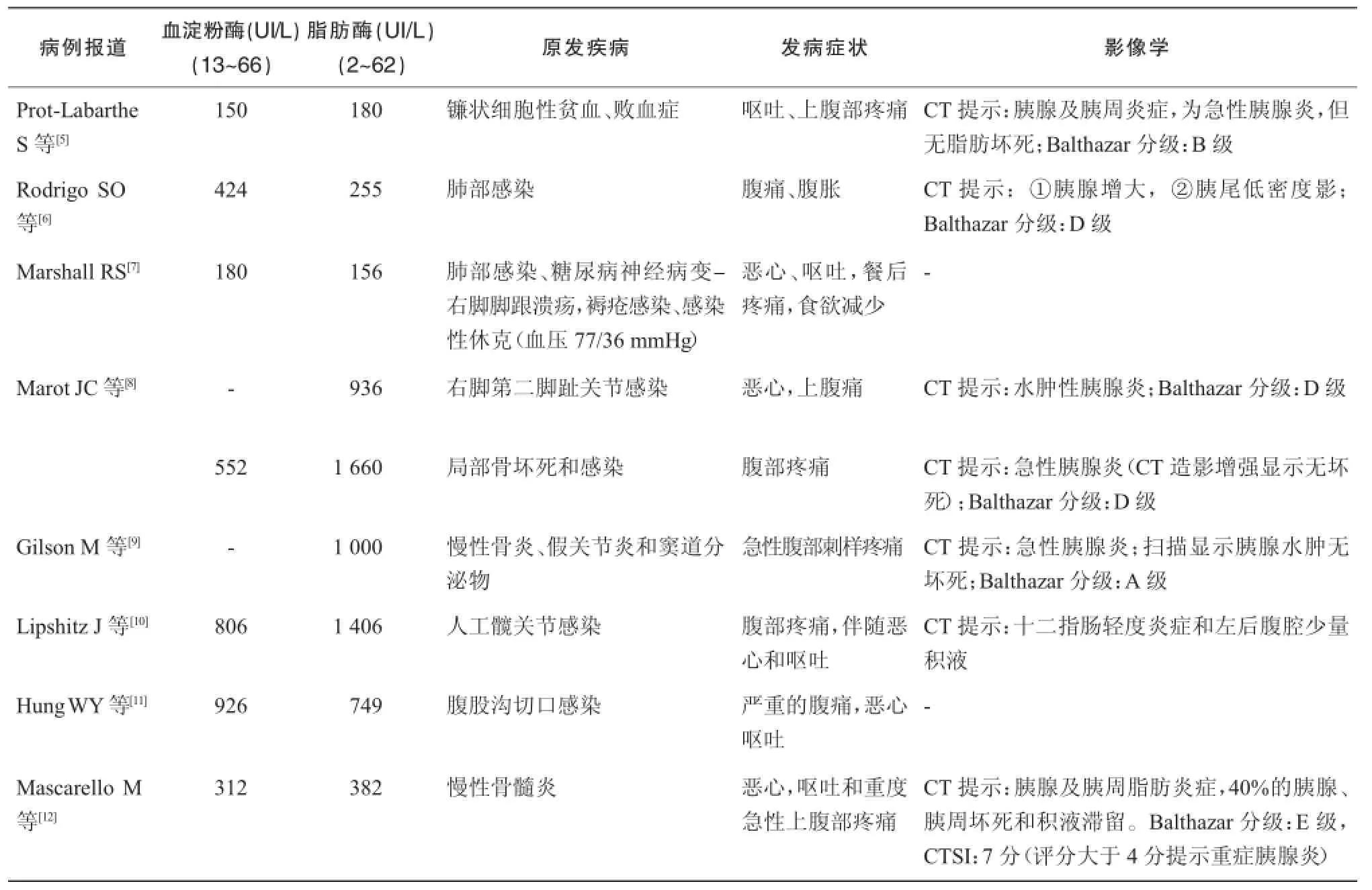
表1 替加环素引起胰腺炎患者血淀粉酶、脂肪酶检验结果,影像学检查及临床表现

表2 患者联合用药及平均日剂量与用药时间及治疗时间的分布
引起急性胰腺炎有很多原因,包括胆道、呼吸道疾病(40%)和酒精的暴露史(35%),其他原因包括(特发性胰腺炎、后经内镜逆行胰胆管造影术,创伤,药物,感染,高钙血症,高三酰甘油血症,肿瘤和自身免疫性疾病)。其中,某些药物(四环素、大环内酯类抗生素,异烟肼,甲硝唑,丙泊酚,血管紧张素转换酶抑制剂)引起急性胰腺炎的发生率达到0.1% ~ 2.0%[14]。四环素类药物包括四环素、米诺环素、土霉素、多西环素已经有引起急性胰腺炎的报道。四环素类药物能引起药源性胰腺炎[15-16],虽然四环素类药物引起急性胰腺炎机制尚未清楚,但至少已经有3种不同机制的假设,包括:四环素类相似的机制引起急性胰腺炎。目前,四环素类药物的发病机制主要有以下3种不同的理论:①产生有毒代谢物;②高三酰甘油血症;③胆汁浓度高。
Steinberg WM[17]认为一种不明有毒代谢产物的不断产生可能为四环素类药物诱发胰腺炎的原因。Elmore MF等[18]认为四环素类药物通过抑制肝细胞内30S核糖体亚基在mRNA中的翻译转录抑制蛋白的合成,促进有缺陷的蛋白质不断积累造成堵塞,进而抑制三酰甘油的释放,诱导的高三酰甘油血症引起胰腺炎。Gilson M等[9]认为胆汁中高浓度的四环素类药物可能为导致胰腺炎发生的原因。米诺环素在人体内药代动力学特征的研究证明,给予200 mg负荷剂量,100 mg维持剂量的米诺环素中观察到,胆汁中米诺环素的药物浓度为血液中的10倍以上[19]。Gotfried MH等[20]对替加环素的药代动力学研究显示,患者单次给予替加环素100 mg后,胆汁中的药物浓度与在血清中浓度之比为39∶1。
3 讨论
替加环素刚刚被批准上市时,胰腺炎并没有被药品说明书列入替加环素的药品不良反应,同时基于未曾公开的数据,替加环素诱导的胰腺炎的发病率约为0.1% ~ 1%[9]。然而这项数据与替加环素的Ⅳ期临床试验结果是不一致的。在替加环素Ⅲ期临床试验阶段中发现,替加环素引起淀粉酶升高的发生率为3.1%,腹痛症状的发生率为4.5%,均高于对照组1.1%与2.5%[21-24]。尽管目前所公开的替加环素引起急性胰腺炎或引起血清淀粉酶和脂肪酶异常的个案例数缺乏大样本数据的支持,但制造商(惠氏公司)于2009年7月更新产品的说明书,将急性胰腺炎作为上市后的不良事件之一[25]。
急性胰腺炎病程中淀粉酶及脂肪酶水平一般均升高。血清脂肪酶升高持续时间可能稍长于淀粉酶。由表1的数据可知,9例患者的淀粉酶的浓度范围超过正常值3~ 14倍,脂肪酶的浓度范围超过正常值3~ 26倍。但淀粉酶和(或)脂肪酶升高的程度与急性胰腺炎的轻重并不直接相关。由表1的数据可知:Lipshitz J等[10]报道的病人血清脂肪酶和淀粉酶分别高达806 UI/L,1 406 UI/L,患者症状腹部疼痛伴恶心呕吐,CT仅提示:十二指肠轻度炎症和左后腹腔少量积液。Mascarello M等[12]报道的病人血清脂肪酶和淀粉酶为 382 UI/L,312 UI/L,患者症状为急性重度上腹部疼痛伴随恶心、呕吐,CT提示:重症胰腺炎(胰腺及胰周脂肪炎症,40%胰腺、胰周坏死和积液滞留。Balthazar分级:E级,CTSI:7分)。同时由表1和表2可知,9例患者的血清脂肪酶和淀粉酶恢复正常的时间和淀粉酶及脂肪酶升高的水平也并不直接相关。
四环素诱导急性胰腺炎与潜在的肝脏疾病是密切相关的[26-27],对于过往没有肝脏疾病病史并使用四环素抗感染治疗的病人,引起急性胰腺炎的时间多数需要达到4个月到2年的时间,平均每日总剂量为1 083~ 1 353 mg/d。然而,对那些存在严重肝功能障碍的患者,四环素引起急性胰腺炎所需时间仅为8~ 17天,平均每日总剂量为1 500~ 4 000 mg/d[28],患者症状及淀粉酶、脂肪酶恢复的时间约为13~ 21天。由表2的数据可知,9例替加环素引起急性胰腺炎的患者均没有肝脏疾病病史,大部分患者开始使用替加环素约7~ 14天引起急性胰腺炎,逐渐出现腹痛、恶心、呕吐等症状,平均每日总剂量为107~150 mg,患者的腹痛、恶心、呕吐等临床症状在停用替加环素5~ 6天消除,血清脂肪酶、淀粉酶恢复的时间为7~ 12天。本文9例患者替加环素的用法用量均符合说明书规定,说明替加环素引起急性胰腺炎与用药情况无显著关联。对于无肝脏疾病史的患者,替加环素引起的胰腺炎比四环素诱导更加快速,同时,停药后,患者症状的消除及血清脂肪酶、淀粉酶恢复的时间比四环素要快。
4 结语
本文回顾性分析了2005-2013年PubMed数据库关于替加环素引起急性胰腺炎的病例报道,目前,替加环素引起的急性胰腺炎是一种罕见的现象,替加环素引起的急性胰腺炎的9例病例报道中,患者平均发病时间大约为10天。现阶段没有更灵敏的鉴别方法来预防替加环素的这种不良反应。制造商(惠氏公司)不推荐血清淀粉酶和脂肪酶的常规监测。然而,如果在替加环素治疗过程中,临床表现疑似急性胰腺炎,应高度警惕腹部疼痛的症状和严密监测血清淀粉酶和脂肪酶浓度水平。由于替加环素的这种潜在严重不良反应,应进一步强调临床需要谨慎使用替加环素,因为与有着同样疗效的抗感染药物相比,替加环素引起的相关不良事件有着显著的高风险因素。未来应更多地关注替加环素导致急性胰腺炎的机制及替加环素引起急性胰腺炎是否与四环素类药物存在交叉反应的可能。
参考文献:
[1]Seputiene V,Povilonis J,Armalyte J,et al.Tigecycline-how powerful is it in the fight against antibiotic-resistant bacteria?[J]. Medicina(Kaunas),2010,46(4):240-248.
[2]Wyeth Pharmaceutics.Tygacil○R(Tigecycline)for Injection for Intravenous Use(Prescribing Information)[S].Philadelphia,PA:Wyeth Pharmaceuticals Inc.,2010-11-09.
[3]陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J].中华医学杂志,2012,92(2):76-85.
[4] Sopirala MM,Mangino JE,Gebreyes WA,et al.Synergy testing by Etest,microdilution checkerboard,and time-kill methods for pan-drug-resistant Acinetobacter baumannii[J].Antimicrob A-gents Chemother,2010,54(11):4678-4683.
[5]Prot-Labarthe S,Youdaren R,Benkerrou M,et al.Pediatric acute pancreatitis related to tigecycline[J].Pediatr Infect Dis J,2010,29(9):890-891.
[6] Rodrigo SO,Dulce EL,Alejandra PP,et al.Pancreatitis probablemente inducida por tigeciclina:reporte de un caso[J].Med Int Mex,2010,26(3):273-275.
[7] Marshall RS.Tigecycline-induced pancreatitis[J].Hospital Pharmacy,2009,44(3):239-241.
[8] Marot JC,Jonckheere S,Munyentwali H,et al.Tigecycline-induced acute pancreatitis:about two cases and review of the literature[J].Acta Clin Belg,2012,67(3):229-232.
[9] Gilson M,Moachon L,Jeanne L,et al.Acute pancreatitis related to tigecycline:case report and review of the literature[J].Scand J Infect Dis,2008,40(8):681-683.
[10] Lipshitz J,Kruh J,Cheung P,et al.Tigecycline induced pancreatitis[J].J Clin Gastroenterol,2009,43(1):93.
[11] Hung WY,Kogelman L,Volpe G,et al.Tigecycline-induced acute pancreatitis:case report and literature review[J].Int J Antimicrob Agents,2009,34(5):486-489.
[12]Mascarello M,Papa G,Arnez ZM,et al.Acute necrotizing pancreatitis related to tigecycline[J].J Antimicrob Chemother,2012,67(5):1296-1297.
[13]Jawaid Q,Presti ME,Neuschwander-Tetri BA,et al.Acute pancreatitis after single-dose exposure to propofol:a case report and review of literature[J].Dig Dis Sci,2002,47(3):614-618.
[14] Balani AR,Grendell JH.Drug induced pancreatitis[J].Drug Saf,2008,31(10):823-837.
[15] 炎晏妮,吴胜林,王赘春,等.药源性胰腺炎[J].药物流行病学杂志,2011,20(10):541-543.
[16] 隋忠国.四环素合理用药指导[J].中国医刊,2011,46(6):88-90.
[17] Steinberg WM.Acute drug and toxin induced pancreatitis[J]. Hosp Pract,1985,20(5):95-102.
[18]Elmore MF,Rogge JD.Tetracycline induced pancreatitis[J].Gastroenterology,1981,81(6):1134-1136.
[19] MacDonald H,Kelly RG,Allen ES,et al.Pharmaeokinetic studies on minocycline in man[J].Clin Pharmacol Ther,1973,14 (5):852-861.
[20] Gotfried MH,Rodvold KA,Cwik M,et al.An open label clinical evaluation of tigecycline(TGC)concentrations in selected tissues and fluids[J].Clin Pharmacol Ther,2005,77(S2):98.
[21] Florescu I,Beuran M,Dimov R,et al.Efficacy and safety of tigecycline compared with vancomycin or linezolid for treatment of serious infections with methicillin-resistant Staphylococcus aureus or vancomycin resistant enterococci:a Phase 3,multicenter,double-blind,randomized study[J].J Antimicrob Chemother,2008,62(S1):i17-i28.
[22] Vasilev K,Reshedko G,Orasan R,et al.A Phase 3,open-label,non-comparative study of tigecycline in the treatment of patients with selected serious infections due to resistant Gramnegative organisms including Enterobacter species,Acinetobacter baumannii and Klebsiella pneumoniae[J].J Antimicrob Chemother,2008,62(S1):i29-i40.
[23] Bergallo C,Jasovich A,Teglia O,et al.Safety and efficacy of intravenous tigecycline in treatment of community-acquired pneumonia:results froma double blind randomized Phase 3 comparison study with levofloxacin[J].Diagn Microbiol Infect Dis,2009,63(1):52-61.
[24] Kadoyama K,Sakaeda T,Tamon A,et al.Adverse event profile of tigecycline:data mining of the public version of the U. S.Food and Drug Administration adverse event reporting system[J].BiolPharm Bull,2012,35(6):967-970.
[25] Wyeth Pharmaceutics.Tygacil(package insert)[S].Philadelphia,PA:Wyeth Pharmaceutics,2009-07-11.
[26]Nicolau DP,Mengedoht DE,Kline JJ.Tetracycline induced pancreatitis[J].Am J Gastroenterol,1991,86(11):1669-1671.
[27] Elmore MF,Rogge JD.Tetracycline induced pancreatitis[J]. Gastroenterology,1981,81(6):1134-1136.
[28] Kunelis CT,Peters JL,Edmondson HA.Fatty liver of pregnancy and its relationship to tetracycline therapy[J].Am J Med,1965,38:359-377.
doi:10.3969/j.issn.1672-5433.2016.02.012
收稿日期:(2015-11-02)
作者简介:周艳玲,女,主管药师。研究方向:临床药学。E-mail:89570353@qq.com
Acute Pancreatitis Related to Tigecycline:Analysis of Foreign Literatures
Zhou Yanling(Department of Pharmacy,The Third People’s Hospital,Guangxi Yulin 537000,China)
ABSTRACTObjective:To investigate the clinical features,cause and possible measure for treatment of acute pancreatitis related to tigecycline.Methods:Using”Tigecycline”and“Pancreatitis”as keywords,PubMed data were retrieved and the case repots of pancreatitis induced by tigecycline published in foreign literatures from 2005 to 2013 were collected,in which the baseline characteristics,drug use,clinical features,medication association,therapy and prognosis of patients with acute pancretitis were analyzed.Results:A total of 9 cases of acute pancreatitis induced by tigecycline were collected.The patients included 5 male,3 female and one of unknown gender.Both acute pancreatic enzyme elevation and symptoms occurred 7~14 d after administration with tigecycline,while the of symptoms disappeared about 5~6 d,and acute pancreatic enzyme recovered to the normal level 7~ 12 d,after withdrawal of the drug.The average total daily dose of tigecycline was 107~150 mg. After withdrawal of the drug and symptomatic treatment,all the 9 cases were improved.The mechanism of acute pancreatitis caused by tigecyclins remains unclear.However,because of the structural similarity between tigecycline and tetracycline,the mechanism of tigecycline in induction of acute pancreatitis might be similar to that of tetracycline.Conclusion:In the course of treatment with tigecline,if the clinical manifestation of suspected acute pancreatitis appeared,care should be taken to the symptom of abdominal pain,and the serum amylase and lipase levels should be monitored strictly.Once acute pancreatitis occurs,the drug should be withdrawn immediately,and symptomatic treatment,such as fasting,fluid resuscitation and acesodyne,should be adopted.
KEY WORDSTigecycline;Acute Pancreatitis;Tetracycline;Adverse Reaction

