脑胶质瘤细胞体外促进人骨髓间充质干细胞肿瘤相关基因表达☆
朱汝森许成杰兰柳波陈兴贵梁远生尹延庆
脑胶质瘤细胞体外促进人骨髓间充质干细胞肿瘤相关基因表达☆
朱汝森*许成杰*兰柳波△陈兴贵**梁远生*尹延庆*
目的观察与人脑胶质瘤细胞共培养后的人骨髓间充质干细胞(human bone marrow-derived mesenchymal stromal cells,hMSCs)中肿瘤相关基因表达的变化,初步评估hMSCs在人脑胶质瘤环境中的生物安全性在致瘤性方面的风险。方法 将hMSCs与人脑胶质瘤细胞U251于体外共同培养5d后,通过肿瘤基因芯片、实时定量RT-PCR及Western-blot实验检测hMSCs中肿瘤相关基因表达水平的变化。结果 基因芯片结果显示,与单独培养的hMSCs对比,与人脑胶质瘤细胞U251共同培养后的hMSCs中存在SPINT2、TK1、STC1、MMP1、CCND1、SORT1、SEPT6、CDC20、SHB、CDK5、RELA、XRCC4、KIT、CTPS、CAPNS1及ETV6等16个肿瘤相关基因的表达明显上调(3倍以上),而无一基因表达下调;实时定量RT-PCR结果显示癌基因KIT、CAPNS1、TK1、MMP1、CCND1、CDC20、RELA以及STC1在共培养组hMSCs中呈表达上调;Western-blot结果显示癌基因KIT、MMP1、CCND1以及RELA的蛋白水平在共培养组hMSCs中呈表达上调。结论 hMSCs在脑胶质瘤细胞的影响下可出现部分癌基因的高度表达,提示了对于hMSCs应用于对脑胶质瘤进行基因治疗的生物安全性在致瘤性方面的风险需引起关注及深入研究。
骨髓间充质干细胞 脑胶质瘤 基因治疗 致瘤性 肿瘤相关基因 基因表达
研究[1,2]表明,在体外培养的过程中,人类的骨髓间充质干细胞(bone marrow-derived mesenchymal stromal cells,MSCs)是稳定的,而鼠的 MSCs却容易发生恶性转变并可以在体内形成肿瘤。然而,关于MSCs在肿瘤环境中的稳定性问题并未得到足够重视,尚未明确。有研究报道,从人脂肪细胞获得的成体干细胞与鳞状细胞癌细胞共同培养可导致这些干细胞中的基因表达及蛋白质合成发生明显的变化,从而引起了对其在肿瘤环境中是否存在致瘤性的担忧[3]。脑胶质瘤环境中的生长因子以及炎性细胞因子等的构成与正常的骨髓环境存在很大的区别。关于hMSCs在人脑胶质瘤环境中会否被诱导发生恶性转变而获得致瘤性的问题并未得到大家的重视和关注。由于致瘤性可归因于基因特征的改变,本实验通过将hMSCs与人脑胶质瘤细胞U251进行共同培养,于体外模拟hMSCs在人脑胶质瘤的环境中生存,然后检测经过共培养后的hMSCs中肿瘤相关基因表达的改变,为评估hMSCs在人脑胶质瘤细胞的影响下其生物安全性在致瘤性方面的风险提供部分的参考依据。
1 材料与方法
1.1 hMSCs的分离和培养 在前期的研究中我们已经建立了获取 hMSCs的成熟方法[4]。以健康成人志愿者为取材对象,抽取骨髓组织,于Percoll细胞分离液(瑞典Pharmacia)中通过密度梯度离心获取中间的有核细胞层,接种于培养瓶中,加入含10%胎牛血清的DMEM/F12培养基(美国HYCLONE),置于37℃、5%CO2培养箱中培养,48h后换液,去除未贴壁的细胞,每周换液两次,待细胞密度达70%~80%,以0.25%胰酶+0.02% EDTA消化传代。取P2~P10代细胞作后续实验。
1.2 hMSCs表面标志抗原的检测收集hMSCs,以PBS洗涤1次,分别加入单克隆抗体CD34、CD45(美 国 Becton Dickinson),CD73(瑞 典PharMingen)及CD 166(美国Ansell),工作浓度1 ∶100,4℃孵育30 min后,再用PBS洗涤3次,加入荧光素标记的二抗,工作浓度1∶100,4℃孵育30 min,PBS洗涤2次,流式细胞仪检测。用PBS代替一抗作空白对照。
1.3 hMSCs与人脑胶质瘤细胞U251的共同培养通过transwell系统(美国 Corning)进行细胞的共同培养,其中实验组为:将数量为2×104的hMSCs种植于transwell小室,膜的孔径为0.4μm,将同样数量的U251细胞种植于transwell的底层,培养基为含10%胎牛血清的DMEM/F12培养基,置于37℃、5%CO2培养箱中培养,每隔48 h换液一次,培养5d后收集hMSCs进行后续实验。在对照组中,除了transwell的底层不接种U251细胞外,处理条件和方式与实验组完全一致。每次共培养实验设置3个平行组,并且重复3次实验,最后将每次实验获取的实验组和对照组hMSCs的总RNA和总蛋白分别混合后进行后续的检测实验。
1.4基因芯片检测 hMSCs肿瘤相关基因表达水平的变化 通过 Trizol试剂(美国 Invitrogen life technologies)提取细胞的总 RNA。cRNA标记与合成、芯片杂交与洗涤、化学发光检测按Oligo GEArray Human Cancer Microarray OHS-802(美国SuperArray Bioscience)试剂盒说明进行。图像采集和数据分析:用台式扫描仪扫描X胶片,图片保存为灰度的、TIFF格式的电子版文档。用GEArray表达分析配套软件(GEArray Expression Analysis Suite)进行完整的芯片数据分析。每个点的灰度值跟芯片所有看家基因的平均灰度值进行标准化处理,得出每个点的标准值,再与对照组相应点的标准值进行比较,高度表达标准为3倍以上。
1.5实时定量RT-PCR检测验证基因芯片结果针对β-actin、KIT、CAPNS1、TK1、MMP1、CCND1、CDC20、RELA及STC1基因的PCR引物序列如下:β-actin(5'-CCTGTACGCCAACACAGTGC-3',5’-ATACTCCTGCTTGCTGATCC-3’,211bp);KIT(5'-TTGTCATCAGCCACCATCCT-3',5'-CCAGTCCATACCTCCCTCTCTT-3',121bp);CAPNS1(5'-GATAGCGACACCACAGGCAAG-3',5'-GAGATTTGAAGGCACGGAACAT-3',283bp);TK1(5'-GTGATTCTCGGGCCGATGTT-3',5'-GCGAGTGTCTTTGGCATACTTGAT-3',114bp);MMP-1(5'-CGCACAAATCCCTTCTACC-3',5'-CTCTGTCGGCAAATTCGTAAG-3',103bp);CCND1(5'-TGGCGTTTCCCAGAGTCATC -3',5'-CCACCTCCCTTCAACACTTCC-3',195bp);CDC20(5'-TCCCTGGCAGTCCAATGTCC-3',5'-GGAGACCAGAGGATGGAGCAC-3',135bp);RELA(5'-CGCTGCATCCACAGTTTCCA-3',5'-GCACAGCATT CAGGTCGTAGTCC-3',151bp);STC1(5'-GAAGCCTGCTGGAATGTGAT-3',5'-GGGATGTGCGTTTGATGTG-3',237bp)。使用RNA样品进行cDNA合成。制备用于绘制标准曲线的梯度稀释DNA模板。使用Sybergreen(美国Molecular Probes)作为检测系统,在Rotor-Gene 3000 PCR仪(澳大利亚 Corbett Research)进行Real-time PCR反应。结果与计算:各样品的目的基因和管家基因Beta-acin分别进行Real-time PCR反应。根据绘制的梯度稀释DNA标准曲线,各样品目的基因和管家基因的浓度结果直接由机器生成。每个样品的目的基因浓度除以其看家基因的浓度,即为此样品此基因的校正后的相对含量。最后,各基因在经共培养处理hMSCs中的相对含量与对照组的hMSCs中的相对含量进行比较。数据分析使用Rotor-Gene 6.0软件和Microsoft Excel 2007进行。
1.6 Western blot检测hMSCs中部分癌基因蛋白表达水平的变化 分别提取共培养处理组和对照组的hMSCs细胞总蛋白,BCA法测浓度后,8%的聚丙烯酰胺凝胶按每孔等量30 μg上样,积层胶80 V,分离胶120 V电泳,100V转膜90 min,转好的PVDF膜以5%BSA封闭1 h,鼠抗人CCND1抗体(中国 北京中山公司),鼠抗人KIT、鼠抗人MMP、鼠抗人RELA抗体(中国Boster公司)浓度均为1∶3000,及兔抗人Beta-actin抗体(中国上海康成生物工程公司)浓度为1∶1 0000,行一抗孵育,4℃振荡过夜。TBST洗涤后滴加Anti-mouse二抗、Anti-rabbit二抗(中国 上海康成生物工程公司)浓度为1∶5 000,37℃孵育1 h,显影成像。Imagej分析软件扫描特异性条带净灰度值后Beta-actin作为内参,计算两者比值分析蛋白相对表达量。
2 结果
2.1 hMSCs表面标志抗原的检测结果 所获取的hMSCs通过流式细胞术检测的结果显示,CD34 和CD45为阴性,CD73和CD166为阳性,符合骨髓间充质干细胞的特征(图1)。
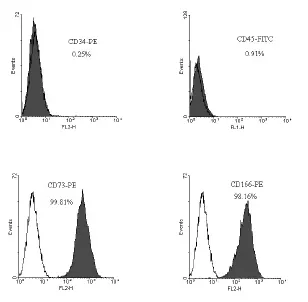
图1人骨髓间充质干细胞表面标志抗原的检测结果。流式细胞术检测结果显示,获取的hMSCs呈CD34、CD45阴性,CD73、CD166阳性
2.2基因芯片检测结果为检测与脑胶质瘤细胞U251共同培养处理后的hMSCs中肿瘤相关基因表达情况,对其进行基因芯片检测;在相同条件下单独培养的hMSCs也进行同样的检测以作为对照。图2所示为进行芯片杂交后的扫描结果。对芯片结果分析后显示,在寡核苷酸芯片Oligo GEArray Human Cancer Microarray OHS-802所覆盖的440个肿瘤相关基因当中,与单独培养的hMSCs相比较,在与人脑胶质瘤细胞U251共同培养5d后的 hMSCs中存在SPINT2、TK1、STC1、MMP1、CCND1、SORT1、SEPT6、CDC20、SHB、CDK5、RELA、XRCC4、KIT、CTPS、CAPNS1及ETV6的表达明显上调(3倍以上),而无一基因表达下调(表1)。表达上调范围为3.22~17.26倍,其中基因KIT、CAPNS1、TK1、MMP1、CCND1、CDC20、RELA以及 STC1为一些重要的癌基因,其过度表达已被证实可以促进肿瘤的发生。

图2人骨髓间充质干细胞与脑胶质瘤细胞U251共培养后的肿瘤相关基因芯片检测结果。人骨髓间充质干细胞与脑胶质瘤细胞U251共培养5 d后,以涵盖440个肿瘤相关基因的基因芯片Oligo GEArray Human Cancer Microarray OHS-802进行检测。以单独培养的人骨髓间充质干细胞作为对照组
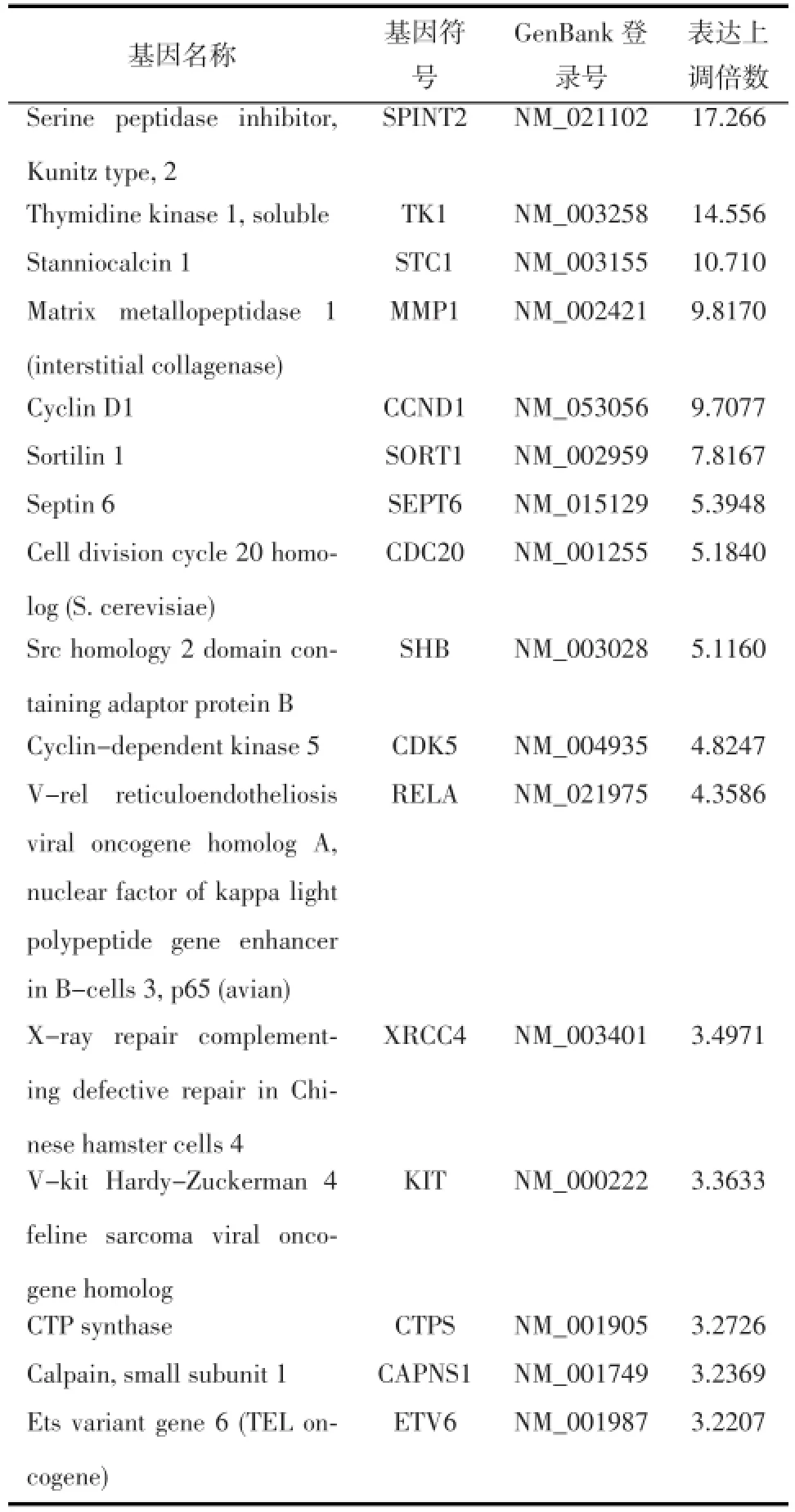
表1人骨髓间充质干细胞与脑胶质瘤细胞U251共培养5 d后呈高度表达的肿瘤相关基因
2.3实时定量RT-PCR检测结果 为验证基因芯片的检测结果,对芯片检测结果显示的在与脑胶质瘤细胞U251共培养5d后的hMSCs中呈高度表达的重要癌基因KIT、CAPNS1、TK1、MMP1、CCND1、CDC20、RELA以及 STC1的mRNA水平进一步进行实时定量RT-PCR检测。结果显示,与单独培养的hMSCs相比较,所检测的癌基因在与脑胶质瘤细胞U251共培养后的hMSCs中均呈高度表达,与基因芯片检测的结果相符,其表达上调倍数分别是:KIT 4.84;CAPNS1 4.21;TK1 2.69;MMP1 8.34;CCND1 8.94;CDC20 4.88;RELA 5.17;STC1 1.82。
2.4 Western blot检测结果 对与脑胶质瘤细胞U251共培养5d后的hMSCs中重要癌基因KIT、MMP1、CCND1以及RELA的蛋白表达水平进行Western blot检测,结果显示与对照组比较这些癌基因的蛋白表达水平均呈上调,其表达上调倍数为:KIT 3.46;MMP1(40 kD)2.00;MMP1(50 kD)1.97;CCND1 1.98;RELA 1.31(图3)。
3 讨论
人骨髓间充质干细胞(human bone marrow-derived mesenchymal stromal cells,hMSCs)可作为对脑胶质瘤进行基因治疗的理想基因载体。当hMSCs作为基因载体对脑胶质瘤进行基因治疗时,会离开原本生存的骨髓环境而进入到脑胶质瘤的环境中,在脑胶质瘤细胞的影响下hMSCs会发生什么样的改变,目前尚未明确。我们关注的是hMSCs在人脑胶质瘤环境中的生物安全性在致瘤性方面的风险。在本研究中,我们首次发现了与人脑胶质瘤细胞共同培养后,hMSCs出现了在肿瘤相关基因表达方面发生了有意义的改变。
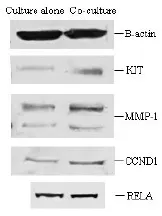
图3人骨髓间充质干细胞与脑胶质瘤细胞U251共培养后的Western blot检结果显示,与对照组比较人骨髓间充质干细胞与脑胶质瘤细胞U251共培养5d后,癌基因KIT、MMP1、CCND1及RELA的蛋白表达水平均呈上调,其表达上调倍数为:KIT 3.46;MMP1(40KD)2.00;MMP1(50KD)1.97;CCND1 1.98;RELA 1.31
我们在健康成人志愿者身上获取骨髓组织,通过体外分离培养获得hMSCs,并通过流式细胞术检测了其特征性的细胞表面标志抗原。在前期的研究中,我们也验证了所获取的hMSCs具有向神经干细胞以及神经系细胞的定向分化能力[4]。在本研究中,我们将hMSCs与人脑胶质瘤细胞U251进行共同培养,在体外模拟hMSCs在脑胶质瘤环境下的生存,然后通过基因芯片检测hMSCs中肿瘤相关基因表达情况的变化。芯片结果发现与同条件下单独培养的hMSCs对比,与胶质瘤细胞共同培养5d后的hMSCs中存在16个肿瘤相关基因呈明显表达上调,而无一基因表达下调。这些表达明显上调的基因中包括了一些重要的癌基因,分别是 KIT、CAPNS1、TK1、MMP1、CCND1、CDC20、RELA和STC1等基因,这些基因分别属于促进细胞增殖的基因、促进细胞侵袭和转移的基因,以及一些具有致癌性的信号传导通路的成员等。为验证基因芯片的结果,我们对这8个重要基因进行了实时定量RT-PCR检测,结果显示均呈表达上调,与基因芯片检测结果一致。并且对其中的KIT、MMP1、CCND1和RELA基因的蛋白水平进行Western bot检测,结果显示这四个基因的蛋白表达水平均上调,进一步验证的基因芯片的结果。
恶性细胞的一个重要生物学特征是不受限制的增殖。KIT、CAPNS1和 TK1基因被发现在与胶质瘤细胞共同培养的hMSCs中呈表达上调。而这些基因的过度表达已被证实和促进细胞增殖和导致肿瘤的发生有密切关系。KIT是作为干细胞因子(stem cell factor,SCF)的受体,它们的结合作用在调节细胞生存和增殖方面是必须的;KIT表达的上调被证实与细胞的恶性转变密切相关[5]。Capns 1是Calpain的一个调节单元,而Calpain的作用是抗细胞凋亡,Calpain的缺失会导致哺乳动物细胞中受自噬性溶酶体诱导的细胞凋亡的敏感性增强;在细胞发生恶性转变的过程中Calpain系统表达增强,这在恶性细胞的转移和血管生成方面起着重要的作用[6]。Thymidine kinase 1(TK1)是DNA前体合成的一个关键酶,因而是细胞增殖依赖的核苷激酶;作为细胞周期的标志物,TK1可在不同肿瘤类型患者的血清中被检测到;TK1的血清水平高低可反映肿瘤的进展和反映肿瘤化疗药物的治疗效果[7]。
侵袭和转移是恶性细胞另一个重要的生物学特征。hMSCs具有对脑胶质瘤细胞的趋向性,在中枢神经系统中表现出良好的迁移能力。然而,一旦该细胞获得不受控制的增殖能力,这种迁移能力将会增加其恶性潜能,这是我们需要关注的方面。基质金属蛋白酶(Matrix metalloproteinases,MMPs)一直以来都被证实与细胞的侵袭转移密切相关;MMPs几乎在所有的人类肿瘤细胞中都呈表达上调,其表达通常与肿瘤的不良预后相关[8]。MMP1被发现在与胶质瘤细胞共同培养的hMSCs中呈表达上调,提示了在脑胶质瘤细胞的影响下hMSCs的侵袭和转移能力可能得到了增强。
细胞周期和肿瘤的关系是明显的:细胞周期机制调控着细胞的增殖,而肿瘤是一种细胞出现不正常增殖的疾病。CCND1和CDC20基因与细胞周期密切相关,我们发现这两个基因在与胶质瘤细胞共同培养的 hMSCs中均呈表达上调。CCND1作为转录的共同调节子在细胞周期调控中起着重要作用,CCND1的过度表达与肿瘤的发生和发展密切相关[9]。CDC20对于有丝分裂的完成是必须的,因此是细胞周期调节的一个关键因素[10]。CDC20的过度表达的现象被发现于多种肿瘤细胞中,CDC20的过度表达导致了纺锤体组装检查点机制的破坏,从而导致了肿瘤细胞染色体的不稳定性[11,12]。
NF-kappaB信号传导通路控制着一系列涉及到免疫炎性反应、细胞周期进展、细胞凋亡抑制以及细胞粘附方面的基因,可促进肿瘤的发生和肿瘤的进展[13]。RelA作为NF-kappaB信号传导通路的p65单元,我们发现其在与胶质瘤细胞共同培养的hMSCs中呈表达上调。RelA有着多种作用,但其通常与导致细胞拒绝程序性死亡相关[14]。RelA的异常激活与人类的很多肿瘤相关,其抗凋亡的作用被发现导致了很多肿瘤治疗手段的效果降低[15]。
参与细胞表面受体信号传导通路的STC1基因被发现在与脑胶质瘤细胞共同培养的hMSCs中呈表达上调。有越来越多的证据表明,STC1基因表达模式的改变在人类癌症中起着重要的作用,增强的STC1基因表达在很多的人类癌症中被发现[16]。
综上所述,在本研究中我们首次发现了在与脑胶质瘤细胞共同培养的hMSCs中存在一系列的肿瘤相关基因的表达明显上调,其生物学意义仍不清楚,需要进一步研究。由于这些表达上调的基因中包括了一些重要的癌基因,它们的过度表达已被证实可以促进肿瘤的发生,因此在hMSCs对脑胶质瘤进行基因治疗的临床应用前,需要对该细胞在脑胶质瘤环境中的生物安全性问题进行深入研究。
[1]BERNARDO ME,ZAFF ARONI N,NOVARA F,et al.Human bone marrow derived mesenchymal stem cells do not undergo transformation after long-term in vitro culture and do not exhibit telomere maintenance mechanisms[J].Cancer Res,2007,67 (19):9142-9149.
[2]ZHOU YF,BOSCH-MARCE M,OKUYAMA H,et al.Spontaneous transformation of cultured mouse bone marrow-derived stromal cells[J].Cancer Res,2006,66(22):10849-10854.
[3]KOELLENSPERGER E,GRAMLEY F,PREISNER F,et al.Alterations of gene expression and protein synthesis in co-cultured adipose tissue-derived stem cells and squamous cell-carcinoma cells:consequences for clinical applications[J].Stem Cell Res Ther,2014,5(3):65.
[4]ZHU R,XU R,JIANG X,et al.Expression profile ofcancer-related genes in human adult bone marrow-derived neural stemlike cells highlights the need for tumorigenicity study[J].J Neurosci Res,2007,85(14):3064-3070.
[5]NIKOLAOU M,VALAVANIS C,ARAVANTINOS G,et al.Kit expression in male germ cell tumors[J].Anticancer Res,2007,27(3B):1685-1688.
[6]DEMARCHI F,SCHNEIDER C.The calpain system as a modulator of stress/damage response[J].Cell Cycle,2007,6(2):136-138.
[7]O'NEILL KL,BUCKWALTER MR,MURRAY BK.Thymidine kinase:diagnostic and prognostic potential[J].Expert Rev Mol Diagn,2001,1(4):428-433.
[8]EGEBLAD M,WERB Z.New functions for the matrix metalloproteinases in cancer progression[J].Nat Rev Cancer,2002,2 (3):161-174.
[9]ALAO JP.The regulation of cyclin D1 degradation:roles in cancer development and the potential for therapeutic invention[J]. Mol Cancer,2007,6:24.
[10]YU H.Cdc20:a WD40 activator for a cell cycle degradation machine[J].Mol Cell,2007,27(1):3-16.
[11]YUAN B,XU Y,WOO JH,et al.Increased expression of mitotic checkpoint genes in breast cancer cells with chromosomal instability[J].Clin Cancer Res,2006,12(2):405-410.
[12]MONDAL G,SENGUPTA S,PANDA CK,et al.Overexpression of Cdc20 leads to impairment of the spindle assembly checkpoint and aneuploidization in oral cancer[J].Carcinogenesis,2007,28(1):81-92.
[13]OKAMOTO T,SANDA T,ASAMITSU K.NF-kappa B signaling and carcinogenesis[J].Curr Pharm,2007,13(5):447-462.
[14]KUCHARCZAK J,SIMMONS MJ,FAN Y,et al.To be,or not to be:NF-kappaB is the answer--role of Rel/NF-kappaB in the regulation of apoptosis[J].Oncogene,2003,22(56):8961-8982.
[15]BALDWIN AS.Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB[J].J Clin Invest,2001,107(3):241-246.
[16]CHANG AC,JELLINEK DA,REDDEL RR.Mammalian stanniocalcinsandcancer[J].EndocrRelatCancer,2003,10(3):359-373.
(责任编辑:甘章平)
Glioma cells promote expression of cancer-related genes in human bone marrow-derived mesenchymal stromal cells in vitro.
ZHU Rusen,XU Chengjie,LAN Liubo,CHEN Xinggui,LIANG Yuansheng,YIN Yanqing.Neurosurgery Department,Affiliated Hospital of Guangdong Medical College,53 Renmin avenue,Zhanjiang 524001,China.Tel:0759-2369962.
Objective We investigated the expression profile of cancer related genes in hMSCs co-cultured with U251 glioma cells,to evaluate the risk of malignant transformation of hMSCs in glioma environment.Methods hMSCs were co-cultured with U251 glioma cells for 5 days and the expression profile of cancer-related genes were investigated by using microarray assay,followed by Real-time quantitative RT-PCR and Western blot.Results Of the 440 cancer-related genes covered by Oligo GEArray Human Cancer Microarray OHS-802,SPINT2,TK1,STC1,MMP1,CCND1,SORT1,SEPT6,CDC20,SHB,CDK5,RELA,XRCC4,KIT,CTPS,CAPNS1 and ETV6 were significantly upregulated(>3-fold)whereas none was downregulated in hMSCs co-cultured with U251 glioma cells.The upregulation of oncogenes KIT,CAPNS1,TK1,MMP1,CCND1,CDC20,RELA and STC1 in co-cultured hMSCs were confirmed by Real-time quan-titative RT-PCR.The upregulation of protein expression of oncogenes KIT,MMP1,CCND1 and RELA were detected by Western blot.Conclusion The present study demonstrates that co-culture of hMSCs with human glioma cells leads to upregulation of some important oncogenes in hMSCs,indicating the tumorigenic potential of hMSCs in glioma environment.
Bone marrow-derived mesenchymal stromal cellsGliomaGene therapyTumorigenicity Cancer-related genes Gene expression
R739
A
10.3969/j.issn.1002-0152.2016.01.010
☆广东省自然科学基金(编号:2015A030313525);广东省医学科研基金(编号:B2009197);湛江市科技攻关计划项目(编号:2014B01087);广东医学院博士科研基金
*广东医学院附属医院神经外科(湛江524001)
△广东医学院生物化学与分子生物学研究所
**广东医学院附属医院肿瘤中心
(E-mail:rusenzhu@126.com)
2015-12-20)

