胃腺癌中PYGOPUS2、基质金属蛋白酶-2和-14的表达及对预后的判断价值
刘爱东 马 征 熊艳杰 刘 扬
(华北理工大学附属医院病理科,河北 唐山 063000)
胃腺癌中PYGOPUS2、基质金属蛋白酶-2和-14的表达及对预后的判断价值
刘爱东马征1熊艳杰刘扬1
(华北理工大学附属医院病理科,河北唐山063000)
〔摘要〕目的检测胃腺癌中PYGOPUS2、基质金属蛋白酶(MMP)-2和MMP-14的表达特点,关注三者在不同临床特征中的表达差别及相关性。方法以95例胃腺癌作为观察组,以70例正常胃粘膜组织作为对照组,采用免疫组织化学方法检测二组中PYGOPUS2、MMP-2和MMP-14的表达,探讨三者在不同临床病理特征中表达的差别及相关性。结果观察组中PYGOPUS2、MMP-2和MMP-14表达的阳性率明显高于对照组,观察组中PYGOPUS2、MMP-2和MMP-14表达的阳性率均与肿瘤体积、分化程度、淋巴结转移、脉管浸润和Ki67的表达密切相关。相关性分析显示观察组中PYGOPUS2和MMP-2、PYGOPUS2和MMP-14的表达均呈正相关性。生存分析显示PYGOPUS2、MMP-2和MMP-14的表达均与预后相关。结论胃腺癌组织中PYGOPUS2、MMP-2和MMP-14高表达,对肿瘤的进展有促进作用,术后联合检测PYGOPUS2、MMP-2和MMP-14的表达对判断胃腺癌的预后有一定关系。
〔关键词〕胃腺癌;PYGOPUS2、基质金属蛋白酶-2;基质金属蛋白酶-14;免疫组织化学技术
转移是肿瘤进展的重要生物学行为,在转移过程中细胞外基质的降解有重要意义。基质金属蛋白酶家族(MMPs)与肿瘤进展有关,当肿瘤恶变及处于进展期时,MMPs大量分泌,可以有效地降解细胞外基质,使肿瘤转移的屏障打开,细胞的迁移程度增加〔1〕。MMP-2和MMP-14是家族中的重要成员,对细胞外基质和基底膜的溶解作用强〔2〕。有研究显示MMP-14高表达时可以高效地促进MMP-2分泌,加速基底膜的溶解作用〔3〕。PYGOPUS2蛋白是Wnt信号通路下游的新功能蛋白,主要通过结合游离β-catenin,使其大量聚集在胞质,并转移到细胞核内,引起靶点的异常活化〔4〕。近年研究认为PYGOPUS2参与细胞的癌变和转移过程〔5〕。本文关注胃腺癌中PYGOPUS2、MMP-2和MMP-14的表达及临床意义。
1材料和方法
1.1临床资料收集2006年1~12月行胃腺癌根治手术后留取的蜡块组织及患者的临床资料作为观察组,纳入均符合世界卫生组织(WHO)关于胃腺癌的诊断标准。共观察95例,男54例,女41例,年龄42~79〔平均(60.6±5.9)〕岁;高分化39例,中分化35例,低分化21例,患者手术前均未进行放、化疗。同时选取距肿瘤边缘大于3 cm的切端正常的胃黏膜组织70例作为对照组,男39例,女31例,年龄43~76〔平均(59.5±5.8)〕岁。二组一般资料的比较差异无统计学意义(P>0.05)。
1.2免疫组化检测PYGOPUS2、MMP-2和MMP-14蛋白的表达PYGOPUS2蛋白的浓缩液购自美国Santa Cruz公司,MMP-2和MMP-14蛋白的浓缩液均购自北京中杉金桥生物技术有限公司。抗体按不同比例进行预实验,选择最佳配比浓度进行正式实验。采用免疫组织化学技术SP法检测组织中PYGOPUS2、MMP-2和MMP-14蛋白的表达,严格实验步骤,并均由同一技师操作,减少误差,严格质控。
1.3PYGOPUS2、MMP-2和MMP-14蛋白检测结果的判定方法PYGOPUS2以细胞核中呈现棕黄色颗粒为阳性细胞,MMP-2和MMP-14以出细胞质中出现均匀棕黄色颗粒为阳性细胞,每张切片选择10个400倍的高倍视野,取其平均值作为样本最终的阳性表达率,以阳性细胞≥25%定为阳性,以阳性细胞<25%定为阴性。计算组间阳性率的差别。
1.4统计学方法采用SAS6.12软件行χ2检验、相关分析和生存分析。
2结果
2.1两组PYGOPUS2、MMP-2和MMP-14蛋白表达阳性率的比较PYGOPUS2、MMP-2和MMP-14在观察组中表达的阳性率〔83.16%(79/95)、75.79%(72/95)、63.16%(60/95)〕明显高于对照组〔24.29%(17/70)、21.43%(15/70)、15.71%(11/70)、χ2=57.412 4、47.782 1、37.006 2,均P<0.000 1〕,见图1。
2.2观察组中不同临床特征患者PYGOPUS2、MMP-2和MMP-14蛋白表达阳性率的比较观察组中PYGOPUS2、MMP-2和MMP-14的表达在不同肿瘤直径、分化程度、淋巴结转移、脉管浸润、Ki67表达中的差异显著(P<0.05)。见表1。
2.3观察组中PYGOPUS2、MMP-2和MMP-14表达的相关性PYGOPUS2和MMP-2(r=0.45,P=0.019 0)、PYGOPUS2和MMP-14的表达(r=0.47,P=0.027 8)均呈正相关性。
2.4观察组中PYGOPUS2、MMP-2和MMP-14表达的生存分析本组患者随访时间为7~60个月,平均24.9个月。经检验,胃腺癌中PYGOPUS2、MMP-2和MMP-14的表达均与患者预后相关(均P<0.05),即PYGOPUS2、MMP-2和MMP-14高表达患者的预后差。
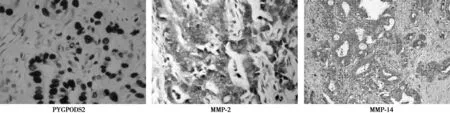
图1 胃腺癌PYGPODS2、MMP-2、MMP-14蛋白阳性表达(DAB,×400)
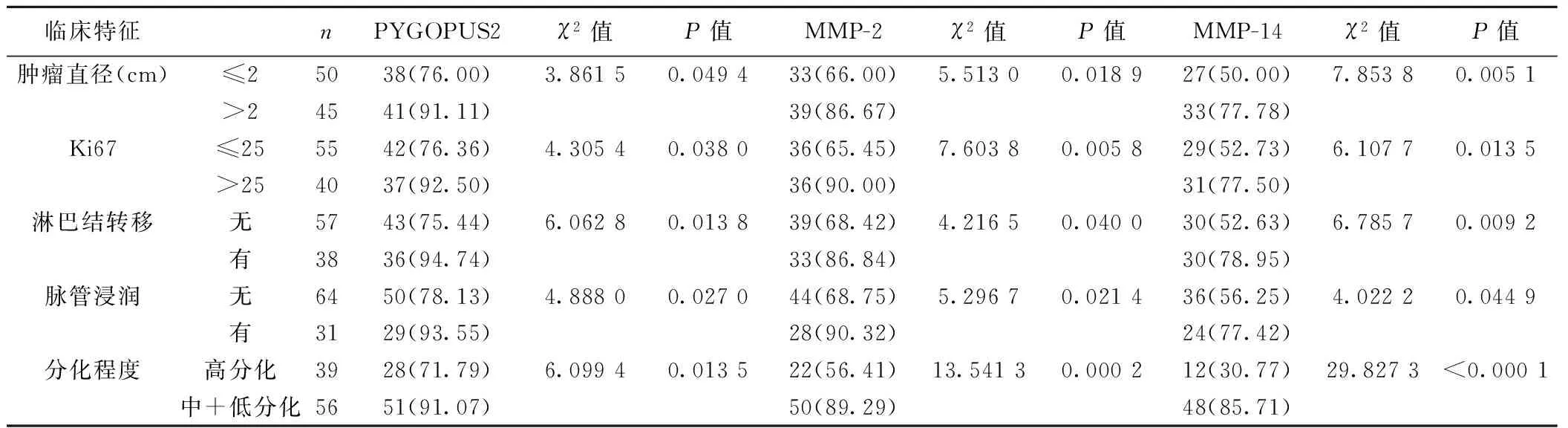
临床特征nPYGOPUS2χ2值P值MMP-2χ2值P值MMP-14χ2值P值肿瘤直径(cm)≤25038(76.00)3.86150.049433(66.00)5.51300.018927(50.00)7.85380.0051>24541(91.11)39(86.67)33(77.78)Ki67≤255542(76.36)4.30540.038036(65.45)7.60380.005829(52.73)6.10770.0135>254037(92.50)36(90.00)31(77.50)淋巴结转移无5743(75.44)6.06280.013839(68.42)4.21650.040030(52.63)6.78570.0092有3836(94.74)33(86.84)30(78.95)脉管浸润无6450(78.13)4.88800.027044(68.75)5.29670.021436(56.25)4.02220.0449有3129(93.55)28(90.32)24(77.42)分化程度高分化3928(71.79)6.09940.013522(56.41)13.54130.000212(30.77)29.8273<0.0001中+低分化5651(91.07)50(89.29)48(85.71)
3讨论
胃腺癌临床常见,病变发展过程中多种基因和蛋白表达异常。PYGOPUS是在果蝇实验中发现的蛋白,认为是β-catenin蛋白下游的一个新功能蛋白,其突变导致了WNT信号的缺失。它有二个同源蛋白,分别是PYGOPUS1和PYGOPUS2〔6〕。PYGOPUS2基因位于1号染色体q21.3位置,其编码的产物为含有233个氨基酸的蛋白,PYGOPUS2蛋白包括两个独特的保守区域,分别是N端同源序列和C端PHD锌指结构〔7〕。进一步研究发现PYGOPUS2对组织发育、转录激活及染色质重塑均有重要作用〔8,9〕。MMP-2和MMP-14是MMPS家族的重要成员,MMP-2也称明胶酶A,可以与MMP-9协同参与作用〔10〕。MMP-14在发挥作用时能够在细胞的表面对MMP-2等MMPs家族的成员进行有效的活化,同时又反作用于MMP-14,使MMP-14表达明显增高,形成环式循环,进而促进肿瘤离开原发部位发生转移〔11,12〕。也有研究显示MMP-14可以使肿瘤细胞间质产生较多的MMPs原酶,不仅使其直接发挥作用,还可以诱导家族的其他成员发挥级联反应〔13,14〕,起到降解细胞外基质的作用。
本实验结果提示PYGOPUS2、MMP-2和MMP-14蛋白对肿瘤的发生和发展有明显的促进作用,即3种蛋白起到的作用与癌基因类似。陈玉英等〔15〕通过观察PYGOPUS2对大鼠胶质瘤C6细胞增殖的影响,认为PYGOPUS2通过增高cyclinD1水平,促进细胞从G1期进入S期,加速细胞增殖、抑制细胞分化进而有效的引起细胞的增殖过程而促进肿瘤的进展。MMP-2和MMP-14促肿瘤的过程可能与对细胞外基质的影响有关,主要表现为对肿瘤的进展的促进作用。本实验结果提示PYGOPUS2/MMP-2/MMP-14可能具有正向协同效应,即三者共同促进胃腺癌的进展。PYGOPUS2调节细胞外基质可以有效证明PYGOPUS2对肿瘤进展的作用。PYGOPUS2大量分泌时,可以加速细胞外基质溶解作用,主要可以表现为以MMP-2和MMP-14为主的蛋白酶的分泌。此时细胞外基质和基底膜的溶解作用增强,肿瘤细胞易于通过屏障形成播散,进而引起肿瘤浸润性生长和转移。Yang等〔16〕通过观察肺癌中Desmoplakin的作用,发现Desmoplakin 在通过Wnt/β-catenin信号传导途径作用过程中对MMP-14有一定的影响,分析认为Wnt/β-catenin可能与MMPs有一定相关性。因此本实验观察到的PYGOPUS2/MMP-2/MMP-14的相关性可能均是通过Wnt/β-catenin的作用调节的。但是由于PYGOPUS2与MMPs的协同作用并非PYGOPUS2作用的经典通路,因此三者协同作用机制尚有待更多基础实验研究及进一步验证〔17,18〕。本实验结果显示PYGOPUS2、MMP-2和MMP-14均与肿瘤的体积、淋巴结转移、脉管浸润、分化程度和Ki67的表达密切相关,由于以上因素均与肿瘤的预后相关,因此检测三者可能对判断预后有重要价值,而生存分析直接证实了此结论,即三者高表达的胃腺癌患者预后差。
总之,胃腺癌组织中PYGOPUS2、MMP-2和MMP-14高表达,对肿瘤的进展有促进作用,术后联合检测PYGOPUS2、MMP-2和MMP-14的表达对判断胃腺癌的预后有一定价值。
4参考文献
1刘爱东,李青,要瑞莉,等.MMP-14 mRNA在胃腺癌中的表达及意义〔J〕.重庆医学,2012;41(5):439-41.
2Hernandez-Perez M,El-hajahmad M,Massaro J,etal.Expression of gelatinases (MMP-2,MMP-9) and gelatinase activator (MMP-14) in actinic keratosis and in in situ and invasive squamous cell carcinoma〔J〕.Am J Dermatopathol,2012;34(7):723-8.
3Mohammad MA,Zeeneldin AA,Abd Elmageed ZY,etal.Clinical relevance of cyclooxygenase-2 and matrix metalloproteinases (MMP-2 and MT1-MMP) in human breast cancer tissue〔J〕.Mol Cell Biochem,2012;366(1-2):269-75.
4De D,Chen A,Wu Z,etal.Overexpression of Pygopus2 protects HeLa cells from vinblastine-induced apoptosis〔J〕.Biol Chem,2009;390(2):157-65.
5Andrews PG,Lake BB,Popadiuk C,etal.Requirement of Pygopus 2 in breast cancer〔J〕.Int J Oncol,2007;30(2):357-63.
6王海东,杜天明,项永生,等.Wnt信号调控因子Pygo2在人脑胶质瘤中的表达及意义〔J〕.中华神经外科疾病研究杂志,2010;9(6):513-5.
7袁圆阳,骆启聪,李超,等.Pygo2转基因小鼠模型的建立及表型的初步分析〔J〕.厦门大学学报(自然科学版),2010;49(2):266-9.
8Pez F,Lopez A,Kim M,etal.Wnt signaling and hepatocarcinogenesis:molecular targets for the development of innovative anticancer drugs〔J〕.J Hepatol,2013;59(5):1107-17.
9Popadiuk CM,Xiong J,Wells MG,etal.Antisense suppression of pygopus2 results in growth arrest of epithelial ovarian cancer〔J〕.Clin Cancer Res,2006;12(7 Pt 1):2216-23.
10Xu YY,Bao YY,Zhou SH,etal.Effect on the expression of MMP-2,MT-MMP in laryngeal carcinoma Hep-2 cell line by antisense glucose transporter-1〔J〕.Arch Med Res,2012;43(5):395-401.
11Bodnar M,Szylberg L,Kazmierczak W,etal.Differentiated expression of membrane type metalloproteinases (MMP-14,MMP-15) and pro-MMP2 in laryngeal squamous cell carcinoma.A novel mechanism〔J〕.J Oral Pathol Med,2013;42(3):267-74.
12McLaughlin SL,Ice RJ,Rajulapati A,etal.NEDD9 depletion leads to MMP14 inactivation by TIMP2 and prevents invasion and metastasis〔J〕.Mol Cancer Res,2014;12(1):69-81.
13Chen TY,Li YC,Liu YF,etal.Role of MMP14 gene polymorphisms in susceptibility and pathological development to hepatocellular carcinoma〔J〕.Ann Surg Oncol,2011;18(8):2348-56.
14Faber A,Sauter A,Hoedt S,etal.Alteration of MMP-2 and -14 expression by imatinib in HPV-positive and -negative squamous cell carcinoma〔J〕.Oncol Rep,2012;28(1):172-8.
15陈玉英,王海东,王占祥,等.Pygo2过表达促进大鼠胶质瘤C6细胞增殖〔J〕.中国医科大学学报,2012;41(5):413-5.
16Yang L,Chen Y,Cui T,etal.Desmoplakin acts as a tumor suppressor by inhibition of the Wnt/β-catenin signaling pathway in human lung cancer〔J〕.Carcinogenesis,2012;33(10):1863-70.
17黄才权,陈玉英,王占祥.Pygopus蛋白及其与肿瘤相关研究进展〔J〕.实用肿瘤杂志,2011;26(6):651-3.
18王海东,陈玉英,王占祥,等.Pygo2在脑胶质瘤组织和细胞的表达及临床意义〔J〕.中国肿瘤临床,2011;38(2):75-7.
〔2014-12-08修回〕
(编辑赵慧玲/曹梦园)
〔中图分类号〕R735.1
〔文献标识码〕A
〔文章编号〕1005-9202(2016)12-2955-03;
doi:10.3969/j.issn.1005-9202.2016.12.062
1唐山职业技术学院医学校区
第一作者:刘爱东(1975-),男,硕士,副主任医师,副教授,主要从事肿瘤分子病理学研究。

