术前18F-2-脱氧葡萄糖PET/CT测定肿瘤负荷在胰腺癌预后判断中的价值
吴忠仕 简志祥 余 敏 刘海鸣 林 叶
(南方医科大学,广东 广州 510000)
术前18F-2-脱氧葡萄糖PET/CT测定肿瘤负荷在胰腺癌预后判断中的价值
吴忠仕1简志祥1余敏1刘海鸣1林叶1
(南方医科大学,广东广州510000)
〔摘要〕目的探讨术前经18F-2-脱氧葡萄糖(FDG)正电子发射X线断层摄像术(PET)CT测定的肿瘤负荷在胰腺癌预后判断中的价值。方法回顾性分析52例经手术切除且术后病理证实为胰腺导管腺癌(PDAC)的患者一般临床病理及随访资料。术前均行18F-FDG PET/CT全身扫描,计算机计算PET/CT肿瘤负荷参数:最大标准化摄取值(SUVmax)、肿瘤代谢体积(MTV)、病灶糖酵解总量(TLG),并以其中位数为界值分组。采用Kaplan-Meier法和Log-rank检验、Cox回归风险模型分析一般临床病理因素、SUVmax、MTV及TLG与胰腺癌预后的关系。结果Kaplan-Meier生存分析结果显示不同MTV、TLG、pTNM分期、术后化疗水平间的术后生存率差异显著(P<0.05)。COX单因素分析显示 MTV、TLG、pTNM分期、术后化疗均是预后的影响因素(P<0.05)。Cox多因素回归分析结果显示TLG、pTNM分期是影响预后的独立危险因素(P<0.05),TLG高组(TLG>58)的相对危险度(HR)是低组(TLG≤58)的2.281倍,pTNM Ⅱ期患者的相对危险度(HR)是Ⅰ期的2.739倍。结论术前18F-FDG PET/CT 测定的肿瘤负荷是胰腺癌重要的预后因素,肿瘤负荷较高者生存期很可能较短。
〔关键词〕胰腺癌;正电子发射断层显像术;肿瘤负荷;病灶糖酵解总量
胰腺癌是预后极差的消化道恶性肿瘤之一,总体5年生存率为0~5%,手术切除率只有10%~15%,根治性手术后5年生存率也仅为5%~20%〔1〕。尽管近年来对胰腺癌侵袭、转移及复发机制的研究已经深入到分子学水平,但胰腺癌的生存率在过去40年里改善仍不明显,发病率几乎等于死亡率〔2〕。目前仅依据患者一般临床病理因素如病理学分型、淋巴结转移情况、血清肿瘤标志物、pTNM分期等作出的预后判断仍不够全面准确,临床上公认的预后指标甚少,正电子发射X线断层摄像术(PET)/CT测定的肿瘤负荷预测肿瘤预后是近期研究的热点。肿瘤细胞由于细胞中最为重要的肿瘤抑制因子之一p53的突变或缺失,使其失去了与葡萄糖-6-磷酸脱氢酶结合和对该酶抑制的能力,为了满足快速、无限生长的需要,在供氧充足的条件下肿瘤细胞也只能通过糖酵解途径进行大量的生物合成,这种有氧糖酵解的代谢特征称为瓦博格效应〔3〕,表现为葡萄糖摄取率高,糖酵解活跃。PET/CT提供的最大标准化摄取值(SUVmax)、肿瘤代谢体积(MTV)及病灶糖酵解总量(TLG)三个肿瘤负荷参数,特别是TLG,同时包含了解剖信息及代谢信息,能提供更多的肿瘤特异性信息。PET/CT被广泛用于肿瘤诊断、分期、可切除性及治疗反应评估,但这些应用绝大多数都依赖SUVmax〔4〕,而MTV及TLG在胰腺癌临床应用方面报道较少。本文探讨术前经18F-2-脱氧葡萄糖(18F-FDG)PET/CT 测定的肿瘤负荷与胰腺癌预后的相关性。
1资料与方法
1.1一般资料2008年1月至2015年4月广东省人民医院胰腺癌患者52例。纳入标准:①均行胰腺癌根治术,且病理证实为胰腺导管腺癌(PDAC);②术前均行全身18F-FDG PET/CT肿瘤扫描,且行PET/CT检查前未接受任何抗肿瘤治疗;③临床资料完整,PET/CT检查与根治性手术切术时间相隔10 d以内。分别收集统计患者一般临床病理研究因素,包括:年龄、性别、肿瘤部位、肿瘤大小、术前血清癌抗原(CA)19-9、淋巴结转移情况(N0,N1)、pTNM分期〔采用美国癌症联合会(AJCC)制定的第7版胰腺癌TNM分期标准〕、术后化疗。其中男34例,女18例;年龄35~81岁,平均(61±11.5)岁;肿瘤大小1.5~7.0 cm,平均(3.7±1.7)cm,中位大小3.5 cm,胰头癌42例,胰尾癌10例;淋巴结转移(N1)25例,(N0)27例;CA19-9 阳性(>37 kU/L)40例,阴性(≤37 kU/L)12例;pTNM Ⅰ期患者14例,Ⅱ期28例;24例术后化疗,28例术后无化疗。
1.2显像方法采用SIEMENS Biograph16型 PET/CT仪。显像剂18F-PDG为本院加速器生产,放化纯度>98%,pH 值为7。检查前患者禁食6 h以上,血糖(微量法)控制<8 mmol/L,肘静脉静注18F-PDG(剂量为7.4 MBq/kg体重),暗光,静息60 min后,行3D PET /CT采集(Biograph16,120 kev,50 mAs)。顺序及范围:会阴部→颅底(2 min/床位)+头部。采集结束后进行CT图像及PET图像均以DICOM格式存于PET PACS系统。
1.3图像分析及PET/CT参数采集参考田月丽〔5〕提供的方法,将CT图像及PET图像导入RT-image图像处理软件进行组织衰减校正及图像进行融合。结合患者原有临床资料,先对图像行视觉分析,寻找胰腺可疑病灶,在18F-PDG最浓聚处勾画合适的感兴趣区(ROI),由计算机工作站自动计算生成18F-PDG SUVmax,再采用 40%SUVmax为阈值逐层自动或手动勾画感兴趣区ROI,确定病灶的边界,同时记录每层的面积Si、层厚Ti及18F-PDG平均摄取值SUVmean,方法见图1。

先将CT图像(a)与PET图像(b)进行图像融合得到PET/CT图像(c),寻找可疑病灶,手动勾画ROI1,计算机自动获取SUVmax,再以40%SUVmax为阈值,自动勾画ROI2,同时记录ROI2的Si,Ti,SUVmean图1 MTV、TLG的获取方法
1.4统计学方法采用SPSS19.0统计软件进行Log-rank检验,并行COX单、多因素回归分析。
2结果
2.1临床资料SUVmax平均(5.12±2.68),中位数4.6,MTV平均(37±52.3)cm3,中位数23 cm3,TLG平均(141±235.9),中位数58,全组随访6个月以上,随访3~58个月,中位随访时间19个月,生存状况见表1。
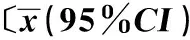
表1 PDAC患者术后基本生存状况,个月〕
2.2Kaplan-Meier法生存率分析MTV高组1、2年生存率分别为60.5%、22.2%,MTV低组分别为86.8%、65.4%,两者差异具有统计学意义(P=0.032)。见图2。TLG高组1、2年生存率分别为59.7%、29.8%,TLG低组分别为90.3%、67.0%,两者差异具有统计学意义(P<0.017)。见图3。pTNM分期、术后化疗间的生存率差异有统计学意义(P分别为0.014,0.041),而性别、年龄、肿瘤大小、肿瘤部位、淋巴结转移、术前血清CA19-9间、SUVmax组间的生存率差异不明显(P>0.05)。
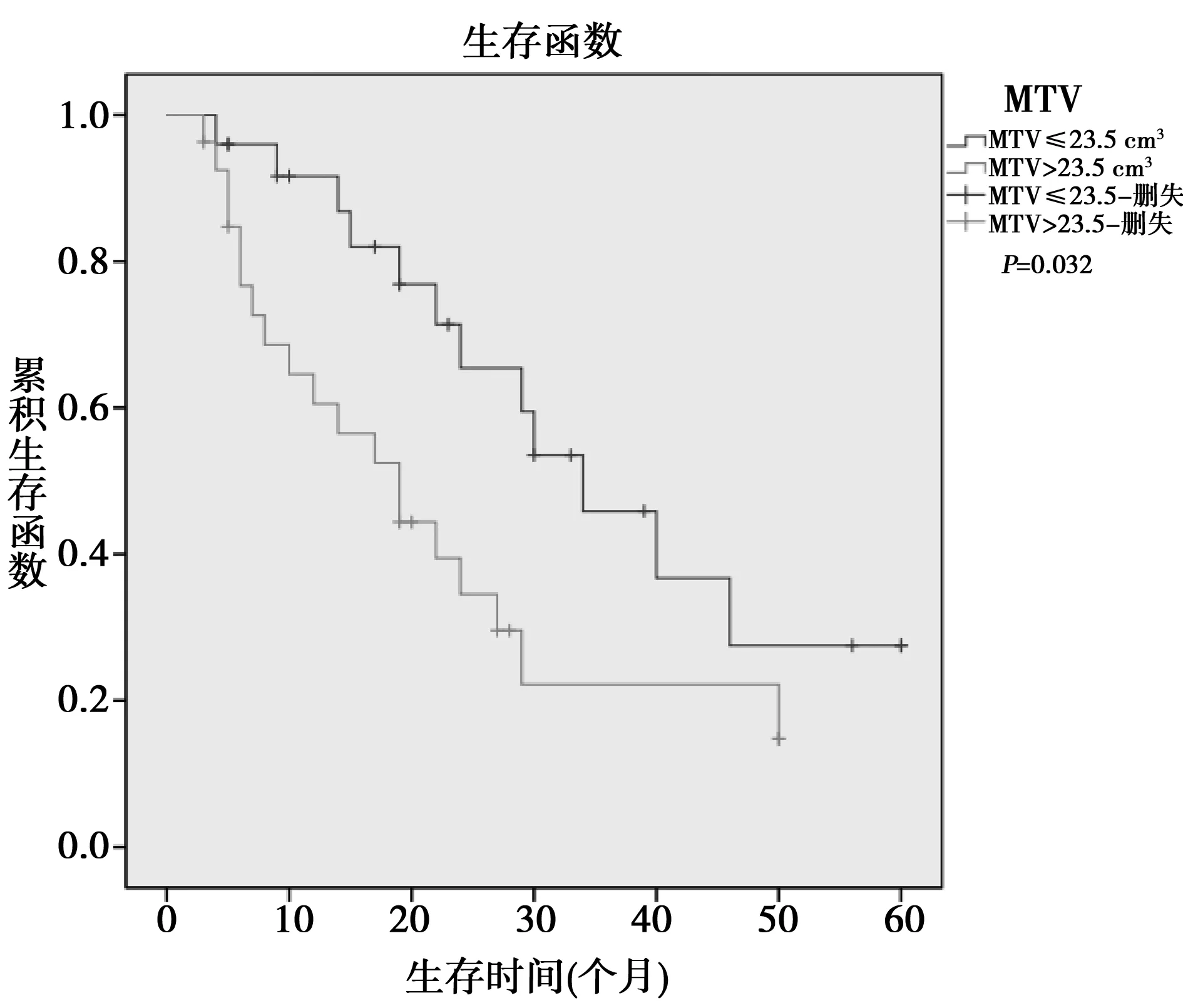
图2 不同MTV的PDAC患者术后生存曲线
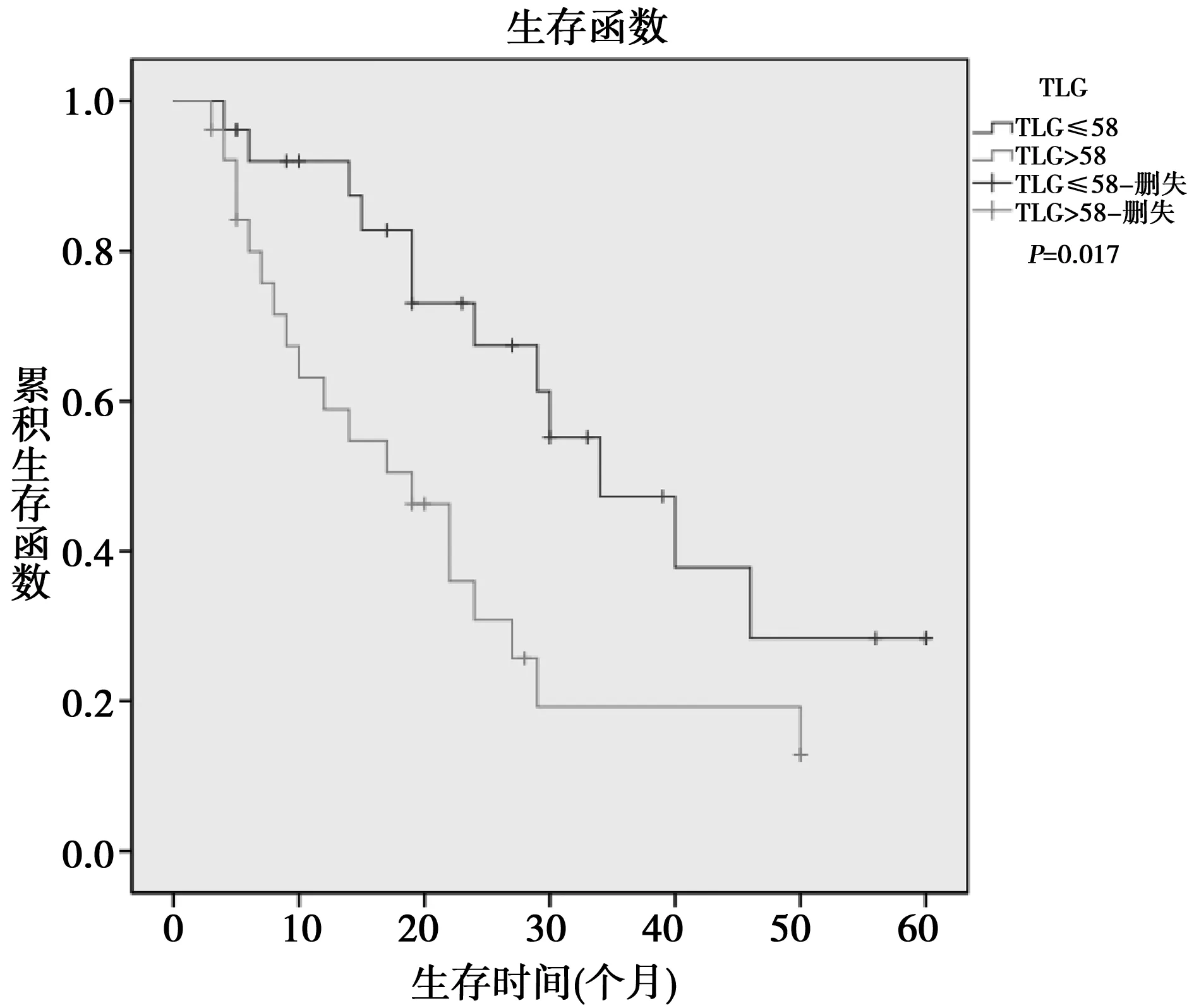
图3 不同TLG的PDAC患者术后生存曲线
2.3COX单因素生存分析表2可见,TNM分期、术后化疗、MTV、TLG与患者预后密切相关(P<0.05)。而性别、年龄、肿瘤大小、肿瘤部位、淋巴结转移、术前血清CA19-9及SUVmax对预后无影响(P>0.05)。其中MTV及TLG高组的相对危险度(HR)分别是低组的2.169、2.613倍。
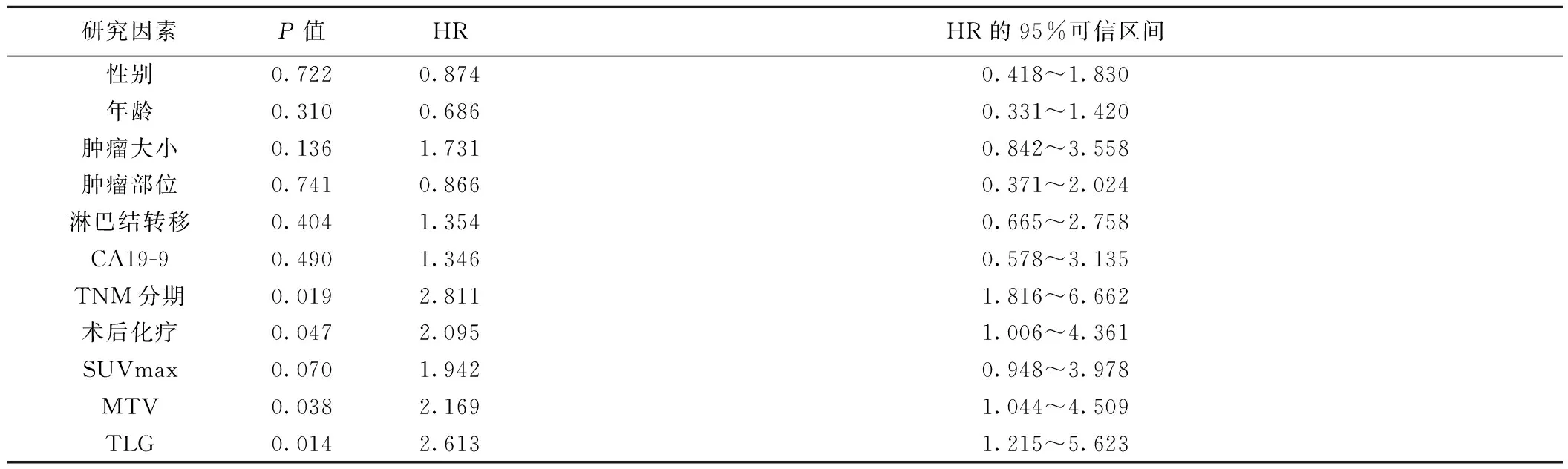
表2 PDAC患者术后预后COX单因素分析
2.4COX多因素生存分析将COX单因素分析有意义的因素纳入COX多因素分析,结果显示,PET参数中,TLG是影响预后的独立危险因素,TLG高组HR是低组的2.281倍。调整了其他研究因素后,pTNM分期亦是影响预后的独立危险因素,而其他预后因素在多因素预后分析中不具有独立影响预后作用(P>0.05)。见表3。
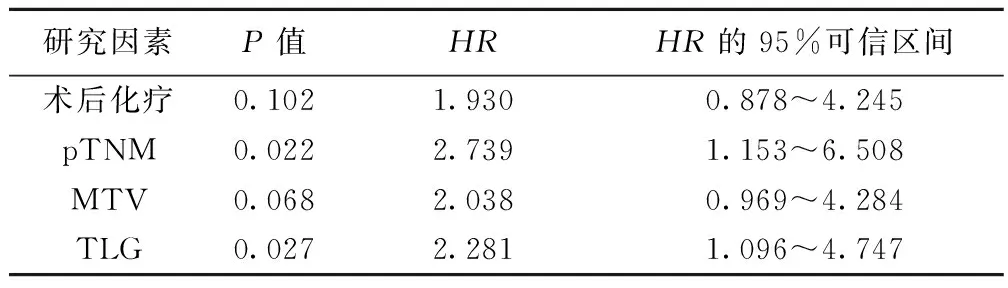
表3 PDAC患者术后预后COX多因素分析
3讨论
影响胰腺癌预后的因素有多种,主要概括为三类:①肿瘤自身生物学行为特性;②患者个体因素;③治疗相关因素。深入了解评估肿瘤负荷对肿瘤患者尤为重要,因为肿瘤负荷不但与肿瘤短期疗效密切相关,而且对肿瘤远期预后具有重要意义,是影响肿瘤预后的重要因素〔6〕。本研究提示,通过PET/CT测量的肿瘤负荷有助于胰腺癌术后的预后判断,且比手术肿瘤标本大小等既往讨论的预后因素预测价值更高,高肿瘤负荷的胰腺癌患者,术后应更注重综合治疗〔7〕。
既往评估肿瘤负荷通常依靠手术肿瘤标本大小或CT断层扫描,但此类方法受肿瘤形状及存在无功能肿瘤坏死组织的局限,增加假阳性的发生率,测得的肿瘤直径和体积并不能代表肿瘤的实际大小〔8〕。18F-FDG PET/CT将肿瘤大小或体积等反映解剖因素的CT图像与反映代谢活性因素的PET图像结合起来,使得直接依据肿瘤内异常的葡萄糖代谢信息和肿瘤形态等来评估肿瘤负荷更加精确全面。基于PET评估的肿瘤负荷对非小细胞肺癌术后生存率〔9〕、胆管癌化疗方案选择〔10〕,复发难治性大B细胞淋巴瘤的化疗疗效评估〔11〕等多种肿瘤均有良好的临床应用价值,且对比传统方法优势明显。
关于MTV与TLG何者更能预测肿瘤愈合目前仍存在争议。Shi等〔12〕发现MTV及TLG均是影响胰腺癌预后的独立风险因素,且预测价值优于SUVmax及肿瘤大小。Xie等〔13〕对鼻咽癌的研究中发现TLG能独立预测鼻咽癌的预后,但MTV却非鼻咽癌的独立风险因素。而在一项食道癌的研究却发现只有MTV能对食管癌的同步放化疗效果有预测作用〔14〕。SUVmax关注的是PDG最高的某一区域,是一种基于肿瘤代谢程度的半定量参数,MTV是图像上SUV 处于某给定范围的全部体素的体积,一种基于肿瘤体积大小的参数,而TLG在计算过程中,引入了SUVmean这一反映肿瘤平均糖酵解水平的参数,既考虑了肿瘤的体积,同时也兼顾了肿瘤的糖酵解程度,是既包含SUV又包含MTV的参数,更为接近于PET成像原理及肿瘤负荷的概念。本研究认为TLG理论上较SUVmax及MTV有更高的预后预测效能。
计算MTV及TLG过程中,根据勾画ROI所界定的SUV阈值不同,文献报道约有27种〔15〕,而最常用的有3种〔8〕:绝对阈值法,相对阈值法和背景法(基于本底的动态阈值算法)。三种方法中,绝对阈值法以SUV=2.5为勾画阈值,方法最简单,但准确性最低。相对阈值法通常以40%SUVmax为勾画阈值,复杂性及准确度均较好,而背景法是通过选取病灶周围背景组织3个层面任意勾画约10个ROI,然后计算所有ROI的 SUV平均值获得SUV背景,通过公式SUV=SUV背景+20% (SUVmax-SUV背景)最终界定勾画阈值,此方法准确性最高,但较为复杂。本研究采用了40%SUVmax为勾画阈值,原因是容易操作,同时此方法得到的MTV及TLG与背景法得到的数据差别不大〔8〕,外文文献大多也沿用此方法。
本研究主要局限为单中心回顾性研究且样本量偏少,胰腺癌手术切除率低,PET/CT检查用高、普及率低,限制了能同时行PET检查及根治性手术治疗的病例数量。肿瘤部位、肿瘤大小、淋巴结转移,术前血清CA19-9、术后化疗等既往文献讨论的影响胰腺癌预后的重要因素在本研究中并没体现独立预测预后作用,原因可能在一定程度上也受样本量的影响,要得到更准确更有说服力的结论,仍需大样本多中心的研究加以证实。另外,PET/CT测定MTV、TLG的方法较多,至今没有公认的标准,这在一定程度上限制其在临床上的推广应用。而肿瘤负荷对胰腺癌的诊断特异性及敏感性,肿瘤负荷与胰腺癌无瘤生存期的关系,肿瘤负荷联合肿瘤标志标志物、病理分期、肿瘤基因等其他胰腺癌预后指标能否提供更加全面可靠的预后判断效能等诸多命题,目前相关的研究仍较少,需要后期更多研究以拓宽PET/CT测定的肿瘤负荷在胰腺癌方面的应用。
4参考文献
1王强,傅德良.胰腺癌淋巴结转移研究进展〔J〕.中国实用外科杂志,2009;29(8):682-5.
2李慧超,王宁,郑荣寿,等.中国2010年胰腺癌发病和死亡分析〔J〕.中国肿瘤,2015;24(3):163-9.
3van Horssen R,Freire Jorge P,van Dam GM,etal.The Warburg effect and its role in tumour metabolism:opportunities for new cancer treatments〔J〕.Ned Tijdschr Geneeskd,2015;160:A9489.
4Ospina MB,Horton J,Seida J,etal.Positron emission tomography for nine cancers(bladder,brain,cervical,kidney,ovarian,pancreatic,prostate,small cell lung,testicular)〔J/OL〕.Rockville(MD):Agency for Healthcare Research and Quality(US),2008.
5田月丽.18F-FDG PET/CT显像对鼻咽癌患者治疗后随访价值及预后分析〔D〕.武汉:华中科技大学,2014.
6Moon SH,Hyun SH,Choi JY.Prognostic significance of volume-based PET parameters in cancer patients〔J〕.Korean J Radiol,2013;14(1):1-12.
7Yamamoto M,Tsujikawa T,Fujita Y,etal.Metabolic tumor burden predicts prognosis of ovarian cancer patients who receive platinum-based adjuvant chemotherapy〔J〕.Cancer Sci,2016;107(4):478-85.
8袁辉.基于18F-FDG PET/CT图像的总糖解量对食管鳞癌术后患者预后的预测价值〔D〕.武汉:华中科技大学,2013.
9Kim MH,Lee JS,Mok JH,etal.Metabolic burden measured by(18)f-fluorodeoxyglucose positron emission tomography/computed tomography is a prognostic factor in patients with small cell lung cancer〔J〕.Cancer Res Treat,2014;46(2):165-71.
10Choi MK,etal.Prognostic and predictive value of metabolic tumor volume on(18)F-FDG PET/CT in advanced biliary tract cancer treated with gemcitabine/oxaliplatin with or without erlotinib〔J〕.Med Oncol,2014;31(7):23.
11Tateishi U,Tatsumi M,Terauchi T,etal.Prognostic significance of metabolic tumor burden by positron emission tomography/computed tomography in patients with relapsed/refractory diffuse large B-cell lymphoma〔J〕.Cancer Sci,2015;106(2):186-93.
12Shi S,Ji S,Qin Y,etal.Metabolic tumor burden is associated with major oncogenomic alterations and serum tumor markers in patients with resected pancreatic cancer〔J〕.Cancer Lett,2015;360(2):227-33.
13Xie P,Yue JB,Zhao HX,etal.Prognostic value of 18F-FDG PET-CT metabolic index for nasopharyngeal carcinoma〔J〕.J Cancer Res Clin Oncol,2010;136(6):883-9.
14Arslan N,Miller TR,Dehdashti F,etal.Evaluation of response to neoadjuvant therapy by quantitative 2-deoxy-2-〔18F〕fluoro-D-glucose with positron emission tomography in patients with esophageal cancer〔J〕.Mol Imaging Biol,2002;4(4):301-10.
15Frings V,van Velden FH,Velasquez LM,etal.Repeatability of metabolically active tumor volume measurements with FDG PET/CT in advanced gastrointestinal malignancies:a multicenter study〔J〕.Radiology,2014;273(2):539-48.
〔2014-12-19修回〕
(编辑苑云杰)
基金项目:2014年度广东省自然科学基金项目资助(No.2014A030310073)
通讯作者:简志祥(1961-),男,博士,主任医师,博士生导师,主要从事肝胆胰肿瘤研究。
〔中图分类号〕R657.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)12-2948-03;
doi:10.3969/j.issn.1005-9202.2016.12.059
1广东省人民医院广东省医学科学院
第一作者:吴忠仕(1987-),男,硕士,医师,主要从事肝胆胰肿瘤研究。

