新疆维吾尔族、汉族胃癌血清胃蛋白酶原、胃泌素-17水平及其与幽门螺杆菌感染相关性的临床研究*
朱 琦 俞 文 薛莱提·艾孜木 艾尼·阿布都热依木#
上海交通大学医学院附属仁济医院消化科1(200127) 新疆维吾尔自治区喀什地区第二人民医院消化科2
新疆维吾尔族、汉族胃癌血清胃蛋白酶原、胃泌素-17水平及其与幽门螺杆菌感染相关性的临床研究*
朱琦1,2俞文2薛莱提·艾孜木2艾尼·阿布都热依木2#
上海交通大学医学院附属仁济医院消化科1(200127)新疆维吾尔自治区喀什地区第二人民医院消化科2
背景:血清胃蛋白酶原(PG)和胃泌素-17(G-17)水平以及幽门螺杆菌(Hp)感染与胃癌的发生关系密切。新疆维吾尔族、汉族胃癌血清PG、G-17与Hp感染关系的研究少见。目的:探讨新疆维吾尔族、汉族胃癌患者血清PG、G-17水平及其与Hp感染的关系。方法:选择198例维吾尔族胃癌和50例汉族胃癌患者,分别以同民族健康体检者作为正常对照。应用ELISA法检测血清PGⅠ、PGⅡ和G-17水平,计算PGⅠ/PGⅡ比值(PGR);应用尿素呼气试验和粪便Hp抗原行Hp检测。结果:维吾尔族、汉族胃癌组血清PGⅠ和PGR均明显低于相应对照组,血清PGⅡ和G-17明显升高(P<0.05);维吾尔族胃癌组血清PGⅠ和PGR明显低于汉族胃癌组,血清G-17明显升高(P<0.05)。维吾尔族、汉族胃癌组Hp感染率均明显高于相应对照组(P<0.05)。汉族胃癌组Hp阳性者血清PGⅠ和PGR明显低于同组Hp阴性者,血清PGⅡ、G-17明显升高(P<0.05);维吾尔族胃癌组Hp阳性者血清PGⅠ、PGⅡ、G-17明显高于Hp阴性者,PGR明显降低(P<0.05)。维吾尔族胃窦癌血清PGⅠ、PGⅡ和PGR均明显高于胃体癌和近端胃癌(P<0.05)。结论:血清PGⅠ、PGR降低和血清G-17升高可作为新疆地区维吾尔族、汉族胃癌筛查的血清学指标;维吾尔族、汉族胃癌患者血清PGⅠ、PGR和G-17水平改变与Hp感染相关。
关键词维吾尔族;胃肿瘤;胃蛋白酶原类;胃泌素-17;幽门螺杆菌
Study on Serum Levels of Pepsinogen and Gastrin-17 and their Relationships withHelicobacterpyloriInfection in Uygur and Han Population with Gastric Cancer in Xinjiang AreaZHUQi1,2,YUWen2,Shohrad·AZIMU2,Aini·ABUDUREYIMU2.1DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200127);2DepartmentofGastroenterology,KashgarPrefectureSecondPeople’sHospital,Kashi,XinjiangUygurAutonomousRegion
Correspondence to: Aini·ABUDUREYIMU, Email: ainiabudu@126.com
胃癌的致病是一个多步骤、多因素过程,与宿主遗传因素、幽门螺杆菌(Helicobacterpylori, Hp)感染以及环境因素如饮食的相互作用有关。胃癌的发生经历了慢性胃炎、萎缩、肠化生和异型增生等一系列演变过程,这一过程中伴随着血清胃蛋白酶原(pepsinogen, PG)和胃泌素17(gastrin-17, G-17)的变化[1-2]。胃镜下取活检可诊断萎缩性胃炎和胃癌,但胃镜筛查胃癌的成本较高,且患者依从性差,故不适用于大规模筛查。有学者通过检测血清PG来提高胃癌及其癌前病变的诊断率,得到临床广泛认可[3-7]。我国亦已展开相关研究[8-11]。2014年《中国早期胃癌筛查及内镜诊治共识意见》[12]建议联合检测血清G-17、PGⅠ、PGⅠ/PGⅡ比值(PGR)以及Hp抗体,作为胃癌筛查的血清学方法。维吾尔族(下文简称维族)是我国的主要民族之一,对维族胃癌血清PG、G-17及其相关影响因素的研究少见报道。本研究通过检测维族和汉族胃癌患者和正常人群中血清PG、PGR、G-17水平以及Hp感染情况,旨在为维族胃癌的筛查以及早期诊断提供简便经济而有效的检测手段。
对象与方法
一、研究对象
选择2014年1月—2015年10月新疆喀什地区第二人民医院经内镜或术后病理学检查确诊的胃癌患者248例,其中维族198例、汉族50例,连续3代均为同一民族。维族患者平均年龄(58.5±16.4)岁;胃窦癌51例,胃体癌89例,近端胃癌(包括胃底、贲门)58例。汉族平均年龄(60.2±15.1)岁;胃窦癌28例,胃体癌14例,近端胃癌8例。选择同期80例健康体检者作为正常对照组(维族58例,汉族22例),平均年龄(50.3 ±15.5)岁,除外萎缩性胃炎和上消化道肿瘤,无肝肾功能不全。所有受试者纳入本研究4周前未服用过抑酸药、抗菌药物、铋剂等药物。所有研究对象均知情同意。
二、研究方法
1. ELISA法:受检者禁食8 h后采集血液标本10 mL,按照ELISA试剂盒(芬兰Biohit公司)说明书检测血清PGⅠ、PGⅡ和G-17水平,并计算PGR。
2. Hp的检测:采用13C或14C-尿素呼气试验(深圳中核海得威生物科技有限公司)和(或)粪便Hp抗原检测(北京协和药业有限公司),具体步骤按说明书操作,任一检查结果阳性视为Hp感染。
三、统计学分析
结果
一、血清PGⅠ、PGⅡ、PGR和G-17水平
维族、汉族胃癌组血清PGⅠ和PGR较相应对照组明显降低,血清PGⅡ和G-17明显升高(P<0.05)。维族胃癌组血清PGⅠ和PGR明显低于汉族胃癌组,血清G-17明显升高(P<0.05)。维族对照组血清PGⅠ和PGR较汉族对照组明显降低,血清PGⅡ和G-17明显升高(P<0.05)(表1)。
二、Hp感染
维族、汉族胃癌组的Hp感染率均明显高于相应对照组(分别为69.7%对54.4%,68.0%对 50.0%)(P<0.05),而维组与汉族胃癌组以及维组与汉族对照组间Hp感染率无明显差异(P>0.05)。
三、不同Hp感染情况下血清PGⅠ、PGⅡ、PGR和G-17水平
维族、汉族对照组Hp阳性者血清PGⅠ、PGⅡ、G-17明显高于同组Hp阴性者(P<0.05),但PGR无明显差异。汉族胃癌组Hp阳性者血清PGⅠ和PGR低于同组Hp阴性者,血清PGⅡ、G-17明显升高(P<0.05);维族胃癌组Hp阳性者血清PGⅠ、PGⅡ、G-17明显高于Hp阴性者,PGR明显降低(P<0.05)(表2)。
四、胃癌不同部位血清PGⅠ、PGⅡ、PGR和G-17水平
维族、汉族胃窦癌血清PGⅠ、PGⅡ和PGR高于胃体癌和近端胃癌(P<0.05),而胃体癌与近端胃癌之间无明显差异(P>0.05)。维族胃体癌和近端胃癌血清G-17水平明显高于胃窦癌(P<0.05),维族胃体癌与近端胃癌之间无明显差异(P>0.05),而汉族胃癌组三个不同病变部位之间无明显差异(P>0.05)(表3)。
讨论
我国为胃癌高发国家,新疆特别是南疆地区胃癌发病率较高。目前研究认为Hp感染以及PG、G-17均与胃癌的发生、发展密切相关[4,13]。
PGⅠ主要由胃底腺主细胞和颈黏液细胞分泌,
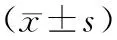
表1 各组血清PGⅠ、PGⅡ、PGR和G-17水平比较
*与同民族对照组比较,P<0.05;#与汉族胃癌组比较,P<0.05;▲与汉族对照组比较,P<0.05
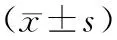
表2 Hp感染与血清PGⅠ、PGⅡ、PGR和G-17水平的关系
*与同组Hp阴性者比较,P<0.05
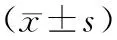
表3 维族和汉族不同胃癌部位血清PGⅠ、PGⅡ、PGR和G-17水平比较
*与同民族胃窦癌比较,P<0.05
PGⅡ由全胃腺和近端十二指肠Brunner腺产生。血清PG可反映胃黏膜腺体和细胞数量,是胃癌危险度和胃黏膜状态的指征[3-5,13-14]。胃癌前病变和胃癌细胞中PGⅠ水平减少,而PGⅡ水平无明显变化或仅轻度升高,导致PGR下降,因此联合检测血清PG水平和PGR对诊断胃病具有一定意义。低水平PGⅠ和PGR可作为筛查胃癌高危人群的标记物,起到“血清学活检”的作用[13-14]。Yoshihara等[15]从10 996 名居民中筛选出低PG水平者行胃镜检查,结果显示PGⅠ和PGR降低的人群中胃癌发生率远高于PG不降低者,90%普查检出的胃癌为早期癌。国内多项研究亦表明血清PG异常的胃黏膜多有明显的癌前疾病倾向,为胃癌的高危人群,利用PGⅠ和PGR联合诊断和筛查胃癌具有良好的敏感性和特异性[8-11,16]。本研究结果显示,维族胃癌组血清PGⅠ、PGR低于维族对照组和汉族胃癌组,说明低水平PGⅠ和PGR可提示维族胃癌高危的可能。不同民族患者血清PGⅠ水平和PGR差异可能与维族胃癌患者就诊较晚,确诊时属于进展期胃癌有关。此外,血清PG水平在不同种族中的明显差异可能与遗传因素和饮食因素有关[7,17-18],新疆地区维族独特的遗传因素和生存环境决定其胃癌的发病机制可能有别于其他民族,但需大样本研究进一步证实。
Hp阳性人群的胃癌发生风险明显高于普通人群[19]。本研究结果表明维族、汉族胃癌组Hp感染率均明显高于相应对照组,而前两者间无明显差异;提示新疆地区不同民族胃癌患者的Hp感染率相似,Hp感染亦是参与维族胃癌发病的主要致病因素之一。Hp感染与PG关系的研究结果存在差异,可能与研究人群感染的Hp菌株、宿主遗传因素、感染部位和感染阶段的不同有关。有研究[4,20]认为胃癌PG表达改变的机制可能为Hp长期持续感染,发展至胃癌前病变或胃癌时,由于长期炎症和免疫反应导致胃腺体萎缩丢失,主细胞减少,PGⅠ合成分泌下降,而PGⅡ变化不明显,导致PGR下降。Kikuchi等[21]对2 584例患者Hp感染及其感染灶大小对PG水平的影响随访了5年,发现Hp阳性组PGⅠ低于阴性组,PGR降低更为明显。而曹勤等[8]的研究显示正常对照组Hp阳性者的PGⅠ显著高于阴性者,PGR显著低于阴性者,与本研究中对照组的结果相一致。本研究还发现汉族胃癌组Hp阳性患者血清PGⅠ和PGR均明显低于Hp阴性患者(P<0.05);维族胃癌组Hp阳性患者血清PGⅠ水平高于Hp阴性患者,PGR明显降低(P<0.05)。表明不同Hp感染情况下维族胃癌患者PGⅠ水平与汉族胃癌患者存在明显差异,可能与维族患者的遗传因素、肿瘤累及部位、病理类型以及样本量有关。
胃泌素对调节消化道功能并维持其结构完整具有重要作用,其中80%~90%的胃泌素为G-17。近年研究证实胃泌素对癌细胞的生长和恶性转化有一定影响。有研究发现胃癌患者血清胃泌素含量显著升高,表明胃泌素异常分泌与胃癌的发生和发展密切相关[22-23]。程兆明等[24]的研究表明胃癌患者确实存在一定程度的高胃泌素血症,主要见于胃底、贲门和胃体癌,浸润型胃癌较局限型胃癌胃泌素水平升高更明显,提示血清胃泌素与癌肿浸润范围和病变部位有关。本研究中维、汉两族胃癌组G-17水平显著高于相应对照组,且维族胃癌G-17水平高于汉族,表明血清G-17水平在不同民族中存在差异,可能与人种、饮食习惯、环境因素等有关。此外,维族和汉族Hp阳性患者血清G-17水平均明显高于Hp阴性患者,提示Hp感染与G-17水平变化有关。有研究表明Hp感染并定植于胃窦黏膜可刺激胃窦G细胞分泌,从而导致胃泌素的分泌和升高[8,13,22],与本研究结果相一致。本研究中,维族胃体癌和近端胃癌血清G-17水平高于胃窦癌,而前两者之间无明显差异,说明G-17水平与维族胃癌部位存在相关性,而与汉族胃癌部位无关,这一结果与曹勤等[8]汉族胃癌人群的研究结果相一致,提示各民族累及不同胃癌部位的G-17表达存在差异,亦可能存在样本选择偏倚,有待今后扩大样本量,分不同部位亚组进一步比较研究。
总之,本研究结果表明维族、汉族胃癌患者血清PGⅠ、PGR和G-17水平改变与Hp感染相关,提示血清PGⅠ、PGR降低和血清G-17升高可用于新疆地区人群早期胃癌的筛查。对新疆地区维族、汉族胃癌高危人群可进一步行胃镜检查,以提高胃癌的早期诊断率。本研究还表明血清PG、PGR和G-17水平在新疆地区不同民族人群中存在差异,维族、汉族胃癌不同病变部位PG、PGR和G-17水平改变亦存在差异,可能与民族遗传因素、环境因素有关,其具体机制尚需更多样本行进一步研究。
参考文献
1 Kikuchi R1, Abe Y, Iijima K, et al. Low serum levels of pepsinogen and gastrin 17 are predictive of extensive gastric atrophy with high-risk of early gastric cancer[J]. Tohoku J Exp Med, 2011, 223 (1): 35-44.
2 孙涛, 袁媛, 李兆申. 早期胃癌非创伤性检查进展与现状[J]. 中国实用内科杂志, 2014, 34 (4): 421-427.
3 Watabe H, Mitsushima T, Yamaji Y, et al. Predicting the development of gastric cancer from combiningHelicobacterpyloriantibodies and serum pepsinogen status: a prospective endoscopic cohort study[J]. Gut, 2005, 54 (6): 764-768.
4 Kokkola A, Louhimo J, Puolakkainen P, et al.Helicobacterpyloriinfection and low serum pepsinogen Ⅰ level as risk factors for gastric carcinoma[J]. World J Gastroenterol, 2005, 11 (7): 1032-1036.
5 Oishi Y, Kiyohara Y, Kubo M, et al. The serum pepsinogen test as a predictor of gastric cancer: the Hisayama study[J]. Am J Epidemiol, 2006, 163 (7): 629-637.
6 di Mario F, Cavallaro LG. Non-invasive tests in gastric diseases[J]. Dig Liver Dis, 2008, 40 (7): 523-530.
7 Haj-Sheykholeslami A, Rakhshani N, Amirzargar A, et al. Serum pepsinogen Ⅰ, pepsinogen Ⅱ, and gastrin 17 in relatives of gastric cancer patients: comparative study with type and severity of gastritis[J]. Clin Gastroenterol Hepatol, 2008, 6 (2): 174-179.
8 曹勤, 冉志华, 萧树东. 血清胃蛋白酶原、胃泌素-17和幽门螺杆菌IgG抗体筛查萎缩性胃炎和胃癌[J]. 胃肠病学, 2006, 11 (7): 388-394.
9 王朝晖, 李艳华, 郭占方. 蒙古族、汉族胃癌患者血清胃蛋白酶原水平及与幽门螺杆菌关系的研究[J]. 中国中西医结合消化杂志, 2014, 22 (12): 725-728.
10王雪华, 曹燕, 张剑宏, 等. 血清胃蛋白酶原联合胃泌素测定在胃癌及萎缩性胃炎中的诊断价值[J]. 中华临床医师杂志(电子版), 2015, 9 (10): 1824-1827.
11刘文佳, 毛秋卉, 张学俭, 等. 血清胃蛋白酶原和胃泌素-17筛选胃癌及癌前病变有效性[J]. 中华实用诊断与治疗杂志, 2015, 29 (9): 885-887.
12中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜学专业委员会. 中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)[J]. 胃肠病学, 2014, 19 (7): 408-427.
13Tu H, Sun L, Dong X, et al. Temporal changes in serum biomarkers and risk for progression of gastric precancerous lesions: a longitudinal study[J]. Int J Cancer, 2015, 136 (2): 425-434.
14王法成, 景晶晶, 王选杰, 等. 早期与进展期胃癌患者胃黏膜“血清学活检”指标差异比较[J]. 胃肠病学和肝病学杂志, 2015, 24 (2): 156-160.
15Yoshihara M, Sumii K, Haruma K, et al. Correlation of ratio of serum pepsinogen Ⅰ and Ⅱ with prevalence of gastric cancer and adenoma in Japanese subjects[J]. Am J Gastroenterol, 1998, 93 (7): 1090-1096.
16姜智敏, 戈之铮. 胃蛋白酶原在慢性萎缩性胃炎和胃癌筛查中的价值[J]. 胃肠病学, 2009, 14 (12): 754-756.
17Fahey MT, Hamada GS, Nishimoto IN, et al. Ethnic differences in serum pepsinogen levels among Japanese and non-Japanese Brazilian gastric cancer patients and controls[J]. Cancer Detect Prev, 2000, 24 (6): 564-571.
18Miftahussurur M, Sharma RP, Shrestha PK, et al.Helicobacterpyloriinfection and gastric mucosal atrophy in two ethnic groups in Nepal[J]. Asian Pac J Cancer Prev, 2015, 16 (17): 7911-7916.
19Fock KM. Review article: the epidemiology and prevention of gastric cancer[J]. Aliment Pharmacol Ther, 2014, 40 (3): 250-260.
20Keck JW, Miernyk KM, Bulkow LR, et al.Helicobacterpyloriinfection and markers of gastric cancer risk in Alaska Native persons: a retrospective case-control study[J]. Can J Gastroenterol Hepatol, 2014, 28 (6): 305-310.
21Kikuchi S, Kurosawa M, Sakiyama T, et al. Long-term effect ofHelicobacterpyloriinfection on serum pepsinogens[J]. Jpn J Cancer Res, 2000, 91 (5): 471-476.
22Song DH, Rana B, Wolfe JR, et al. Gastrin-induced gastric adenocarcinoma growth is mediated through cyclin D1[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285 (1): G217-G222.
23Wang TC, Dangler CA, Chen D, et al. Synergistic interaction between hypergastrinemia andHelicobacterinfection in a mouse model of gastric cancer[J]. Gastroenterology, 2000, 118 (1): 36-47.
24程兆明, 李龙, 陈琳娜. 血清胃蛋白酶原Ⅰ、Ⅱ与胃泌素联合检测对胃癌的诊断价值[J]. 中华消化内镜杂志, 2002, 19 (1): 32-34.
(2016-02-05收稿;2016-03-17修回)
DOI:10.3969/j.issn.1008-7125.2016.06.007
*基金项目:新疆少数民族科技人才特殊培养计划科研项目(No.201523104)
Background: Serum levels of pepsinogen (PG), gastrin-17 (G-17) andHelicobacterpylori(Hp) infection are closely associated with gastric cancer. Studies on relationship of serum levels of PG and G-17 with Hp infection in Uygur and Han population with gastric cancer in Xinjiang area are rare. Aims: To investigate serum levels of PG and G-17 and their relationships with Hp infection in Uygur and Han population with gastric cancer in Xinjiang area. Methods: A total of 198 Uygur and 50 Han gastric cancer patients were enrolled, and healthy people with the same race were served as normal controls. Serum levels of PGⅠ, PGⅡ, G-17 were determined by ELISA, PGⅠ/PGⅡ ratio (PGR) was calculated. Urea breath test and stool Hp antigen test were used to detect Hp infection. Results: Serum PGⅠ level and PGR in Uygur and Han patients with gastric cancer were significantly decreased than those in corresponding control groups (P<0.05), and serum levels of PGⅡ and G-17 were significantly increased (P<0.05). Serum PGⅠ level and PGR in Uygur gastric cancer patients were significantly decreased than those in Han gastric cancer patients (P<0.05), and serum G-17 level was significantly increased (P<0.05). Hp infection rate in Uygur and Han patients with gastric cancer were significantly increased than those in corresponding control groups (P<0.05). Serum level of PGⅠ and PGR were significantly decreased in Han gastric cancer patients with Hp-positive than in Hp-negative patients, and serum levels of PGⅡ and G-17 were significantly increased (P<0.05). Serum levels of PGⅠ, PGⅡ and G-17 were significantly increased in Uygur gastric cancer patients with Hp-positive than in Hp-negative patients, PGR was significantly decreased (P<0.05). Serum levels of PGⅠ, PGⅡ and PGR were significantly increased in Uygur gastric antral cancer patients than in gastric corpus cancer and proximal gastric cancer patients (P<0.05). Conclusions: Decreased serum PGⅠ level, PGR and increased serum level of G-17 can be used as biomarkers to screen gastric cancer in Uygur and Han population in Xinjiang area. Hp infection in Uygur and Han patients with gastric cancer is related to the changes of serum level of PGⅠ, PGR and G-17.
Key wordsUygur Nationality;Stomach Neoplasms;Pepsinogens;Gastrin-17;Helicobacter pylori
#本文通信作者,Email: ainiabudu@126.com

