CXC趋化因子受体2和白细胞介素-8在炎症性肠病患者中的表达及其意义*
朱 锋 王晓兵 刘 适 吴 婷 夏 冰
武汉大学中南医院消化内科(430071)
CXC趋化因子受体2和白细胞介素-8在炎症性肠病患者中的表达及其意义*
朱锋王晓兵刘适吴婷夏冰#
武汉大学中南医院消化内科(430071)
背景:CXC趋化因子受体2(CXCR2)为G蛋白耦联受体超家族成员,主要参与肿瘤生长、血管形成以及炎症性疾病的发病,有研究显示其参与炎症性肠病(IBD)发病,但相关作用仍未明确。研究表明白细胞介素-8(IL-8)与CXCR1和CXCR2的相互作用在IBD发病中发挥重要作用。目的:探讨CXCR2和IL-8在IBD患者中的表达及其意义。方法:纳入武汉大学中南医院2013年10月—2014年12月收治的活动期IBD患者121例,分为克罗恩病(CD)组和溃疡性结肠炎(UC)组,选取70例同期健康体检者作为正常对照(HC)组。采用real-time PCR检测外周血和肠黏膜组织IL-8和CXCR2 mRNA表达;采用蛋白质印迹法检测肠黏膜组织CXCR2蛋白表达。结果:UC组外周血IL-8 mRNA表达水平显著高于HC组(P=0.017);CD组、UC组和HC组外周血CXCR2 mRNA表达水平无明显差异(P=0.285)。CD组、UC组和HC组肠黏膜组织IL-8 mRNA表达水平无明显差异(P=0.206);CD组和UC组肠黏膜组织CXCR2 mRNA表达水平显著高于HC组(P=0.002;P<0.001),且UC组显著高于CD组(P=0.005)。UC组和CD组肠黏膜组织CXCR2蛋白表达水平高于HC组(P=0.049;P=0.080)。结论:IBD患者肠黏膜组织CXCR2 mRNA和蛋白表达均显著上调,且以UC患者为著,下调肠黏膜CXCR2表达可为治疗UC提供新靶点。IL-8主要在UC患者外周血中高表达,提示IL-8主要与UC发病相关。
关键词炎症性肠病;Crohn病;结肠炎,溃疡性;受体, CXCR;白细胞介素8
Expressions and Significance of CXC Chemokine Receptor Type 2 and Interleukin-8 in Patients with Inflammatory Bowel DiseaseZHUFeng,WANGXiaobing,LIUShi,WUTing,XIABing.DepartmentofGastroenterology,ZhongnanHospitalofWuhanUniversity,Wuhan(430071)
Correspondence to: XIA Bing, Email: wxbandzhp@163.com
Interleukin-8
炎症性肠病(inflammatory bowel disease, IBD)是一组慢性、非特异性肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。目前IBD的病因和发病机制尚未阐明,普遍认为可能与遗传、环境、微生物以及免疫等因素相互作用有关,其中免疫反应异常是IBD发生的主要病理生理改变,以炎性细胞浸润的黏膜炎症为主要组织病理学特征[1-2]。大量趋化因子及其受体参与了IBD的发病过程[3]。CXC趋化因子受体2(CXCR2)为G蛋白耦联受体超家族成员,主要参与肿瘤生长、血管形成以及炎症性疾病的发病。有研究显示CXCR2参与IBD发病,但相关作用仍未明确。白细胞介素-8(IL-8)是具有炎性活性和趋化作用的细胞因子,属于CXC亚家族成员,与IBD的发生密切相关[4-6]。研究[7-8]表明IL-8与CXCR1和CXCR2的相互作用在IBD发病中发挥重要作用。本研究通过检测IBD患者和健康对照者的外周血和肠黏膜CXCR2和IL-8表达情况,旨在明确两者在IBD发病中的作用。
材料与方法
一、研究对象
纳入武汉大学中南医院2013年10月—2014年12月收治的活动期IBD患者121例,分为CD组和UC组,诊断标准参考中华医学会消化病学分会2012年制订的《炎症性肠病诊断与治疗的共识意见》[9]。选取70例同期健康体检者作为正常对照(HC)组。本研究方案经武汉大学中南医院伦理委员会批准,所有入选者均签属知情同意书。按照患者纳入时间,分三阶段完成下述实验内容。
二、主要试剂
cDNA逆转录试剂盒购自Fermentas公司,real-time PCR试剂盒购自Takara公司,CXCR2兔抗人多克隆抗体购自Santa Cruz公司,羊抗兔IgG(H+L)-HRP购自天津三箭生物技术有限公司。
三、Real-time PCR检测外周血IL-8和CXCR2 mRNA表达
CD组34例患者、UC组26例患者以及HC组44名健康者空腹抽取静脉血5 mL,以real-time PCR检测IL-8和CXCR2 mRNA表达。IL-8引物上游:5’-TCA GGA ATT GAA TGG GTT TGC-3’,下游:5’-CTG TGA GGT AAG ATG GTG GCT AAT-3’;CXCR2引物上游:5’-CAA TAC AGC AAA CTG GCG GA-3’,下游:5’-AGA GCA GGA AGA TGA GGA CG-3’;GAPDH引物上游:5’-GAA GGT GAA GGT CGG AGT C-3’,下游:5’-GAA GAT GGT GAT GGG ATT TC-3’。采用Trizol法提取静脉血RNA,取RNA产物2 μL,以M-MLV逆转录酶合成cDNA,采用BioRad Real-Time PCR仪进行荧光定量扩增,获得CT值,所得结果以2-△△Ct法分析。PCR反应条件:95 ℃ 5 min (预变性);95 ℃ 30 s(变性),56~62 ℃ 30 s(退火),72 ℃ 1 min(延伸),30个循环;72 ℃ 10 min(终延伸)。
四、Real-time PCR检测肠黏膜组织IL-8和CXCR2 mRNA表达
CD组18例患者、UC组17例患者以及HC组16名健康者取肠黏膜组织,以real-time PCR检测IL-8和CXCR2 mRNA表达,肠黏膜组织均为结肠镜活检组织,其中HC组取自结肠息肉患者正常肠段组织。实验步骤和IL-8、CXCR2引物序列同上一步骤。
五、蛋白质印迹法检测肠黏膜组织CXCR2蛋白表达
CD组14例患者、UC组12例患者以及HC组10名健康者取肠黏膜组织,以蛋白质印迹法检测CXCR2蛋白表达。20 mg肠黏膜组织经研磨粉碎后加入100 μL新鲜配制的冷蛋白裂解液(50 mmol/L Tris-HCL,pH 7.5,150 mmol/L NaCl,1% NP-40,0.1% SDS;每100 μL裂解液加入1 μL 100 mmol/L PMSF液),充分裂解后4 ℃、10 000 r/min 离心3 min,取上清液并测定蛋白浓度。取40 μg 蛋白与上样缓冲液混合,煮沸5 min,行SDS-PAGE,电转移至PVDF膜,5% BSA配制的脱脂牛奶封闭。加入兔抗人CXCR2 多克隆抗体(1∶2 000)4 ℃过夜,加入相应二抗室温孵育120 min。TBST缓冲液清洗3次,采用增强化学发光法(ECL)曝光、显影。
六、统计学分析
结果
一、一般情况
CD组66例患者,其中男45例,女21例,年龄12~67岁,平均(34.7±13.7)岁;UC组55例患者,其中男36例,女19例,年龄16~65岁,平均(39.6±14.6)岁。HC组男37例,女33例,年龄22~87岁,平均(38.0±11.8)岁。三者间性别构成、年龄差异无统计学意义(P>0.05)。
二、外周血IL-8和CXCR2 mRNA表达
外周血中,CD组IL-8 mRNA表达水平与HC组和UC组无明显差异(P=0.330;P=0.150),UC组IL-8 mRNA表达水平显著高于HC组(P=0.017);CD组、UC组和HC组间CXCR2 mRNA表达水平无明显差异(P=0.285)(表1、图1)。

表1 外周血IL-8和CXCR2 mRNA表达M(QR)
三、肠黏膜组织IL-8和CXCR2 mRNA表达
肠黏膜组织中,CD组、UC组和HC组IL-8 mRNA表达水平无明显差异(P=0.206),CD组和UC组CXCR2 mRNA表达水平显著高于HC组(P=0.002;P<0.001),且UC组显著高于CD组(P=0.005)(表2、图2)。
四、肠黏膜组织CXCR2蛋白表达
肠黏膜组织中,UC组和CD组CXCR2蛋白表达水平高于HC组(P=0.049;P=0.080),但UC组与CD组间差异无统计学意义(P=0.915)(表3、图3)。

A: IL-8 mRNA; B:CXCR2 mRNA
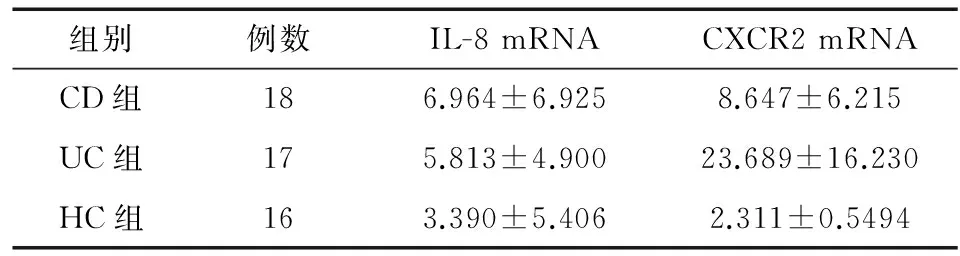
组别例数IL-8mRNACXCR2mRNACD组186.964±6.9258.647±6.215UC组175.813±4.90023.689±16.230HC组163.390±5.4062.311±0.5494
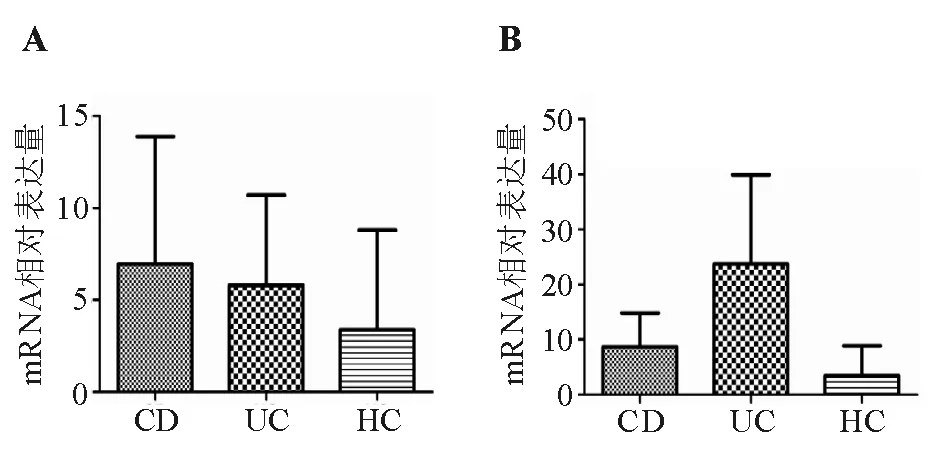
A: IL-8 mRNA; B:CXCR2 mRNA

组别例数CXCR2CD组141.803±1.647UC组122.065±1.670HC组100.748±0.242

图3 肠黏膜组织CXCR2蛋白表达(蛋白质印迹法)
讨论
目前,IBD的发病机制尚未完全明确,普遍认为免疫因素在IBD的发病机制中发挥重要作用,大量炎性细胞(包括自然杀伤细胞、嗜酸性粒细胞、中性粒细胞、淋巴细胞等)向肠道迁移并释放趋化因子,参与肠道炎症的发生,产生炎症损伤效应。趋化因子是一类由组织细胞和炎性细胞合成、分泌的具有趋化募集和活化作用的碱基肝素结合性小分子蛋白家族,与相应趋化因子受体结合后,可诱导炎性细胞趋化游走,介导细胞在炎症部位聚集、活化以及参与组织损伤、修复。趋化因子家族成员在蛋白质分子结构上具有较高的同源性,均包含有4个可形成特征性的链内二硫键的半胱氨酸。根据多肽链一级结构和4个共有氨基酸残基中前2个残基的排列顺序不同,可将趋化因子分为CXC亚家族和CC亚家族。CXC亚家族中,C为半胱氨酸,X为插入两个半胱氨酸的任意氨基酸;CC亚家族中的两个半胱氨酸残基间无其他氨基酸。按照趋化因子的分类,将与趋化因子CXC亚家族结合的受体称为CXC受体(CXCR),与CC亚家族结合的受体称为CC受体(CCR),此两种受体通常表达于炎性细胞、内皮细胞等表面,为G蛋白耦联受体超家族成员[10]。趋化因子与受体结合后发挥相应生物学功能,通常一种趋化因子受体能与多个不同趋化因子结合,相同趋化因子亦可能有多个特异性受体,其共同构成繁杂的网络系统,在炎症反应中发挥重要作用[11-13]。
IL-8是具有炎性活性和趋化作用的CXC亚家族成员,多种炎性细胞和上皮细胞均能分泌IL-8。CXCR1和CXCR2均为IL-8受体,IL-8与CXCR1和CXCR2可通过相互作用,参与IBD的发生、发展[14]。IL-8可通过与其受体作用,诱导中性粒细胞向病变结肠黏膜聚集,并激活中性粒细胞,刺激中性粒细胞脱颗粒以及诱导呼吸爆发,产生大量毒性物质,进一步加重肠道炎症反应和组织损伤[15-16]。研究[17]表明,CXCR1和CXCR2与IL-8结合后发挥不同作用,CXCR1能特异性结合IL-8,介导中性粒细胞趋化、磷脂酶D活化以及超氧化物产生等,在IBD中主要参与UC发病,且与UC活动性相关;CXCR2与IL-8的亲和力较低,其可与生长调节致癌基因、巨噬细胞炎性蛋白-2、中性粒细胞激活蛋白-2等结合,主要参与组织纤维化、肿瘤的发生、发展、血管形成以及其他炎症性疾病[11-12],目前关于CXCR2与IBD的研究较少。
本研究对IBD患者外周血和肠黏膜CXCR2和IL-8表达进行研究,结果显示IBD患者肠黏膜组织中CXCR2 mRNA和蛋白表达均显著上调,以UC患者为著,IL-8 mRNA表达则与健康人无明显差异,推测CXCR2上调可能参与UC发病,IL-8可能通过与肠道组织中上调的CXCR2相互作用,介导炎性细胞向肠黏膜募集和浸润,加重肠道炎症反应。此外,UC患者外周血中IL-8 mRNA呈高表达,而CD患者外周血IL-8 mRNA表达与健康人无明显差异。UC和CD虽同属于IBD,但两种疾病有各自的病理表现和病理生理特点,UC有显著数量的中性粒细胞聚集于固有层和隐窝并形成微脓肿,且病变自直肠向上弥漫性分布;CD病变部位聚集有大量巨噬细胞,常形成非干酪性肉芽肿,病变呈节段性分布[18]。IL-8是中性粒细胞趋化因子,而UC中有大量中性粒细胞聚集,此可能为IL-8在UC和CD患者中表达差异的原因之一。Rodríguez-Perlvárez等[19]和Haas等[20]的研究均发现UC患者血清IL-8水平较CD患者升高,且更具特征性,与本研究结果一致。
本研究结果显示,外周血CXCR2 mRNA在三组患者间无明显差异,而UC组和CD组肠黏膜组织CXCR2 mRNA表达水平显著高于HC组,推测体循环中的CXCR2与IL-8结合后,可能存在上调肠道组织CXCR2表达的效应。因此,拮抗或下调IBD患者肠道组织中的CXCR2表达可为IBD中UC的治疗提供新方法,并指导临床用药。
本研究中IL-8 mRNA在UC患者的外周血中表达升高,而在肠道组织中则未升高,这可能是由于IL-8是炎性因子,主要由中性粒细胞分泌,而炎性细胞以外周血中含量较高,由远处分泌等方式经体循环抵达炎症部位产生炎症反应。IBD的主要发病部位为肠道,体循环中升高的炎性因子经外周血于肠道渗出、募集炎性细胞浸润,并与受体结合后产生炎症损伤。
综上所述,UC患者外周血IL-8显著升高,结合肠道组织中CXCR2高表达,提示体循环中升高的IL-8与CXCR2结合后可能存在上调肠道组织CXCR2表达的效应。IBD患者肠道组织中CXCR2 mRNA和蛋白表达均显著上调,且以UC患者为著,推测CXCR2上调可能主要参与UC发病,下调CXCR2表达可为治疗UC提供新靶点。IBD患者肠道组织中IL-8表达未见明显改变,但CXCR2表达显著增高,推测肠道组织中的IL-8主要通过与上调的CXCR2相互作用,从而介导炎性细胞向肠黏膜募集和浸润,进一步加重肠道炎症反应。
参考文献
1 Podolsky DK. Inflammatory bowel disease[J]. N Engl J Med, 2002, 347 (6): 417-429.
2 Maloy KJ, Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease[J]. Nature, 2011, 474 (7351): 298-306.
3 Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease[J]. Nature, 2007, 448 (7152): 427-434.
4 Gologan S, Iacob R, Iancu D, et al. Inflammatory gene expression profiles in Crohn’s disease and ulcerative colitis: a comparative analysis using a reverse transcriptase multiplex ligation-dependent probe amplification protocol[J]. J Crohns Colitis, 2013, 7 (8): 622-630.
5 Walczak A, Przybylowska K, Dziki L, et al. The IL-8 and IL-13 gene polymorphisms in inflammatory bowel disease and colorectal cancer[J]. DNA Cell Biol, 2012, 31 (8): 1431-1438.
6 梁万东,李劲松,李克深,等. IL-8基因多态性与中国人群炎症性肠病风险的相关性[J]. 中华医学杂志, 2011, 91 (26): 1825-1829.
7 Russo RC, Garcia CC, Teixeira MM, et al. The CXCL8/IL-8 chemokine family and its receptors in inflammatory diseases[J]. Expert Rev Clin Immunol, 2014, 10 (5): 593-619.
8 Gijsbers K, Van Assche G, Joossens S, et al. CXCR1-binding chemokines in inflammatory bowel diseases: down-regulated IL-8/CXCL8 production by leukocytes in Crohn’s disease and selective GCP-2/CXCL6 expression in inflamed intestinal tissue[J]. Eur J Immunol, 2004, 34 (7): 1992-2000.
9 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见[J]. 中华消化杂志, 2012, 32 (12): 796-813.
10Bachelerie F, Ben-Baruch A, Burkhardt AM, et al. International Union of Basic and Clinical Pharmacology. [corrected]. LXXXIX. Update on the extended family of chemokine receptors and introducing a new nomenclature for atypical chemokine receptors[J]. Pharmacol Rev, 2013, 66 (1): 1-79.
11Guerreiro R, Santos-Costa Q, Azevedo-Pereira JM. The chemokines and their receptors: characteristics and physiological functions[J]. Acta Med Port, 2011, 24 Suppl 4: 967-976.
12Koelink PJ, Overbeek SA, Braber S, et al. Targeting chemokine receptors in chronic inflammatory diseases: an extensive review[J]. Pharmacol Ther, 2012, 133 (1): 1-18.
13Raghuwanshi SK, Su Y, Singh V, et al. The chemokine receptors CXCR1 and CXCR2 couple to distinct G protein-coupled receptor kinases to mediate and regulate leukocyte functions[J]. J Immunol, 2012, 189 (6): 2824-2832.
14Müzes G, Molnár B, Tulassay Z, et al. Changes of the cytokine profile in inflammatory bowel diseases[J]. World J Gastroenterol, 2012, 18 (41): 5848-5861.
15Pearl DS, Shah K, Whittaker MA, et al. Cytokine mucosal expression in ulcerative colitis, the relationship between cytokine release and disease activity[J]. J Crohns Colitis, 2013, 7 (6): 481-489.
16Boppana NB, Devarajan A, Gopal K, et al. Blockade of CXCR2 signalling: a potential therapeutic target for preventing neutrophil-mediated inflammatory diseases[J]. Exp Biol Med (Maywood), 2014, 239 (5): 509-518.
17Joseph PR, Sarmiento JM, Mishra AK, et al. Probing the role of CXC motif in chemokine CXCL8 for high affinity binding and activation of CXCR1 and CXCR2 receptors[J]. J Biol Chem, 2010, 285 (38): 29262-29269.
18Schmidt C, Stallmach A. Etiology and pathogenesis of inflammatory bowel disease[J]. Minerva Gastroenterol Dietol, 2005, 51 (2): 127-145.
19Rodríguez-Perálvarez ML, García-Sánchez V, Villar-Pastor CM, et al. Role of serum cytokine profile in ulcerative colitis assessment[J]. Inflamm Bowel Dis, 2012, 18 (10): 1864-1871.
20Haas SL, Abbatista M, Brade J, et al. Interleukin-18 serum levels in inflammatory bowel diseases: correlation with disease activity and inflammatory markers[J]. Swiss Med Wkly, 2009, 139 (9-10): 140-145.
(2015-08-24收稿;2015-10-31修回)
DOI:10.3969/j.issn.1008-7125.2016.06.003
*基金项目:教育部博士点基金优先发展领域项目(20130141130007)
Background: CXC chemokine receptor type 2 (CXCR2) is a member of G protein coupled receptor superfamily, and is mainly involved in the growth of tumor, angiogenesis and the pathogenesis of inflammatory diseases. Studies showed that CXCR2 was associated with the pathogenesis of inflammatory bowel disease (IBD), but the exact role has not yet been clarified. It was found that the interaction of interleukin-8 (IL-8) with CXCR1 and CXCR2 played an important role in the pathogenesis of IBD. Aims: To investigate the expressions and significance of CXCR2 and IL-8 in patients with IBD. Methods: A total of 121 IBD patients in active stage from October 2013 to December 2014 at Zhongnan Hospital of Wuhan University were enrolled and assigned into Crohn’s disease (CD) group and ulcerative colitis (UC) group. Seventy healthy subjects were served as controls (HC). Expressions of IL-8 mRNA and CXCR2 mRNA in peripheral blood and intestinal mucosal tissue were determined by real-time PCR; expression of CXCR2 protein in intestinal mucosal tissue was determined by Western blotting. Results: In peripheral blood, expression of IL-8 mRNA in UC group was significantly higher than that in HC group (P=0.017), while expressions of CXCR2 mRNA in CD, UC and HC groups were not significantly different (P=0.285). In intestinal mucosal tissue, expressions of IL-8 mRNA in CD, UC and HC groups showed no significant difference (P=0.206), while expressions of CXCR2 mRNA in CD and UC groups were significantly higher than that in HC group (P=0.002;P<0.001), and expression of CXCR2 mRNA in UC group was significantly higher than that in CD group (P=0.005); expressions of CXCR2 protein in UC and CD groups were higher than that in HC group (P=0.049;P=0.080). Conclusions: Expressions of CXCR2 mRNA and protein in intestinal mucosal tissue of patients with IBD, especially UC are significantly increased. Down regulation of CXCR2 expression in intestinal mucosa may provide a new target for treatment of UC. IL-8 is significantly highly expressed in peripheral blood of patients with UC, which suggests that IL-8 might be related mainly with UC.
Key wordsInflammatory Bowel Disease;Crohn Disease;Colitis, Ulcerative;Receptors, CXCR;
#本文通信作者,Email: wxbandzhp@163.com

