白介素-6反式信号通路抑制剂改善大鼠急性胰腺炎肺损伤
张卫中 辛栋轶 张丹婷 廖南生
白介素-6反式信号通路抑制剂改善大鼠急性胰腺炎肺损伤
张卫中辛栋轶张丹婷廖南生
318020浙江台州,台州市第一人民医院普外科
急性胰腺炎(AP)是临床常见的急腹症,约20%~30%患者可发展成为以胰腺局部坏死和脏器功能衰竭为特征的重症急性胰腺炎(SAP)。急性肺损伤(acute pancreatitis associated acute lung injury,APALI)是其最常见的并发症,患者可出现低氧血症、急性呼吸窘迫综合征等临床表现[1]。研究表明,白细胞介素6(IL-6)在APALI的发病机制中起重要作用。IL-6根据其跨膜信号传递形式不同在炎症中的作用也不同,其信号传递通路主要分为两种,即经典信号通路和反式信号通路[2]。目前众多研究集中在经典信号通路,很少涉及到IL-6反式信号通路。本研究采用人工合成的特异性抑制剂(sgp130Fc)阻断该信号通路,阐明其在大鼠APALI发病中的保护作用。
一、材料及方法
1.动物模型建立及分组:健康SD雄性大鼠72只,体重(247±35)g,由温州医科大学实验动物中心提供。按随机表法将大鼠分为假手术组、ANP组、干预组,每组24只。大鼠急性坏死性胰腺炎(ANP)模型按照本课题组建立的经胆胰管逆行注射5%牛黄胆酸钠(Sigma公司)0.1 ml/100 g体重的方法制备[3]。假手术组注射等容积生理盐水;干预组大鼠在制模前30 min腹腔注射sgp130Fc(江苏弗泰生物科技提供)100 μg/kg体重(1 mg冻干粉溶于10 ml蒸馏水)。于造模后3、12、24 h分批处死大鼠,每个时间点8只。
2.肺组织髓过氧化物酶(MPO)检测:取肺组织0.1 g,置冰生理盐水中洗净后制备组织匀浆,4℃ 2 300 r/min离心30 min,取上清液0.1 ml加0.167 mol/L邻联茴香胺二盐酸化物以及0.0005%过氧化氢混合液2.9 ml,在恒温紫外分光光度计460 nm处连续记录A460值1 min,以A460值·g-1·min-1表示MPO的活性[4]。
3.肺组织含水量测定:取相同部位的肺组织100 mg,置70℃电热干燥箱内烘烤24 h,称干重,以肺组织湿/干比重[(肺湿重-肺干重)/肺干重]表示肺组织含水量。
4.肺微血管通透性检测:造模后12 h通过左股静脉注射FITC-标记的血清蛋白5.0 mg/kg体重(Sigma Chemical公司),12 h后抽血,离心分离血清,-80℃保存;同时气管内插入18号血管导管,用4 ml磷酸盐缓冲液(PBS)灌洗肺泡腔,收集肺泡灌洗液(Balf),重复3次。用荧光分光计分别测量血清和Balf的FITC荧光,激发光494 nm,发射光520 nm。以Balf与血清FITC的荧光率比值表示肺微血管渗透性。
5.大鼠肺组织病理学检测:取剩余肺组织置液氮中保存。融化后常规行病理学检查。参考Kusske等[5]和Mayer等[6]标准进行肺脏病理评分。
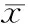
二、结果
1.肺组织MPO活性变化:假手术组大鼠肺组织MOP活性为(0.56±0.04)A460值·g-1·min-1;ANP 3、12、24 h组分别为(2.21±0.52)、(4.71±0.32)、(7.84±0.11)A460值·g-1·min-1,均显著高于假手术组,且随时间延长而增加;干预3、12、24 h组分别为(1.86±0.17)、(2.54±0.27)、(5.74±0.19)A460值·g-1·min-1,干预12、24 h组肺MOP活性均显著低于ANP同时间点组,但仍显著高于假手术组,差异均有统计学意义(P值均<0.05)。
2. 肺组织含水量的变化:假手术组大鼠肺含水量为1.57±0.14,ANP 3、12、24 h组分别为3.79±0.21、3.93±0.14、4.11±0.07,均显著高于假手术组,且随时间延长而增加;干预3、12、24 h组大鼠肺组织含水量分别为3.47±0.15、3.19±0.11、3.75±0.14,干预组12、24 h组肺含水量均显著低于ANP同时间点组,但仍显著高于假手术组,差异均有统计学意义(P值均<0.05)。
3.肺微血管通透性变化:假手术组、ANP 24 h组、干预24 h组肺微血管通透性分别为9.48±0.26、20.89±0.34、11.66±0.13,ANP组肺微血管通透性显著高于假手术组,干预组较ANP组显著减轻,但仍显著高于假手术组,差异均有统计学意义(P值均<0.01)。
4.肺组织病理学改变:假手术组肺组织无明显的病理改变;ANP组大鼠肺泡壁明显增厚、间质充血、白细胞浸润,随时间延长而加重;干预组大鼠肺组织的病理改变明显减轻(图1)。假手术组,ANP 3、12、24 h组,干预3、12、24 h组大鼠肺组织病理评分分别为(0.55±0.52)、(2.25±0.47)、(5.26±0.84)、(5.31±0.69)、(2.14±0.2)、(3.36±0.59)、(3.28±0.71)分,ANP组、干预组均显著高于假手术组,干预12、24 h组又显著低于ANP同时间点组,差异均有统计学意义(P值均<0.01)。
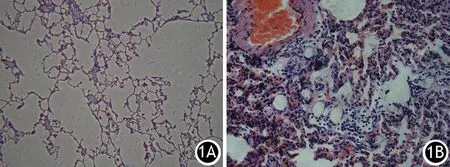

图1假手术组(1A,HE×100)、ANP组(1B,HE×200)、干预组(1C,HE×200)肺组织病理改变
讨论IL-6信号通路有两种,一是经典信号通路,该通路中IL-6与细胞膜上的IL-6受体(IL-6R)结合后经受体关联的gpl30向胞内传递次级信号,但IL-6R仅仅在肝细胞、部分上皮细胞和白细胞膜上表达。在反式信号通路上, IL-6与游离于细胞外液中的sIL-6R结合成复合体,然后再结合至膜表面的gpl30亚单位,进而完成信号传递[7-8]。因为gp130蛋白几乎在所有的细胞中表达,故该信号通路更加广泛。
gpl30为分子量130 000的糖蛋白,共有14个潜在N-糖基化位点。在生理情况下,gpl30不能直接与配基IL-6结合,当IL-6与IL-6R结合使IL-6R的构象发生变化后迅速与两个gpl30分子结合,形成高亲和力的结合位点,而可溶性gp130(sgpl30)可抑制sIL-6R/IL-6复合物的活性[8]。人工合成的sgpl30为IgG1-Fc融合蛋白的形式(sgp130Fc),具备与自然状态下sgp130相同的功能,即特异性抑制IL-6反式信号通路的发生而对经典信号通路无任何抑制作用。
IL-6在AP患者中明显升高,且与AP的严重程度密切相关,也是最早发现并确认与SAP并发肺损伤有密切关系的炎性递质[9]。炎症发生时,循环系统必须提供足够数量的sIL-6R与IL-6结合形成复合体,否则反式信号通路将无法实现。本课题组曾报道[3],ANP大鼠血sIL-6R水平显著高于假手术组,说明ANP时sIL-6R数量明显升高,可与IL-6充分结合介导反式信号通路。外源性应用sgp130Fc与sIL-6R/IL-6复合体结合后,导致sIL-6R和IL-6R数量明显下降。
本研究预先应用sgp130干预ANP大鼠,结果显示,干预后大鼠的肺组织病理学评分、MPO活性及微血管通透性均较ANP组明显改善,推测其是通过抑制IL-6反式信号通路实现的。
参考文献
[1]Malmstrom ML, Hansen MB, Andersen AM. et al. Cytokines and organ failure in acute pancreatitis: inflammatory response in acute pancreatitis[J]. Pancreas, 2012,41(2):271-277. DOI: 10.1097/MPA.0b013e3182240552.
[2]Zhang H, Neuhöfer P, Song L, et al. IL-6 trans-signaling promotes pancreatitis-associated lung injury and lethality[J]. J Clin Invest, 2013, 123(3):1019-1031. DOI: 10.1172/JCI64931.
[3]张卫中,张丹婷,辛栋轶,等. 白细胞介素-6反式信号通路促进急性胰腺炎肺损伤[J]. 中华实验外科杂志, 2015, 32(11):2895. DOI:10.3760/cma.j.issn.1001-9030.2015.11.092.
[4]红山,薛焕洲,潘承恩. p38 MAPK抑制剂对急性胰腺炎肺损伤肺内细胞间黏附分子-1表达和肺微血管通透性的影响[J].中华实验外科杂志, 2010, 27(4):471-473. DOI:10.3760/cma.j.issn.1001-9030.2010.04.025.
[5]Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J]. Surgery, 1996,120(2):284-288.
[6]Mayer JM, Laine VJO, Rau B, et al. Systemic lymphocyte activation modulates the severity of diet-induced acute pancreatitis in mice[J]. Pancreas, 1999, 19(1): 62-68.
[7]Jones SA, Scheller J, Rose-John S. Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling[J]. J Clin Invest, 2011,121(9): 3375-3383. DOI: 10.1172/JCI57158.
[8]Rose-John S. IL-6 trans-signaling via the soluble IL-6 receptor: importance for the pro-inflammatory activities of IL-6[J]. Int J Biol Sci, 2012, 8(9):1237-1247. DOI: 10.7150/ijbs.4989.
[9]Park J, Chang JH, Park SH, et al. Interleukin-6 is associated with obesity, central fat distribution, and disease severity in patients with acute pancreatitis[J]. Pancreatology, 2015, 15(1):59-63. DOI: 10.1016/j.pan.2014.11.001.
(本文编辑:吕芳萍)
DOI:10.3760/cma.j.issn.1674-1935.2016.03.014
基金项目:2014年台州市科技计划资助项目(14SF06)
通信作者:张卫中,Email:zhangweizhong11@hotmail.com
(收稿日期:2015-12-15)

