反式EPA/DHA的来源、检测技术与生理功能研究进展
曾 晶,戢颖瑞,蓝东明,杨 博,戚穗坚,王卫飞
(1.华南理工大学 食品科学与工程学院,广州 510640; 2.华南理工大学 生物科学与工程学院,广州 510006; 3.广东省农业科学院 蚕业与农产品加工研究所, 广州 510610)
反式脂肪酸一般是指化学结构上至少含有1个非共轭反式构型双键的不饱和脂肪酸,包括反式单不饱和脂肪酸和反式多不饱和脂肪酸。在食品中最常见的反式脂肪酸是反式油酸,主要来源于天然动植物油脂的氢化加工过程。研究发现,动植物油脂中的不饱和脂肪酸,如油酸、亚油酸、亚麻酸等,由于热稳定性差,在热加工过程中易形成反式异构体[1- 2]。这些具有反式双键的脂肪酸与其顺式结构相比,在人和动物体内的生理功能和代谢过程有显著的差异[3-4]。
长链ω-3多不饱和脂肪酸(ω-3PUFA)特别是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)具有防治心脑血管疾病、促进脑组织及视网膜的正常生长发育等生理作用,是维持人体健康的重要脂肪酸[5-8]。EPA和DHA是天然脂肪酸,主要来源于海洋鱼油和部分藻类油脂。从天然动植物原料中提取得到富含EPA、DHA的油脂后,需要加工处理才能作为食品、保健品或医药品的原材料使用。与油酸和亚油酸相比,EPA和DHA分子中的双键数目更多,在精炼加工或其他处理工艺中更容易发生反式异构化[9]。
由于EPA和DHA在人和动物的生长发育、维持生理健康等方面具有重要的功能,人们对反式EPA/DHA越来越关注。本文对反式EPA/DHA的来源、检测技术与生理功能进行了综述分析,以期为EPA和DHA等长链多不饱和脂肪酸的深加工技术提供科学依据。
1 反式EPA/DHA的来源
反式长链多不饱和脂肪酸产生的途径有生物转化、化学催化剂(对甲苯磺酸)催化异构化和高温处理等[10]。
根据产生途径,可将反式EPA/DHA来源分为两类:一类为天然存在的,其产生途径是由生物体中的亚麻酸反式异构体在特殊酶的作用下生物转化。天然存在的反式EPA/DHA很少,一般分布在动物体内以及一些微藻的体内;另一类是加工过程中产生的,加工过程中的催化剂和高温会促使EPA和DHA发生反式异构化,特别是油脂精炼加工(脱臭)、油脂使用过程中(煎炸、烹饪等)高温处理环节会产生反式EPA/DHA,这是反式EPA/DHA的主要来源。
1.1 反式EPA/DHA的天然来源
自然界中存在微量的反式EPA/DHA,在生物体内反式EPA/DHA由亚麻酸反式异构体在特殊酶的作用下经延长、去饱和转化而来。研究发现,9cis, 12cis, 15trans亚麻酸会在生物体内转化为5cis, 8cis, 11cis,14cis, 17transEPA[11]。Chardigny等[11]在大鼠的肝脏中检测到11transEPA和11trans,17transEPA两种反式EPA异构体,研究发现这两种异构体分别由9trans,12cis,15cis和9trans,12cis,15trans亚麻酸转化而来,这两种亚麻酸反式异构体是精炼油脂和煎炸油脂中常见的反式脂肪酸。据报道,在大鼠的许多组织中,反式亚麻酸会被延长、去饱和。用热处理后的亚麻籽油(富含反式亚麻酸)喂养大鼠8周后,在大鼠视网膜和肝脏中均发现了EPA和DHA的反式异构体。与血液、视网膜和肝脏中的情况相反,动物实验表明,脑组织中不能积累反式DHA[12]。Ferreri等[13]首次证实了大鼠摄入含有一个反式双键的EPA异构体后,反式EPA结合在肝脏的线粒体膜上。在人体内,反式EPA/DHA主要分布于肝脏、血液及体脂肪中,但含量均很低。Chardigny等[14]对人体血小板脂肪酸中的EPA、DHA进行了研究,在大部分样品中均检测到17transEPA(约为总脂肪酸的0.48%),在一些样本中还有19transDHA(最大含量约为总脂肪酸的0.05%)。
此外,一些海洋生物中也含有不常见的反式长链脂肪酸,如Marty等[15]在扇贝中检测到其特有脂肪酸——4cis,7cis,10cis,13transC22∶4。海洋微藻类微生物体内也含有ω-3系列的transPUFA,如Chang等[16]在海洋半角藻属圆形伊曼托尼亚菌株发现了在ω-3位置具有单个反式双键的C18~C22 反式ω-3多不饱和脂肪酸。这些反式ω-3多不饱和脂肪酸的种类及含量分别为9cis,12cis,15transC18∶3(0.2%~1.8%)、6cis,9cis,12cis,15transC18∶4(1.9%~4.1%)、3cis,6cis,9cis,12cis,15transC18∶5(0.7%~8.8%)、5cis,8cis,11cis,14cis,17transC20∶5(1.2%~4.1%)以及4cis,7cis,10cis,13cis,16cis,19transC22∶6(0.3%~4.3%)。
1.2 反式EPA/DHA的加工来源
油脂加工过程产生反式脂肪酸的原理是在高温或者催化剂的作用下,脂肪酸链中的分子发生化学键旋转,从而生成反式异构体。温度和催化剂是脂肪酸分子双键发生顺反异构化的限制性因素。在常温且没有催化剂的条件下,顺式的不饱和脂肪酸几乎不发生异构化反应;但当温度超过一定值时,不饱和脂肪酸的异构化反应在不借助任何催化剂的情况下也很容易进行,从而生成反式脂肪酸异构体[17-18]。相对于油脂部分氢化产生的反式脂肪酸而言,经过高温精炼工艺的动植物油脂中反式脂肪酸的组成要简单得多,因为油脂在高温下仅发生顺反异构,不发生位置异构[19]。催化剂一般应用于油脂氢化过程,鱼油精炼加工过程中很少或不用催化剂,而温度贯穿于油脂精炼脱臭以及后期使用(煎炸、烹饪)全过程。研究发现,海洋鱼油深加工过程中分子蒸馏和脱臭处理温度过高时,会导致EPA和DHA反式异构体的产生,这是反式EPA/DHA的主要来源。温度是鱼油加工、使用过程中产生反式EPA/DHA的主要因素。因此,引起EPA、DHA反式异构化的温度阈值成为海洋鱼油加工工艺研究中的重要内容。
Wijesundera等[20]将EPA乙酯或EPA装在10 mL具塞离心管中,在常压状态下置于220℃的硅油浴中加热5 h后发现产生EPA反式异构体,但双键的位置不会发生变化。Fournier等[21]在180℃脱臭处理半精炼鱼油3 h,发现EPA、DHA仅有微弱的反式异构化反应发生;当脱臭温度为220℃和250℃时,反式EPA和反式DHA含量分别达到4.2%和7.6%;但是,即使脱臭温度在250℃以上时,主要的反式异构体也只含有1个或2个反式双键。Fournier等[22]分别在180、220℃和250℃下脱臭处理半精炼鱼油时,发现由高温(热)引起的EPA、DHA反式异构化过程是一个定向的异构化反应,脂肪酸链上某些位置的双键更容易发生异构化,如ω-3长链多不饱和脂肪酸比ω-6长链多不饱和脂肪酸更容易发生反式异构化。Mjøs等[23]在常压、140~240℃下热处理浓缩鱼油乙酯2~8 h,发现在180℃以上时加热EPA、DHA 2 h以上有明显的反式异构化;相比已报道的亚油酸和亚麻酸,所有顺式异构体的异构化速率常数(k)更大,而且lnk和热处理温度(热力学温度)的倒数呈线性关系。另外,在煎炸和烧烤鱼油类食品时,也可能会产生反式EPA/DHA。Sebedio等[24]在利用菜籽油煎炸的鲭鱼的脂肪中检测到了5cis,8trans,11cis,14trans, 17cisC20∶5,其含量低于总EPA的0.1%。
海洋鱼油深加工后一般作为食品和医药保健品原料进行使用,在加工过程中产生的长链多不饱和脂肪酸的反式异构体也随之进入食品或医药保健品中。Sciotto等[25]收集了欧洲市场上77种ω-3产品,并对其中的反式EPA/DHA含量进行了分析。结果显示,单反式EPA占全顺式EPA的0.19%~4.51%,单反式DHA占全顺式DHA的0.25%~5.89%;在所收集到的样品中,EPA的异构体和DHA的异构体具有显著的对应关系,一般反式DHA与顺式DHA的比例是反式EPA与顺式EPA比例的1.26倍;对样本进行分类分析发现,产品的脱臭处理是产生反式异构体的主要原因,而且反式异构化可以在加工中避免(见表1)。Menounou等[26]收集了意大利和西班牙共19份含有DHA补充剂的胶囊,对其中的反式DHA进行了测定,发现单反式DHA含量为0.11%~2.70%, DHA含量较高的产品中单反式DHA含量也较高,不同碳位上的单反式DHA也有差异性,4transC22∶6ω-3的含量总体最低(见表2)。

表1 欧州市场ω-3产品反式EPA/DHA的含量[25]
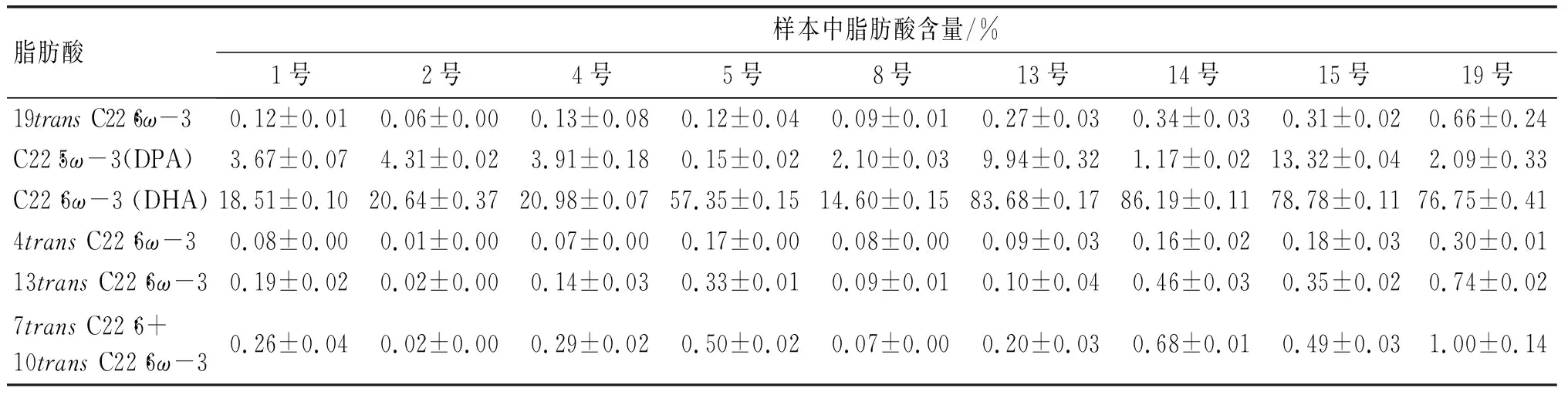
表2 意大利和西班牙市场DHA补充剂中反式DHA含量调查情况[26]
2 反式EPA/DHA的检测技术
目前,关于反式长链多不饱和脂肪酸检测技术的报道不多,基本还处于探索阶段。反式异构体的数量遵照2n原则,其中n为双键数目。由于双键数目较多,EPA和DHA的反式异构体的种类较多,难以对每个异构体进行分离,现阶段的检测技术也只能确定单反式和双反式异构体的反式双键数量以及位置,难以对所有的反式异构体进行分离鉴别,反式EPA/DHA的检测技术还有待进一步发展。
色谱法是检测顺/反脂肪酸的常见方法,检测反式EPA/DHA关键在于将顺式和反式EPA/DHA分离。但由于EPA和DHA脂肪酸链长度和双键数目的特殊性,利用常规的色谱分离方法难以将反式异构体分离。为了更好地分离EPA和DHA反式异构体,准确地测定反式异构体含量,还需要辅以银离子色谱等分离技术。一般的处理方法是先用色谱分离纯化EPA和DHA脂肪酸甲酯,再利用银离子色谱将EPA、DHA反式异构体分开,最后进行定量分析。为了确保气相色谱分离效果,一般采用强极性色谱柱(如CP-Sil 88,SP-2560,BPX-70),再使用氢火焰离子化检测器或质谱检测器对反式EPA/DHA进行检测,由于缺少反式EPA/DHA的标准品, 其定量方法大多采用面积归一化法,误差较大。
Fournier等[21]将热处理后的鱼油甲酯化,利用反相液相色谱(RP-HPLC)分离纯化得到EPA、DHA甲酯,然后利用银离子液相色谱和银离子薄层色谱分离EPA、DHA的反式异构体,最后利用气相色谱对得到的异构体进行定量和定性分析。在优化的操作流程和分析条件下,可以对EPA及其反式异构体进行定性分析。由于全顺式的DHA和单反式双键的DHA异构体在银离子液相色谱分离时有共洗脱现象,该方法还不能用于DHA及其反式异构体的定量检测。实验表明,对半精炼海洋鱼油进行高温处理(250℃,3 h)后,得到的EPA、DHA异构体中,仅检测到含有1、2个反式双键的EPA异构体和含有1、2、3个反式双键的DHA异构体;而且11transEPA和14transEPA是其主要的单反式双键异构体,这可能是由于EPA的ω-9位双键处在碳链的中间位置,更易于发生反式异构化,相应地在DHA分子中,其ω-9、12位的双键更易于反式异构化。Mjøs等[27]利用银离子液相色谱分离纯化EPA和DHA甲酯的反式异构体,并进行了气相色谱分析,得到分别含有1、2、3、4、5个反式双键的反式异构体。EPA的主要异构体为含有1个和2个反式双键的反式EPA,DHA的主要异构体为含有1、2、3个反式双键的DHA。
为了建立更为便捷的反式EPA/DHA检测方法,Mjøs等[23]在常压下热处理浓缩EPA、DHA乙酯,不经分离纯化直接利用GC-MS分析含有单反式双键的EPA、DHA异构体的含量,发现含有单反式双键的EPA、DHA异构体的含量和全顺式异构体的变化量呈线性关系,可以用来预测反式异构体的总量。气相色谱分离和检测反式脂肪酸时一般采用强极性色谱柱,最常用的是以羟甲基聚硅氧烷为固定液的毛细管色谱柱。Sciotto等[25]将其在欧洲市场上收集的ω-3产品甲酯化后,利用BPX-70色谱柱直接测定反式EPA、DHA含量,发现单反式EPA占全顺式EPA的0.19%~4.51%,单反式DHA占全顺式DHA的0.25%~5.89%。Fournier等[28]利用CP-Sil 88气相色谱柱测定热处理后半精炼金枪鱼油中反式EPA、DHA的含量,发现直接检测法(不经过银离子色谱分离)适用于反式异构体含量较少的EPA、DHA样品,EPA和DHA反式异构体的定量限分别为0.16 g/100 g和0.56 g/100 g,而且该方法具有良好的准确度和稳定性。
由于缺少反式EPA和DHA的标准品,反式EPA/DHA的反式双键数目还无法确定,但可以通过核磁共振技术鉴别出反式双键的位置[29-30]。鉴别反式双键位置的方法是先建立EPA/DHA单反式异构体的脂质库,单反式异构体的合成有两种方法:一是顺式EPA/DHA甲酯直接噻吩基自由基催化异构化;二是顺式EPA/DHA甲酯通过单环氧化物作为中间体,然后消除双键位置两步合成反式异构体[26]。第二种为常见构建单反式EPA/DHA标准品方法,该方法全程通过二维核磁共振波谱进行扫描,由于烯烃的顺反异构体的耦合常数存在差异,双键 消除的位点即可确定为反式双键的位置。Menounou等[26]对从意大利和西班牙收集的19份含有DHA补充剂的软胶囊甲酯化后,利用DB23气相色谱柱直接测定顺、反式脂肪酸含量,发现单反式DHA含量为0.11%~2.70%,DHA含量较高的产品中单反式DHA含量也较高;然后利用13C NMR确定反式烯烃的位置,发现单反式DHA的反式烯烃的位置分别在4, 13,19碳位上。反式EPA/DHA检测方法见表3。

表3 反式EPA/DHA检测方法

3 反式EPA和DHA生理功能
反式脂肪酸对生物体的有益或有害的生理功能取决于反式脂肪酸在生物体内的代谢特征。反式脂肪酸在动物体内的代谢特征与顺式脂肪酸有明显的不同,由于反式脂肪酸(油酸)对肝脏中的n-6脱氢酶的活性具有抑制作用,食用反式脂肪酸(油酸)可以使得动物体内亚油酸含量升高,花生四烯酸(AA)和DHA含量降低[36]。在动物体内含有反式双键的亚麻酸可以通过碳链延长和脱氢产生带有反式双键的EPA、DHA异构体。
有一个常见的具有误导性的假设是,所有的反式脂肪酸都有相似的代谢和影响。然而,反式脂肪酸的生物活性还与脂肪酸碳链长度、双键数目以及反式双键位点有关。反式EPA/DHA脂肪酸碳链更长、双键数目更多以及反式双键位点多样,以致于其生理功能与十八碳反式脂肪酸截然不同。研究表明,反式油酸、反式亚油酸等会增加心血管疾病风险,危害人体健康。而动物实验表明,反式EPA/DHA具有抗炎、抗肿瘤以及调节脂质代谢等生理功能。
Loï等[37]考察了11transEPA、17transEPA和11trans, 17transEPA 3种反式EPA异构体对大鼠血小板聚集和AA氧化作用的影响,结果发现:11transEPA和11trans, 17transEPA的抗凝聚效果是全顺式EPA的2倍,3种反式EPA异构体均可以抑制环氧合酶代谢产物的生成;进一步的研究表明11trans的双键可能是引起反式EPA异构体和全顺式EPA分子具有不同生理功能的原因。Zaima等[38]研究发现,反式EPA几何异构体可以通过抑制SREBP-1c和PGC-1b减少LXRa诱导的细胞三酰甘油,从而调节血脂水平。EPA的反式异构体增加了EPA对脂肪生成基因表达的有利作用,在体内反式EPA比顺式EPA更能降低血脂浓度。Okada等[4]研究发现,喂养反式DHA的实验组大鼠,其血浆总脂质水平(191 mg/dL)、总胆固醇水平(48.2 mg/dL)显著低于喂食大豆油的对照组(286、68.0 mg/dL),喂养反式EPA的实验组大鼠血浆总脂质水平(233 mg/dL)、总胆固醇水平(53.7 mg/dL)显著低于喂食大豆油的对照组(286、68.0 mg/dL)。反式EPA/DHA可改变大鼠血浆脂质组成,促进大鼠脂质代谢。Zheng等[39]发现南极磷虾反式EPA/DHA对MCF-72等7种不同类型肿瘤细胞具有生长抑制活性,且其抑制活性比来自市售鱼油、阿穆尔鱼肝油及标准品的3种顺式EPA/DHA高3~7倍。
4 展 望
脂肪酸组成和性质对于油脂的理化性质和生理功能具有重要意义,EPA和DHA是最重要的两种长链多不饱和脂肪酸,对人体生长发育、维持健康具有重要的作用。从总体上看,顺式EPA/DHA的研究已较为深入,但反式EPA/DHA的研究还处于起始阶段。首先,通用的检测与定性定量分析方法尚未建立。EPA和DHA中的双键数目较多,难以区分开是哪个位置上的双键反式异构体;同时,由于缺少反式EPA和DHA的标准品,难以对其进行准确的定量分析。其次,关于长链反式多不饱和脂肪酸生理功能的基础研究较少。研究发现,反式EPA/DHA具有与反式油酸、反式亚油酸等十八碳反式脂肪酸不同的生物活性,现有研究表明反式EPA/DHA在抗炎、促进脂质代谢以及抗肿瘤方面具有广泛的应用前景。反式EPA/DHA与顺式EPA/DHA在生理功能上有相似性,甚至反式EPA/DHA的生理功效更佳,但目前的相关实验数据支持不够充分,需要进行大量的动物实验研究,以及更加广泛和深入的探索。

