胎盘生长因子基因沉默对胰腺癌PANC1细胞迁移和侵袭的影响
刘建化 马冬 陈少杰 练国达 李佳佳 黄开红
·论著·
胎盘生长因子基因沉默对胰腺癌PANC1细胞迁移和侵袭的影响
刘建化马冬陈少杰练国达李佳佳黄开红
510180广州,广东省医学科学院广东省人民医院胃肠肿瘤内科
【摘要】目的探讨胎盘生长因子(PIGF)基因沉默对人胰腺癌PANC1细胞迁移、侵袭能力及化疗药物耐药性的影响。方法设计并合成3个靶向PIGF的siRNA(siRNA-PIGF),以非特异性的siRNA(siRNA-NC)作为转染的阴性对照,以未转染细胞作为空白对照。采用脂质体法将siRNA转染PANC1细胞,分别采用实时RT-PCR和ELISA法检测各组细胞PIGF mRNA及蛋白表达抑制率;MTT法检测化疗药物处理对各组细胞的生长抑制率;Transwell小室检测细胞的侵袭和迁移能力。结果转染3个siRNA-PIGF的PANC1细胞PIGF mRNA表达抑制率分别为(64.38±8.92)%、(70.48±7.72)%、(81.25±6.02)%,以转染siRNA-PIGF-3的基因沉默效应最佳。转染24 h后,siRNA-PIGF组细胞PIGF mRNA表达量较siRNA-NC组下降(63.72±8.20)%,较未转染组下降(75.07±8.25)%,差异均有统计学意义(P值均<0.05);转染48 h后,培养上清液PIGF蛋白含量较siRNA-NC组下降(42.92±1.34)%,较未转染组下降(46.25±3.64)%,差异均有统计学意义(P值均<0.01),而未转染组和siRNA-NC组间的差异无统计学意义。3 ng/L吉西他滨处理后,siRNA-PIGF组细胞的生长抑制率显著高于siRNA-NC组及未转染组[(44.35±5.05)%比(34.29±3.60)%、(31.01±1.08)%],差异均有统计学意义(P值均<0.05),而5-氟尿嘧啶或阿霉素处理后3组的生长抑制率差异无统计学意义。在细胞迁移和侵袭实验中,siRNA-PIGF组穿膜细胞数分别为siRNA-NC组的38.1%、28.2%,为未转染组的40.8%、36.2%,差异均有统计学意义(P值均<0.05)。结论PIGF 基因沉默能显著抑制胰腺癌PANC1细胞的迁移与侵袭能力,能增强对化疗药物吉西他滨的敏感性。
【关键词】胰腺肿瘤;RNA,小分子干扰;胎盘生长因子;肿瘤浸润
Fund program: Science and Technology Commission Foundation of Guangdong Province(2013B021800233)
胰腺癌确诊时多属晚期,失去手术机会,且对化疗不敏感,预后差[1-2]。影响胰腺癌预后的诸多因素中,除了理化环境、诊治方法、分子生物学特征等,恶性肿瘤对周围组织的浸润和器官的转移与预后也密切相关[3-4]。因此,深入探讨胰腺癌侵袭与迁移的分子机制对提高胰腺癌疗效具有重要理论意义和临床指导价值。胎盘生长因子(placental growth factor,PIGF)是血管内皮生长因子(vascular endothelial growth factor,VEGF)家族重要成员,作为调控血管生长的重要因子,能促进新生血管形成,同时对巨噬细胞也有趋化、聚集作用[5]。它在多种恶性肿瘤的生长、侵袭、血管生成和免疫逃避中扮演重要的角色[6],并与肿瘤放化疗敏感性降低有关,是抗肿瘤治疗的靶点之一。有研究表明[7],下调PIGF表达能抑制肿瘤生长及促进肿瘤血管正常化。目前关于PlGF 在胰腺癌发生和发展中的作用报道较少,本研究观察PIGF基因沉默后对人胰腺癌PANC1细胞、迁移、侵袭、耐药性等生物学行为的影响。
材料和方法
一、材料与试剂
人胰腺癌细胞株PANC1(K-ras突变型)购自上海生物化学与细胞研究所;胎牛血清、DMEM培养基、胰蛋白酶、PBS缓冲液、Trizol、Lipofectamin2000购自美国Invitrogen公司;抗人PIGF ELISA试剂盒、Matrigel基底膜购自美国BD公司;逆转录酶M-MLV、RNA酶抑制剂(RNasin)购自Promega公司;Taq酶、dNTP、SYBR Green购自TaKaRa公司;PCR引物采用Primer Priemer 6.0软件设计,由上海生工生物工程公司合成;MTT购自Sigma公司;8μm微孔Transwell小室购自Corning公司。
二、siRNA设计、合成
根据siRNA的设计原则和PIGF基因序列,设计3对靶向PIGF基因的特异性siRNA序列。siRNA-PIGF-1序列为5′-AATTCAAAAAACGAACGTACTTGCAGATGTCTCTTGAACATCTGCAAGTACGT-TCG-3′;siRNA-PIGF-2序列为5′-AATTCAAAAAGATCCGCAGACGTGTAAATTCTCTTGAAATTTACA-CGTCTGCGGAT-3′;siRNA-PIGF-3序列为5′-AATTCAAAAAGGCAGAATCATCACGAAGTTCTCTTGAA-ACTTCGTGATGATTCTGC-3′。同时设计不针对任何靶基因的非特异性阴性对照siRNA(siRNA-NC),序列为5′-UUCUCACCGCGAAUGUCGUTT-3′。siRNA由上海吉凯基因公司采用化学合成法合成。
三、siRNA转染
PANC1细胞复苏后常规培养、传代。取对数生长期细胞接种到6孔板,每孔6.0×105个细胞,培养到第2天待细胞60%融合时应用脂质体方法将各siRNA分别转染PANC1细胞,按Lipofectamine 2000试剂盒说明书操作,以未转染细胞作为对照组。转染后4 h更换培养液继续培养24 h后收集细胞,转染48 h后收集细胞培养上清液。实验重复5次。
四、实时RT-PCR
取上述转染24 h的各组PANC1细胞,采用Trizol提取总RNA,紫外分光光度仪测定RNA浓度和纯度后,以总RNA为模板,采用SYBR Green染料法在罗氏荧光PCR仪进行荧光实时RT-PCR扩增。PIGF正义引物5′-ACGTGGAGCTGACGTTCTCT-3′,反义引物5′-CAGCAGGAGTCAC TGAAGAG-3′,扩增产物248 bp;以GAPDH为内参,GAPDH正义引物5′-AGGTCGGAGTCAACGGATTTG-3′,反义引物5′-GTGATGGCATGGACTGTGGT-3′, 扩增产物150 bp。PCR反应条件:95℃ 5 min,95℃ 1 min、55℃ 35 s,45个循环。扩增完毕进行熔解曲线分析,PIGF mRNA相对表达量用公式2-△△Ct计算, PIGF mRNA表达抑制率=(对照组PIGF mRNA表达量-转染组PIGF mRNA表达量)/ 对照组PIGF mRNA表达量×100%。筛选PIGF基因沉默效应最佳的siRNA-PIGF。
取沉默效应最佳的siRNA-PIGF、siRNA-NC转染6、24 h后的PANC1细胞,另取未转染的PANC1细胞作为对照组,检测各组细胞的PIGF mRNA表达,方法同上。以对照组的mRNA表达量为1,计算转染组细胞的mRNA表达抑制率。
五、酶联免疫吸附试验(ELISA)
取上述3组培养48 h的培养上清液,加入包被特异性抗体的96孔板,每孔100 μl,设4个复孔。应用ELASA法检测上清液中PIGF蛋白含量,按试剂盒说明书操作。依据标准品检测结果绘制标准曲线,通过标准曲线的方程式计算待测标本的PIGF蛋白浓度。实验重复3次,取均值。
六、MTT法
取上述3组培养24 h的对数生长期细胞,以5×103/孔的密度接种于96孔培养板,分别加入0.03、0.3、3 ng/L的吉西他滨(Gem),0.3、3、30 ng/L的5-氟尿嘧啶(5-FU),0.04、0.4、4 ng/L的阿霉素(ADM)继续培养48 h,每组每个药物浓度设5个复孔。培养到时间点后,每孔加5 mg/ml的MTT 20 μl继续培养4 h,上酶标仪测定570 nm波长处各孔的吸光度值(A570值),以未加药物处理细胞作为对照组,以空白孔调零。药物对细胞生长的相对抑制率=(1-实验组A570值/对照组A570值)×100%。
七、细胞迁移实验
收集转染48 h的细胞,PBS清洗后重悬于含10% FBS的DMEM培养液。取100 μl(2×105个)细胞悬液加入Transwell小室的上室,下室加500 μl 20% FBS的DMEM培养液,于37℃平衡1 h后置 37℃、5% CO2培养24 h。取出Transwell小室,用棉棒擦净未穿透滤膜的细胞,PBS冲洗后甲醛固定,Giemsa染色,显微镜下随机取10个400倍视野,计算穿膜细胞数。实验重复3次,取均值。
八、细胞侵袭实验
将Matrigel按50 μl/cm2比例加到Transwell小室聚碳脂膜的上表面,37℃孵箱过夜待其凝固,其他步骤同细胞迁移实验。实验重复3次,取均值。
九、统计学处理
结果
一、PIGF基因沉默效应的筛选
转染3个siRNA-PIGF的PANC1细胞PIGF mRNA表达抑制率分别为(64.38±8.92)%、(70.48±7.72)%、(81.25±6.02)%,转染siRNA-PIGF-3的基因沉默效应最佳,因此选取siRNA-PIGF-3进行后续实验。
二、细胞PIGF mRNA及蛋白表达抑制率
转染6 h后,siRNA-PIGF组、siRNA-NC组、未转染组的PIGF mRNA表达量分别为(85.84±4.21)%、(98.32±3.56)%、100%;培养24 h后的表达量分别为(24.93±15.63)%、(88.64±7.65)%、100%。siRNA-PIGF组细胞PIGF mRNA水平在转染6 h开始下降,24 h后较siRNA-NC组下降(63.72±8.20)%,较未转染组下降(75.07±8.25)%,差异均有统计学意义(t值分别为4.792、8.319,P值均<0.05),而未转染组和siRNA-NC组间的差异无统计学意义。
转染48 h后,siRNA-PIGF组细胞培养上清液PIGF蛋白含量较siRNA-NC组下降(42.92±1.34)%,较未转染组下降(46.25±3.64)%,差异均有统计学意义(t值分别为4.602、6.853,P值均<0.01),而未转染组和siRNA-NC组间的差异无统计学意义。
三、PIGF基因沉默对化疗药物敏感性的影响
吉西他滨处理后,siRNA-PIGF组细胞的生长抑制率显著高于siRNA-NC组及未转染组,差异均有统计学意义(F=2.31,P<0.05),而5-氟尿嘧啶处理后虽然有抑制趋势,但差异无统计学意义,而阿霉素处理后3组的生长抑制率差异无统计学意义(表1)。提示抑制PIGF表达可增强PANC1细胞对吉西他滨的敏感性。
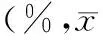
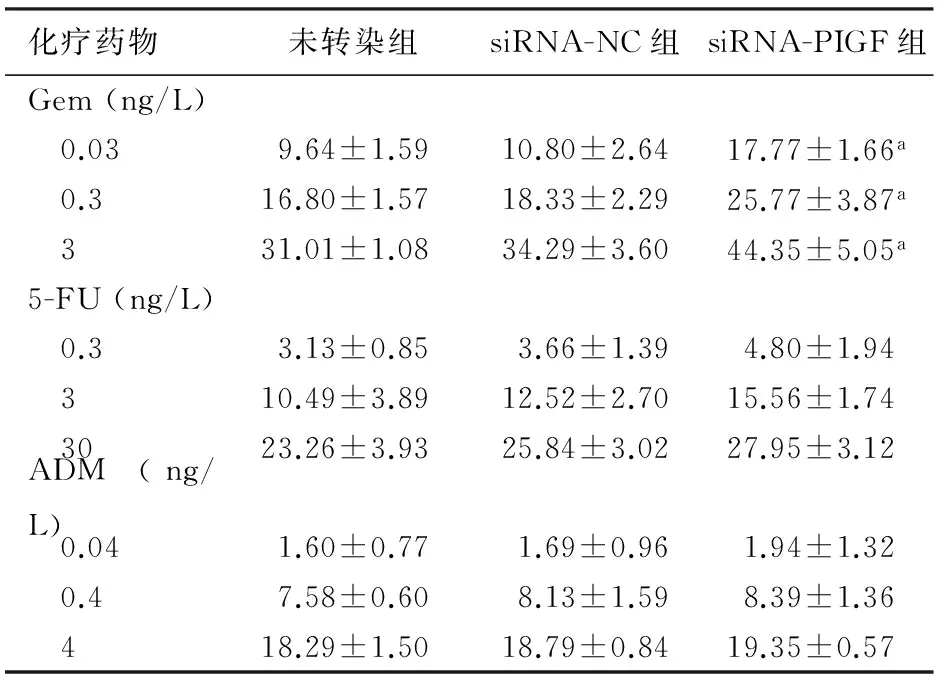
化疗药物未转染组siRNA-NC组siRNA-PIGF组Gem(ng/L) 0.039.64±1.5910.80±2.6417.77±1.66a 0.316.80±1.5718.33±2.2925.77±3.87a 331.01±1.0834.29±3.6044.35±5.05a5-FU(ng/L) 0.33.13±0.853.66±1.394.80±1.94 310.49±3.8912.52±2.7015.56±1.74 3023.26±3.9325.84±3.0227.95±3.12ADM(ng/L) 0.041.60±0.771.69±0.961.94±1.32 0.47.58±0.608.13±1.598.39±1.36 418.29±1.5018.79±0.8419.35±0.57
注:与未转染组及siRNA-NC组比较,aP<0.05
四、细胞迁移和侵袭能力变化
迁移实验中siRNA-PIGF组的穿膜细胞数分别为siRNA-NC组、未转染组的38.1%、40.8%(F=3.51,P<0.05,图1);侵袭实验中siRNA-PIGF组的穿膜细胞数分别为siRNA-NC组、未转染组的28.2%、36.2%,差异均有统计学意义(F=4.37,P<0.05,图1)。提示PIGF均可显著抑制PANC1细胞的迁移和侵袭。
讨论
胰腺癌是严重危及人类健康的重大疾病,由于缺乏早期特异性临床症状,且无有效临床治疗手段,特别是针对胰腺癌的传统放化疗疗效并不理想,严重影响胰腺癌预后。恶性肿瘤发展和转移是一个多阶段、多步骤、多因素参与的极其复杂的过程。Liotta等[8]曾在1991年提出肿瘤转移“三步学说”:肿瘤细胞与细胞外基质成分黏附,肿瘤细胞释放或诱导释放蛋白水解酶降解细胞外基质,降解区域肿瘤细胞在趋化因子引导下迁移。随着对肿瘤发生机制的深入研究,寻找胰腺癌浸润转移过程中起关键性作用相关基因及基因治疗已日益成为人们关注焦点,也是人类攻克恶性肿瘤的关键和希望所在[9]。
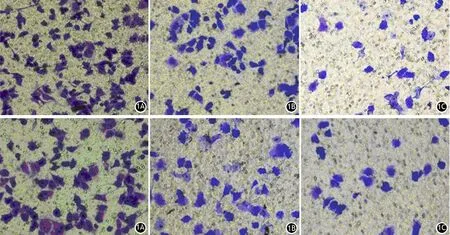
图1 未转染组(1A)、siRNA-NC组(1B)、siRNA-PIGF组(1C)PANC1细胞迁移(上)和侵袭(下)能力
PIGF是一种分泌型同源二聚体糖蛋白,通常在滋养层、正常甲状腺以及伤口愈合期间高表达,促进细胞分化、成熟。PIGF高表达最早于肾细胞癌血管中检出,随后的研究证实[5,10],PIGF在胃癌、结直肠癌、非小细胞肺癌、乳腺癌等多种恶性肿瘤过度表达,且表达与肿瘤微血管密度成正比。
PIGF既可刺激血管源细胞形成新血管,还可刺激肿瘤相关巨噬细胞分泌血管生成因子(如VEGF、bFGF等)及金属蛋白酶(MMP-9、MMP-2),分解肿瘤间质,促进肿瘤新生血管的生成。同时PIGF也可直接作用于癌细胞,损伤树突细胞,促进肿瘤生长,并刺激骨髓中血管生成祖细胞向肿瘤病灶转移[10]。此外,PIGF还诱导肿瘤相关性炎症,激活炎症因子和肿瘤相关因子,介导不同的信号转导通路调控基因表达,为肿瘤生长、转移提供微环境基础,同时降解抑癌基因,从而使PIGF在肿瘤生长、血管生成、肿瘤侵袭转移过程中发挥重要作用。Taylor等[11]研究发现,PIGF通过ERK通路和细胞骨架的重新整合来促进乳腺癌细胞迁移和侵袭。Alpini等[12]构建的肝癌实验模型也提示PlGF过度表达能够促进肿瘤生长。在直肠癌的相关研究中进一步证实,PIGF表达与患者生存期呈负相关[13]。Rahbari等[14]报道,正常胰腺导管、腺体不表达PIGF mRNA和蛋白,仅在胰腺癌组织中表达,且表达程度强的胰腺癌细胞具有更强的侵袭性。
作为一种新兴的基因治疗技术,RNA干扰能够高效、特异地调节和关闭基因表达,从而调控细胞各种高级生命活动。siRNA是RNA干扰技术重要的中间效应分子,是研究基因功能和疾病治疗的重要手段。本研究结果显示,与未转染组和siRNA-NC组比较,siRNA-PIGF组PANC1细胞的PIGF mRNA及蛋白表达显著被抑制,迁移和侵袭能力显著被削弱,但对化疗药物吉西他滨的敏感性显著增强,提示沉默PIGF表达有可能成为胰腺癌靶向治疗的潜在新靶点。
参考文献
[1]Seufferlein T, Bachet JB, Van Cutsem E, et al. Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(suppl 7):33-40. DOI:10.1093/annonc/mds224.
[2]杨尹默.胰腺癌外科治疗的热点与难点[J].中华消化外科杂志,2015,14(8):612-614.DOI:10.3760/cma.j.issn.1673-9752.2015.08.004.
[3]李学彦,郭晓钟,李宏宇,等.胰腺癌198例临床诊治分析[J].中华胰腺病杂志,2015,15(2):120-122. DOI:10.3760/cma.j.issn.1674-1935.2015.02.014.
[4]罗国培,倪泉兴,虞先濬.胰腺癌中淋巴结转移率的临床应用价值[J].中华消化外科杂志,2015,14(8):686-688.DOI:10.3760/cma.j.issn.1673-9752.2015.08.020.
[5]闫鹏飞, 刘煜. 胎盘生长因子的生物活性及其与肿瘤相关作用研究进展[J]. 药物生物技术, 2012, 19(3):265-269.
[6]Tugues S, Honjo S, König C, et al. Genetic deficiency in plasma protein HRG enhances tumor growth and metastasis by exacerbating immune escape and vessel abnormalization[J]. Cancer Res, 2012, 72(8):1953-1963. DOI:10.1158/0008-5472.CAN-11-2194.
[7]Solinas G, Schiarea S, Liguori M, et al. Tumor-conditioned macrophages secrete migration-stimulating factor: a new marker for M2-polarization, influencing tumor cell motility[J]. J Immunol, 2010, 185(1):642-652. DOI:10.4049/jimmunol.1000413.
[8]Liotta LA, Stetler-Stevenson WG. Tumor invasion and metastasis: an imbalance of positive and negative regulation[J]. Cancer Res, 1991, 51(suppl 18):5054s-5059s.
[9]李佳佳, 陈茵婷, 曾林涓, 等. 免疫纳米微粒靶向胰腺癌细胞输送siRNA的方法研究[J]. 中国病理生理杂志, 2014, 30(9):1567-1573.DOI:10.3969/j.issn.1000-4718.2004.09.005.
[10]罗金龙, 姜淮芜. 胎盘生长因子与肿瘤的研究进展[J]. 中国普外基础与临床杂志, 2014, 21(8):1046-1050.
[11]Taylor AP,Leonand E,Goldenberg DM. Placental growth factor (PIGF) enhances breast cancer cell motilityby mobilising ERK1/2 phosphorylation and cytoskeletal rearrangement[J]. Brit J Cancer, 2010, 103(1):82-89. DOI: 10.1038/sj.bjc.6605746.
[12]Alpini G, Glaser SS, Zhang J, et al. Regulation of placenta growth factor by microRNA-125b in hepatocellular cancer[J]. J Hepatol, 2011, 55(6):1339-1345. DOI: 10.1016/j.jhep.2011.04.015.
[13]Waldner MJ, Neurath MF. Colitis-associated cancer: the role of T cells in tumor development[J]. Semin Immunopathol, 2009, 31(2):249-256. DOI: 10.1007/s00281-009-0161-8.
[14]Rahbari NN, Schmidt T, Falk CS, et al. Expression and prognostic value of circulating angiogenic cytokines in pancreatic cancer[J]. BMC Cancer, 2011,11:286. DOI: 10.1186/1471-2407-11-286.
(本文编辑:屠振兴)
Effect of placental growth factor gene silencing on migration and invasion of human pancreatic carcinoma cell line PANC1
LiuJianhua,MaDong,ChenShaojie,LianGuoda,LiJiajia,HuangKaihong.
DepartmentofGastrointestinalOncology,Peoples′HospitalofGuangdongProvince,GuangdongAcademyofMedicalSciences,Guangzhou510180,China
【Abstract】ObjectiveTo explore the effect of inhibiting placental growth factor (PIGF) by small interfering RNA (siRNA) on migration, invasion and chemoresistance of human pancreatic cancer cell line PANC1. MethodsThree specific siRNAs targeting PIGF (siRNA-PIGF) were designed. PANC1 cells were transfected with siRNA-PIGF by liposome transfection using untransfected cells as blank controls and nonspecific siRNA(siRNA-NC) transfected cells as negative controls. The PIGF mRNA and protein expression was examined by real-time RT-PCR and ELISA. MTT method was used to assess the inhibition rate of chemotherapeutic reagents on cell proliferation. The abilities of migration and invasion were evaluated by Transwell assay. ResultsThe inhibition rate of PIGF mRNA in PANC1 cells transfected by 3 siRNA-PIGF were (64.38±8.92)%, (70.48±7.72)% and(81.25±6.02)%, which was lowest in siRNA-PIGF-3 transfected cells. The expression of PIGF mRNA in PANC1 cells were decreased by (63.72±8.20)% at 24 h after siRNA-PIGF transfection compared with siRNA-NC transfected cells; and the level of PIGF protein in the supernatant of cultured PANC1 cells was lowered by (42.92±1.34)% compared with siRNA-NC transfected cells and by (46.25±3.64)% compared with untransfected cells at 48h after transfection, which all had significant difference. There was no statistical difference between untransfected and siRNA-NC transfected cells. After 3 ng/L gemicitabine treatment, the inhibition rate of cell proliferation in siRNA-PIGF group was even higher than that in siRNA-NC and untransfected group[(44.35±5.05)% vs(34.29±3.60)% and(31.01±1.08)%; both P<0.05], and no significant difference was not observed after 5-FU and adriamycin treatment. In migration and invasion assay, the number of transmembrane cells from siRNA-PIGF group was 38.1% and 28.2% of that from siRNA-NC group and 40.8% and 36.2% of that from untransfected group, which had statistical difference(all P<0.05).ConclusionsPIGF silencing could significantly suppress the migration and invasion of PANC1 cells and improve the sensitivity to gemicitabine.
【Key words】Pancreatic neoplasms;RNA, small interfering;Placental growth factor;Neoplasm invasiveness
DOI:10.3760/cma.j.issn.1674-1935.2016.03.004
通信作者:黄开红,Emall: hkhem@163.com
基金项目:广东省科技计划项目资助(2013B021800233)
Corresponding author:Huang Kaihong, Emall: hkhem@163.com
(收稿日期:2016-01-03)

