胰腺导管癌伴发囊性病灶的病理与影像学特征
王志锋 刘贯中 马小龙
·论著·
胰腺导管癌伴发囊性病灶的病理与影像学特征
王志锋刘贯中马小龙
315010浙江宁波,宁波中医院放射科(王志峰);第二军医大学长海医院影像医学科(刘贯中、马小龙)
【摘要】目的探讨胰腺导管癌伴发囊性病灶的病理基础与其影像学表现之间的联系。方法对560例经手术病理证实的胰腺导管癌患者中伴有囊性病灶的97例患者病理学资料和影像学资料进行回顾性分析。所有患者均经过CT和MRI平扫加增强检查。结果手术病理显示所有病变均为实性肿块与囊性病灶并存。实性肿块组织结构紧密,为肿瘤性腺管和(或)腺泡组织与大量纤维胶原混杂,内部缺乏血管结构,周边伴有炎细胞浸润。伴发的囊性病灶中假性囊肿54例(56%),潴留性囊肿22例(23%),胰腺导管内乳头状黏液瘤(IPMN)12例(12%),肿瘤自身坏死、囊变9例(9%)。实性肿块CT平扫呈等低或低密度,MR T1WI呈低信号、T2WI等或等高信号。仅1例肿块内部见灶状钙化。增强后78例轻度强化,19例无明显强化。肿块与周围正常胰腺组织边界不清晰。囊性病灶位于肿块内部仅见于肿瘤自身坏死、囊变的病例,其余病例均为囊性病灶与实性肿块毗邻。单囊70例(假性囊肿49例,潴留性囊肿12例,肿瘤坏死、囊变9例),多囊27例(假性囊肿5例,潴留性囊肿10例,IPMN 12例)。所有假性囊肿周围脂肪间隙内可见渗出,其中10例囊壁与脾脏分界不清晰,5例与肾脏分界不清晰,16例假性囊肿腔内可见出血。80例病灶上游主胰管有扩张伴“截断”表现;18例伴有胆总管胰腺段梗阻,上游胆管扩张;11例脾静脉受侵犯;5例囊变的内壁可见壁结节样结构。结论胰腺导管癌作为高度侵袭性且内部组织结构紧密的恶性肿瘤,在其伴发的囊性病灶中,肿瘤自身坏死、囊变较为少见,绝大多数为肿瘤阻塞胰管导致的假性囊肿和潴留性囊肿的继发性改变,其病理学特征决定其影像学表现。
【关键词】胰腺肿瘤;体层摄影术,X线;磁共振成像;胰腺囊肿
Fund program:“1255 blueprint” Subject Elevation of Changhai Hospital(CH125520804)
胰腺导管癌占胰腺上皮来源恶性肿瘤的90%,因此“胰腺癌”一般就是指胰腺导管癌。胰腺导管癌在组织结构上属于“硬癌”,肿瘤组织结构紧密,富含大量纤维胶原组织,且缺乏血管,所以几乎不会发生坏死、囊变,甚至在放疗、化疗后也不会发生[1]。但是,当胰腺导管癌伴发囊性病灶时,在影像学检查中就会呈现囊实性表现,从而可能误导诊断,因此有必要对造成这种现象的病理因素和影像学表现进行探讨,以避免误诊、漏诊的发生。
材料与方法
一、病例资料
回顾性分析第二军医大学附属长海医院经手术病理证实的560例胰腺导管癌患者中伴有囊性病灶的97例患者资料。其中男性41例,女性56例,年龄37~80岁,平均年龄(58±10)岁。54例患者在外院及长海医院就诊时曾被误诊,其中26例被误诊为“胰腺炎伴假性囊肿”,15例被误诊为“黏液性囊腺瘤”,10例被误诊为“浆液性囊腺瘤”,3例被误诊为“胰腺囊肿”。
二、影像学检查
所有患者均行CT平扫加增强检查和MRI平扫加增强检查。CT检查采用荷兰飞利浦16层螺旋CT扫描仪或德国西门子64层CT扫描仪。螺距1.0~1.2 mm,层厚4 mm。增强选用非离子对比剂碘海醇(300 mgI/ml)80~90 ml,注射流率3~4 ml/s,分别于注射对比剂后20~25 s、60~70 s、110~130 s进行3期扫描。MR检查分别在德国西门子产1.5T avanto 全身扫描仪或1.5T siphony全身扫描仪进行。采用8通道腹部表面线圈,扫描序列:T2WI为快速反转恢复脂肪抑制自旋回波序列[回波时间(TE) 86 ms,重复时间(TR) 6 300 ms],T1WI为三维容积内插快速扰相梯度回波序列[反转时间(TI) 5 ms,TE 2.6 ms,TR 5.8 ms]。层厚和层间距分别采用4.0 mm和1.2 mm。钆喷酸葡胺注射液增强,剂量0.1 ml/kg体重,注射流速2 ml/s,3期扫描时间同CT。
由两位影像学医师从病灶形态、位置、大小、边缘,与相邻器官的关系,内部密度(信号),增强后表现和对胰(胆)影响等方面进行分析。CT密度及MRI信号评判标准以正常胰腺组织为参照物。胰腺主胰管和胆管扩张判断测量以MRCP图像为准,主胰管最大宽度>0.1 cm为扩张,胆总管管径>0.8 cm为扩张。
三、病理学检查
一滴水可以折射出太阳的光辉,一个企业的发展历程也可以映证一个国家经济变革的风貌。西北石油局进疆40年风雷激荡的雄浑篇章,也是40年改革开放取得辉煌成就的一个缩影和历史见证。西北油田正是乘着改革开放的春风,以非凡胆识与创新精神,取得一个个重大突破。沙参二井的重大发现,犹如“沙漠春雷”拉开了塔里木油气勘探开发大会战的序幕;沙48井的高产油气流,拉开了10亿吨储量级缝洞型油藏开发的序幕,并使塔河油田快速跻身国内陆上十大油田之列。如今,西北油田已发生脱胎换骨的变化,一跃成为在低油价时率先盈利,在高油价时创效最多的标杆企业 ,以强劲的发展势头,划出一条激情上扬曲线。
在肿瘤切除后2 h内将病灶沿主胰管长轴剖开,摄像。对肿瘤组织及伴发的囊性病灶囊壁进行取材,常规甲醛固定、脱水、包埋、切片、HE染色。由病理科医师读片。
结果
一、肿瘤的病理特征
大体标本见肿块为灰白色或灰黄色,质地较韧,与正常胰腺无明显分界,其中9例肿瘤中央可见小片不规则囊腔结构。镜下见大量纤维胶原背景下数量不等的肿瘤性腺管和(或)腺泡组织。肿瘤边缘胰腺小叶萎缩,小叶间隔内纤维胶原增生并伴有炎性细胞浸润。
97例中54例(56%)为胰腺导管癌伴发假性囊肿(图1A),其中49例为单囊,5例为多囊。19例囊壁术中已破裂。镜下见囊壁为纤维胶原和少量炎性细胞,囊内可见多量细胞碎屑和脂质,16例单囊囊腔内有大量含铁血黄素及红细胞碎片。
22例(23%)为胰腺导管癌伴发潴留性囊肿(图1B),其中12例为单囊,10例为多囊。镜下见囊内壁残留胰管上皮细胞,囊内为含蛋白的黏液。
12例(12%)为伴有胰腺导管癌的胰腺导管内乳头状黏液瘤(IPMN)(图1C),均为多囊。镜下见囊壁为扩张的胰管,腔内有大量黏液,内壁可见肿瘤细胞乳头状排列。
9例(9%)为肿瘤自身坏死、囊变,囊性病灶位于肿块中央,均为单囊。镜下见囊内大量坏死无结构组织和少量脂质。
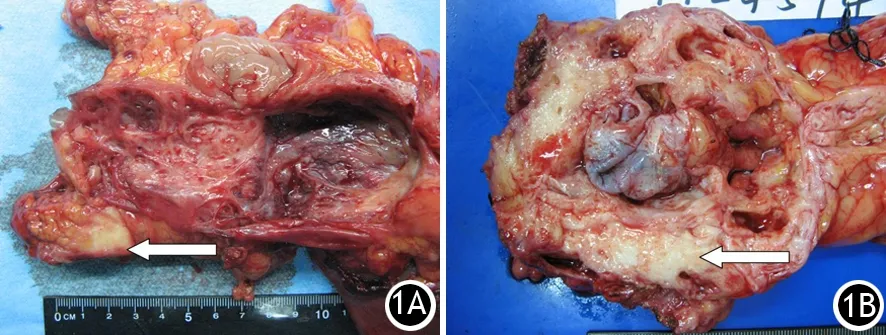
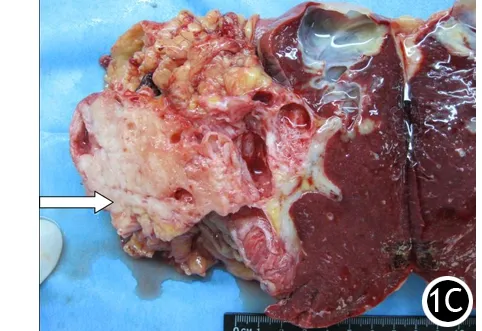
图1胰尾癌继发假性囊肿(1A),胰体癌继发多个潴留性囊肿(1B),伴有胰腺导管癌的IPMN(1C)大体标本
二、肿瘤的影像学表现
2.实性肿块的CT密度与MR信号:肿块为圆形、椭圆形或不规则分叶状。最大径0.8~4.5 cm。CT平扫呈现等低或低密度,MR T1WI呈低信号,T2WI呈等或等高信号。1例内部见灶状钙化。肿块与周围正常胰腺组织边界不清晰,66例周围脂肪间隙内可见网格状水肿、渗出表现。增强后62例肿块在各期均显示强化,但弱于周围胰腺组织;16例在延迟期强化,与周围胰腺组织接近;19例无明显强化。
3.伴发囊性病灶的影像学表现:54例伴有假性囊肿者,实性肿块位于囊性病灶主胰管下游,胰周有渗出(图2)。38例囊内CT平扫为低密度,MR T1WI呈低信号,T2WI呈高信号;16例囊肿见出血表现,CT呈高或等高密度影混杂,MR T1WI高信号、T2WI低信号,其中5例T2WI示囊腔内出现与上层高信号分层的低信号。囊内容物增强后无强化。囊壁厚度不均匀,最厚者不超过2 mm,最薄处在0.1 mm以下,难以测量。所有囊腔周围脂肪内有渗出。10例囊壁与脾脏分界不清晰,5例与肾脏分界不清晰。
22例伴发潴留性囊肿者,12例单囊与2例多囊的肿块位于囊性病灶主胰管下游,其余8例多囊者的肿块位于多囊中央,被多个囊腔包绕(图3)。这些囊腔最小1.0 cm左右,最大2.0 cm左右。CT平扫为低密度,MR T1WI呈低信号,T2WI呈高信号,增强后囊内容物无强化。囊壁薄,均在0.1 mm以下,难以测量。囊壁与周围组织分界清晰,胰周无明显渗出。
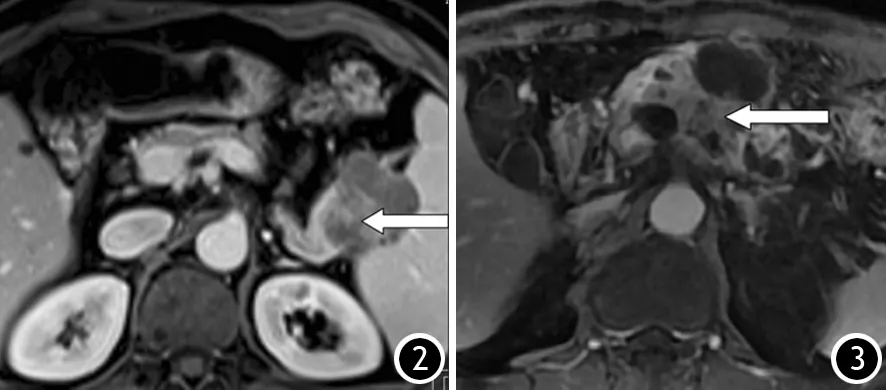
图2 胰尾癌导致的多个假性囊肿。MR T1WI增强后延迟期多个囊腔包绕轻度强化的不规则肿块(↑) 图3 胰体癌继发的多个潴留性囊肿。MR T1WI增强后延迟期可见肿块轻度强化(↑)
12例IPMN均为沿主胰管或钩突胰管的多囊性病灶,其内部或毗邻不规则实性肿块(图4)。6例见囊腔直接或通过扩张的一级分支胰管与主胰管相通,1例与钩突胰管相通。囊壁均未见明显壁结节。CT平扫为低密度,MR T1WI呈低信号,T2WI呈高信号,增强后囊内容物无强化。囊壁薄,厚度在0.1 mm以下,难以测量。囊壁与周围组织分界清晰,胰周无明显渗出。
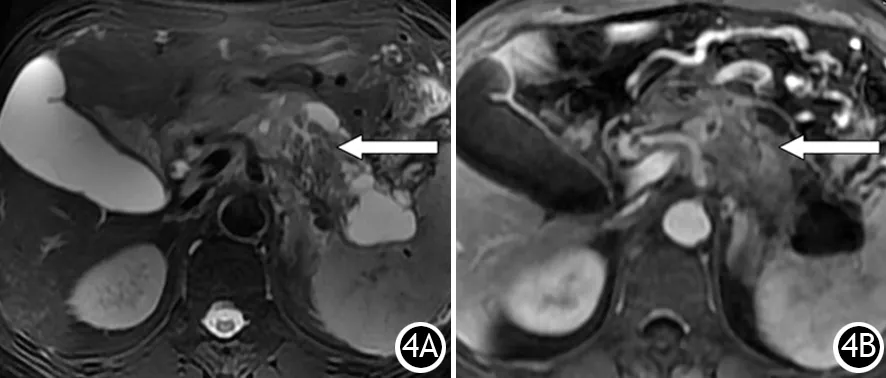
图4 伴发胰腺导管癌的IPMN。MR T2WI横断位见多个囊腔中央等低信号的不规则肿块(4A,↑);MR T1WI增强后门静脉期见肿块轻度强化(4B,↑)
9例肿瘤自身坏死形成囊变者囊腔均位于实性肿块中央,所占面积不超过30%(图5)。囊腔形态不规则,5例见类似壁结节样结构。CT密度和MR信号以及增强后改变与实性肿块相同。囊腔内CT平扫为低密度,MR T1WI呈低信号,T2WI呈高信号。增强后囊内容物无强化。
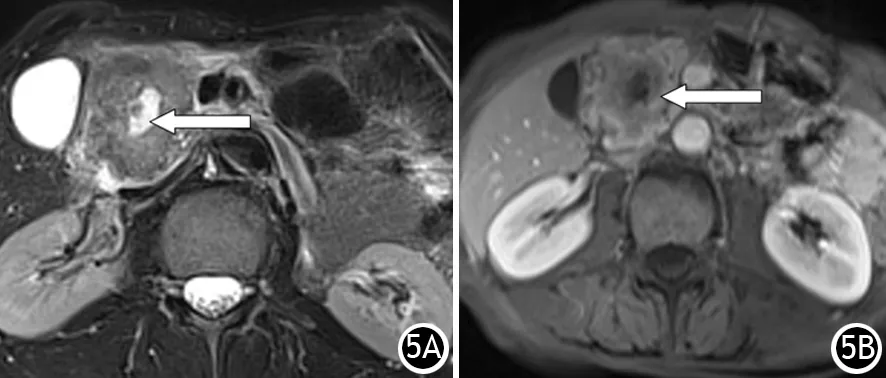
图5 胰腺癌自身坏死、囊变。MR T2WI横断位见胰头肿块中央小片不规则高信号坏死、囊变区(↑),内壁有与肿块信号相同的“壁结节”(5A),MR T1WI增强后延迟期见肿块轻度强化(5B,↑)
4.对胰(胆)管和周围器官的影响:除位于胰尾末端的17例外,其余80例病灶上游主胰管均有扩张伴“截断”表现,其中50例伴有病灶上游胰腺萎缩。18例(12例位于胰头,6例位于胰颈)伴有胆总管胰腺段梗阻,上游胆管扩张。
11例脾静脉全段或部分节段增强后无造影充盈,其中9例发生在伴有胰腺炎表现的病例中,2例为胰腺肿块包绕血管。脾门血管迂曲,侧支血管大量开放,脾脏增大,呈现胰源性门脉高压表现。
讨论
胰腺导管癌起源于主胰管和较大的一、二级分支胰管,为浸润性生长,阻塞胰管继而导致阻塞性胰腺炎或潴留性胰管囊性扩张较为常见。本研究除9例为肿瘤自身坏死形成囊变、12例伴有IPMN外,其余76例均为胰腺导管癌继发囊性改变。对囊性病灶形成原因进行探讨的重点并不在于如何区分这些囊性病灶,而在于避免因为这些囊性病灶而导致胰腺导管癌的漏诊和误诊。
胰腺导管癌为实性肿块,内部为大量纤维胶原组织和肿瘤样腺管和(或)腺泡组织,血管极少甚至几乎没有血管组织,因此质地坚韧,很少发生坏死、囊变[1-2]。由于大量纤维胶原和不同比例的肿瘤性腺管(泡)组织混杂存在,造成肿块在CT上表现为等低或低密度,MR T1WI呈低信号,T2WI呈等低、等或等高信号。由于缺乏血管和组织结构紧密,增强后肿块显示乏血供的弱强化甚至无强化表现[3]。当肿块无明显强化或轻度强化时,如不参照MR T2WI或MRCP,就可能将实性肿块误诊为“囊肿”。部分较小的肿瘤在延迟期可能出现延迟强化,此时与周围强化衰减中的胰腺组织可能出现密度接近的表现。本研究结果显示所有病灶在动脉期和门脉期均显示强化,但弱于正常胰腺组织。
因为肿瘤坏死很少发生,故而也很少继发钙化。以往研究表明,胰腺导管癌发生钙化率在3%以内,远低于胰腺腺泡细胞癌(30%~50%)和神经内分泌肿瘤(22%)[4]。本研究仅1例发生钙化。
当胰管受肿瘤阻塞后可形成假性囊肿与潴留性囊肿。假性囊肿边缘由于炎性反应而出现脂肪间隙水肿和纤维胶原增生。假性囊肿内出血较为常见,血块在CT表现为等高密度,在MR为 T1WI高信号、T2WI低信号。如果血细胞破裂则会造成含铁血黄素沉积, MR图像上可出现“液-液分层”表现。因为假性囊肿是阻塞性胰腺炎的继发改变,因此它位于胰管阻塞段的上游。潴留性囊肿的形成与大胰管受阻进度相对和缓有关,因此潴留性囊肿周围渗出、水肿不显著。如发现胰腺炎假性囊肿或潴留性囊肿的病例时,一定要注意查找有无实性肿块。
IPMN为唯一起源于主胰管或较大分支胰管的囊性肿瘤,在WHO分类中被分为伴有癌变的IPMN和不伴有癌变的IPMN两大类。部分学者认为IPMN很可能是胰腺导管癌的“癌前病变”[5]。本研究中12例胰腺导管癌伴有IPMN者均有实性肿块,且均为多囊性。实性肿块位于多囊的中央区域提示肿瘤可能为IPMN内部起源。
本研究仅有9例出现肿块中央坏死、囊变的表现,占560例胰腺导管癌的2%,占本研究病例的9%。值得注意的是,发生囊变的面积最大不超过肿块最大层面面积的30%。表明坏死、囊变在胰腺导管癌中极为罕见,且局限在中央区域的小面积范围内,这与胰腺癌“硬癌”的特点密切相关。
当胰腺导管癌伴发囊性病变时,绝大部分为肿瘤引发的假性囊肿和潴留性囊肿。此时,胰腺炎表现以及出现的囊肿有可能掩盖肿瘤本身,特别是当囊性病灶较大时。但单个囊肿下游或位于多囊中央的、边缘不清晰且弱强化的肿块可直接显示出癌肿的性质。阻塞性胰腺炎导致的上游主胰管扩张并“截断”是其重要的间接征象。对发生“胰腺炎”的患者行胰腺CT增强扫描和MRCP可以捕捉到这些征象。
伴有假性囊肿或潴留性囊肿的胰腺导管癌需要和胰腺炎伴假性囊肿相鉴别,前者在主胰管下游出现边缘不清晰且弱强化的肿块是主要鉴别点;其次,在发生胰腺炎的胰腺节段中出现主胰管受阻、扩张,梗阻处“截断”等表现是具有鉴别作用的重要继发征象。当伴有多囊病灶的胰腺导管癌肿块体积不大且位于多囊中央时,需要与多囊型浆液性囊腺瘤加以鉴别。有时前者会被误认为浆液性囊腺瘤“中央瘢痕样组织”,但它是“硬癌”,呈现边缘不清晰且弱强化表现;后者并非为真正瘢痕,而是富含血管的肿瘤间质,增强后一般强化较明显。另外浆液性囊腺瘤并非起源于主要胰管,因此对胰管阻塞不明显,不会引发阻塞性胰腺炎。
参考文献
[1]Elias J Jr, Semelka RC, Altun E, et al. Pancreatic cancer: correlation of MR findings, clinical features, and tumor grade[J].J Magn Reson Imaging,2007,26(6):1556-1563.DOI: 10.1002/jmri.21210.
[2]Fusari M, Maurea S, Imbriaco M, et al. Comparison between multislice CT and MR imaging in the diagnostic evaluation of patients with pancreatic masses[J].Radiol Med,2010,115(3):453-466.DOI:10.1007/S11547-010-0490-7.
[3]Mergo PJ, Helmberger TK, Buetow PC, et al. Pancreatic neoplasms: MR imaging and pathologic correlation[J].Radiogra-phics,1997,17(2): 281-301.DOI:10.1148/radiographics.17.2.9084072.
[4]Chiou YY, Chiang JH, Hwang JI, et al.Acinar cell carcinoma of the pancreas: clinical and computed tomography manifestations[J].J Comput Assist Tomogr,2004,28(2):180-186.
[5]Chen SY, Lin CH, Yu JC, et al. Pancreatic adenocarcinoma mimicking intraductal papillary mucinous tumor (IPMT)[J].Rev Esp Enferm Dig,2006,98(9):702-703.
(本文编辑:吕芳萍)
Pathological and radiological characteristics of cystic lesions accompanied with pancreatic ductal adenocarcinoma
WangZhifeng,LiuGuanzhong,MaXiaolong.
DepartmentofRadiology,NingboMunicipalHospitalofChineseTraditionalMedicine,Ningbo315010,China
【Abstract】ObjectiveTo explore the correlation between pathologic findings of pancreatic ductal adenocarcinoma accompanied with cystic lesion and their radiological images. MethodsThe pathological and radiological data of 97 cases with cystic lesion of 560 patients who were diagnosed as pancreatic ductal adenocarcinoma based on postoperative pathology were retrospectively analyzed. All the patients underwent CT and MRI examinations. ResultsPostoperative pathological report showed that solid masses and cysts coexisted in all the lesions. Solid masses had compact structures and consisted of innumerable fibrous collagen mixed with tumorous tubular or acinar gland tissue but lack of vessels and inflammatory cells were infiltrated in tissues surrounding the tumors. As for the accompanied cystic lesions, 54 cases (56%) were pseudocysts, 22 cases (23%) were retention cysts, 12 cases (12%) were pancreatic intraductal papillary mucinous neoplasms (IPMN), and 9 cases (9%) were the necrosis and cystic changes of the tumors. Solid masses were hypodense or iso-hypodense in CT, and hypodense on T1WI and isodense or iso-hyperdense on T2WI in MR. The focal calcification was detected in only one mass. Seventy-eight cases displayed slight enhancement and 19 cases displayed no enhancement after enhancement. The tumor′s boundary were unclear in all cases. The cystic lesions which were located in masses were only observed in patients with tumors′ necrosis and cystic degeneration, and other cystic lesions were adjacent to the solid masses. Single cyst was found in 70 cases (49 with pseudocysts, 12 with retention cysts, 9 tumors′ necrosis and cystic degeneration,) and multiple cysts were in 27 cases (5 with pseudocysts, 10 with retention cysts ,12 with IPMN). Exudation appeared surrounding the tumors in all cases accompanied with pseudocysts, and the cystic wall was attached to the spleen in 10 cases and the kidney in 5 cases. Hemorrhage appeared in 16 cases with pseudocysts. Pancreatic ducts were blocked by tumor masses and the proximal duct was dilated in 80 cases. Common bile ducts were obstructed with the proximal duct dilated in 18 patients. Splenic veins were infiltrated in 11 cases. Wall nodular lesions were seen in 5 cases with cystic degeneration. ConclusionsPancreatic ductal adenocarcinoma is a highly invasive tumor with compact structures, and the tumors′ cystic degeneration is uncommon in such patients. Most of the cystic lesions accompanied with the tumors are pseudocysts or retention cysts, which are secondary changes caused by the obstruction in pancreatic ducts, and these pathological features are correlated the imaging findings.
【Key words】Pancreatic neoplasms;Tomography, X-ray;Magnetic resonance imaging;Pancreatic cyst
DOI:10.3760/cma.j.issn.1674-1935.2016.03.007
通信作者:马小龙,Email: tilt22@sina.com
基金项目:长海医院“1255计划”学科特色提升项目(CH125520804)
Corresponding author:Ma Xiaolong, Email: tilt22@sina.com
(收稿日期:2015-10-19)

