补肾益肺消癥方干预肺纤维化大鼠JNK凋亡信号通路关键分子的表达调控内质网应激的作用机制
吴甜甜,柴立民,杨颖溪,高伟华,朱紫亨,徐 昉,余佳骏,韦 翊,李 雪,晏 军
(北京中医药大学东直门医院,北京 100700)
论著
补肾益肺消癥方干预肺纤维化大鼠JNK凋亡信号通路关键分子的表达调控内质网应激的作用机制
吴甜甜,柴立民,杨颖溪,高伟华,朱紫亨,徐昉,余佳骏,韦翊,李雪,晏军
(北京中医药大学东直门医院,北京 100700)

[摘要]目的探讨补肾益肺消癥方干预肺纤维化大鼠内质网应激和JNK细胞凋亡信号通路的作用机制。方法将SD大鼠随机分为空白组、模型组、阳性药物组、中药预防组、中药治疗组、中药防治组,除空白组外,其他组均以博莱霉素致大鼠肺纤维化模型。中药预防组及中药防治组造模1 d后开始给予补肾益肺消癥方12.68 g/(kg·d)灌胃,空白组和模型组予等量生理盐水灌胃。造模28 d后确定造模是否成功,并处死中药预防组大鼠,观察预防性给药对IPF的影响;造模成功后,阳性药物组给予吡非尼酮53.57 mg/(kg·d)灌胃,中药治疗组及中药防治组给予补肾益肺消癥方12.68 g/(kg·d)灌胃,空白组和模型组仍给予等量生理盐水灌胃,持续28 d。HE染色观察各组大鼠肺组织病理变化,real-time PCR及Western-blot检测肺组织中JNK信号通路相关因子GRP78、IRE1α、p-JNK、TRAF2基因表达及蛋白含量的差异。结果肺组织切片HE染色显示,阳性药物组、中药预防组及中药治疗组肺泡轻度破坏,成纤维细胞有一定程度增生;中药防治组肺泡结构完整,有少量成纤维细胞增生,较模型组纤维化程度明显改善;模型组肺组织中GRP78、IRE1α、p-JNK、TRAF2基因表达拷贝数比值及蛋白含量均明显高于空白组(P均<0.05);中药治疗组和中药防治组GRP78基因表达拷贝数比值及蛋白含量和TRAF2基因表达拷贝数比值均明显低于模型组(P均<0.05),阳性药物组和中药防治组IRE1α基因表达拷贝数比值均明显低于模型组(P均<0.05),阳性药物组、中药预防组、中药治疗组和中药防治组IRE1α蛋白含量均明显低于模型组(P均<0.05),中药防治组p-JNK蛋白含量明显低于模型组(P<0.05)。结论通过下调GRP78、IRE1α、p-JNK、TRAF2的水平,调控JNK信号通路,减轻内质网应激,减少细胞凋亡是补肾益肺消癥方延缓肺纤维化的作用机制之一。
[关键词]补肾益肺消癥方;肺纤维化;大鼠;内质网应激;JNK细胞凋亡信号通路
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是一种原因不明的、进行性的、局限于肺部的以纤维化伴蜂窝状改变为特征的疾病,病理上呈现特发性间质性肺炎(usual interstitial pneumonia,UIP)的组织学征象,肺功能显示限制性通气功能障碍和/或换气障碍,HRCT扫描可见周围性分布及两肺底显著的粗大网织样改变伴蜂窝肺形成。IPF发病率呈逐渐上升的趋势,其生存期中位数2.9年,5年生存率<50%,几乎与恶性肿瘤无异[1]。目前,该病病因不明,缺乏有效的治疗手段。补肾益肺消癥方是基于中医学“金水相生”理论,以补肺益肾、消癥通络为治疗法则而创制,在临床上用于治疗IPF疗效较好。本实验以博莱霉素致大鼠IPF为动物模型,观察了补肾益肺消癥方对IPF大鼠肺组织病理改变以及JNK细胞凋亡信号通路相关因子基因表达和蛋白含量的影响,旨在探讨补肾益肺消癥方的作用机制。
1实验资料
1.1动物及分组清洁级雄性SD大鼠120只,体质量180~200 g,动物合格证号:11400700045968。随机分为空白组、模型组、阳性药物组、中药预防组、中药治疗组、中药防治组,每组20只。
1.2药物及试剂盐酸博来霉素(15 mg/片)购自日本化药株式会社;吡非尼酮胶囊(100 mg/粒)购自北京康蒂尼药业有限公司;补肾益肺消癥方由当归、熟地、陈皮、法半夏、浙贝母、水蛭、连翘、炙甘草组成,各味中药均为免煎颗粒,由东直门医院药剂科提供;SYBR green PCR master mix购自美国ABI生物公司,Rat-β-actin-antibody、Rat-GRP78-antibody、Rat-IRE1α-antibody、Rat-PERK-antibody、Rat-p-JNK-antibody、Rat-TRAF2-antibody购自Santa CRUZ生物公司,HRP标记兔抗羊IgG二抗购自武汉博士德生物科技公司。
1.3模型制作及药物干预3.25%水合氯醛麻醉大鼠,经气管插管,除空白组以外,其他各组大鼠按5 mg/kg缓慢注入博莱霉素,药物注入后,立即将动物直立并不断旋转,使药物均匀分布于肺内,空白组经气管注入等量0.9%氯化钠溶液。中药预防组及中药防治组造模1 d后开始给予补肾益肺消癥方12.68 g/(kg·d)灌胃,空白组和模型组予等量生理盐水灌胃。待造模28 d后,处死1~2只模型组大鼠,组织病理切片,HE染色,观察肺组织纤维化程度,确定造模是否成功,并处死中药预防组大鼠,观察预防性给药对IPF的影响;造模成功后,阳性药物组给予吡非尼酮53.57 mg/(kg·d)灌胃,中药治疗组及中药防治组给予补肾益肺消癥方12.68 g/(kg·d)灌胃,空白组和模型组仍给予等量生理盐水灌胃,持续28 d。
1.4观察指标
1.4.1肺组织病理表现取部分病变肺组织,4%多聚甲醛常温固定过夜,常规乙醇梯度脱水,石蜡包埋,将包埋好的蜡块切成5 μm厚薄片,用二甲苯脱去切片中的石蜡,乙醇梯度脱水,然后加入蒸馏水,将切片放入苏木精水溶液中染色数分钟,流水冲洗1 h后入蒸馏水片刻,加入乙醇伊红染色液染色2~3 min,染色后的切片经纯乙醇脱水,再经二甲苯使切片透明,将已透明的切片滴上树胶,盖上盖玻片封固,光学显微镜下观察肺组织病理变化,并拍照分析。
1.4.2肺组织中JNK信号通路相关因子GRP78、IRE1α、p-JNK、TRAF2基因表达情况取100 mg病变肺组织,Trizol一步法提取Total RNA,RNA经反转录成cRNA,设计特异性引物,以GAPDH为内对照设定相对标准曲线,根据Ct值差异,real-time PCR检测GAPDH和GRP78、IRE1α、p-JNK、TRAF2基因的相对拷贝数,根据GAPDH拷贝数与GRP78、IRE1α、p-JNK、TRAF2拷贝数的比值,检测GRP78、IRE1α、p-JNK、TRAF2基因表达量的差异。PCR引物序列:CAPDH Forward为5’-CCATGGAGAAGGCTGGG-3’,Reverse为5’-CAAAGTTGTCATGGATGACC-3’;GRP78 Forward为5’-CCACCAGGATGCAGACATTG-3’,Reverse为5’-AGGGCCTCCACTTCCATAGA-3’;IRE1 Forward为5’-AAGTTTTGGAAGAGCCAGCA-3’,Reverse为5’-TGTTCTTGCCTCCAAGTGTG-3’;TRAF2 Forward为5’-GCCAGATTTTGGAGCAGAAG-3’,Reverse为5’-TGCTGCACCTTGTTGCTTAG-3’;JNK Forward为5’-CGGAACACCTTGTCCTGAAT-3’,Reverse为5’-TCGCCTGACTGGCTTTAAGT-3’。
1.4.3肺组织中JNK信号通路相关因子GRP78、IRE1α、p-JNK、TRAF2蛋白表达情况采用Western-blot法检测。变性聚丙烯酰胺凝胶电泳分离总蛋白质,转膜后,脱脂奶粉封闭,Rat-β-actin-antibody、Rat-GRP78-antibody 、Rat-IRE1α-antibody 、Rat-p-JNK-antibody 、Rat-TRAF2-antibody 4℃孵育过夜,二抗室温孵育2 h,加入化学发光底物,暗室显影。以β-actin为参照,根据条带灰度比,分析GRP78、IRE1α、p-JNK、TRAF2蛋白含量的差异。每组选取4个不同的样本重复上述实验。
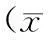
2结果
2.1各组肺组织病理表现空白组大鼠肺组织结构正常;模型组大鼠肺组织肺泡结构破坏,纤维化伴蜂窝肺形成、瘢痕性成纤维化病灶、斑片状分布、侵犯边缘性腺泡或小叶为主;阳性药物组、中药预防组及中药治疗组肺泡轻度破坏,成纤维细胞有一定程度增生;中药防治组肺泡结构完整,有少量成纤维细胞增生,较模型组纤维化程度明显改善。见图1~6。
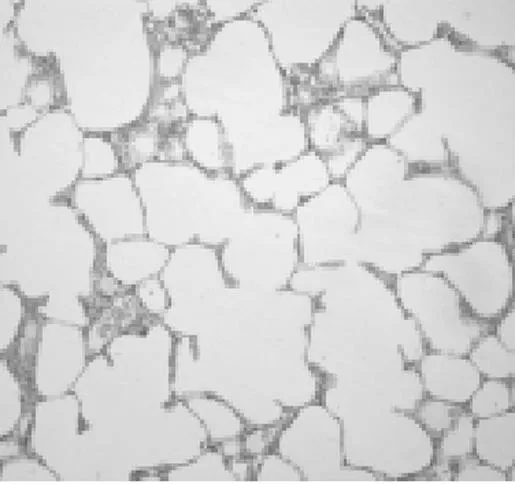
图1 空白组大鼠肺组织HE染色表现(×100)

图2 模型组大鼠肺组织HE染色表现(×100)

图3 阳性药物组大鼠肺组织HE染色表现(×100)
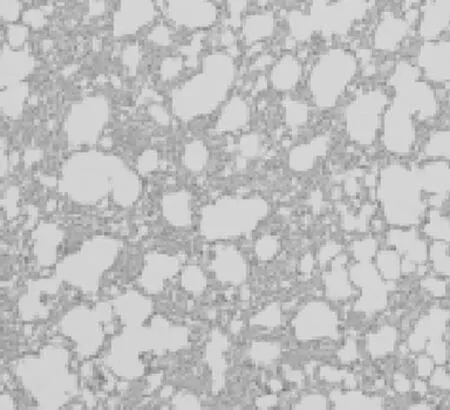
图4 中药预防组大鼠肺组织HE染色表现(×100)
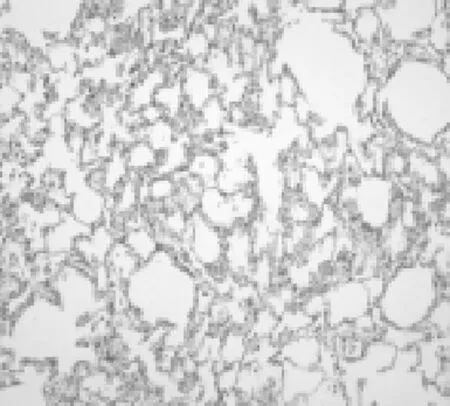
图5 中药治疗组大鼠肺组织HE染色表现(×100)

图6 中药防治组大鼠肺组织HE染色表现(×100)
2.2各组肺组织中GRP78、IRE1α、p-JNK、TRAF2基因表达情况模型组肺组织中GRP78、IRE1α、p-JNK、TRAF2基因表达拷贝数比值均明显高于空白组(P均<0.05);中药治疗组和中药防治组GRP78、TRAF2基因表达拷贝数比值均明显低于模型组(P均<0.05),阳性药物组和中药防治组IRE1α基因表达拷贝数比值均明显低于模型组(P均<0.05)。见表1。
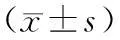
表1 各组肺组织中GRP78、IRE1α、p-JNK、
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
2.3各组肺组织中GRP78、IRE1α、p-JNK、TRAF2蛋白含量比较模型组肺组织中GRP78、IRE1α、p-JNK、TRAF2蛋白含量均明显高于空白组(P均<0.05);中药治疗组和中药防治组GRP78蛋白含量均明显低于模型组(P均<0.05),阳性药物组、中药预防组、中药治疗组和中药防治组IRE1α蛋白含量均明显低于模型组(P均<0.05);中药防治组p-JNK蛋白含量明显低于模型组(P<0.05)。见表2。
3讨论
IPF发病机制不完全清楚,目前研究认为炎症反应导致的Ⅱ型肺泡上皮细胞持续性损伤,诱发肺泡组织的修复和瘢痕形成,连续不减弱的瘢痕形成导致肺组织纤维化病理改变的发生。慢性损伤导致Ⅱ型肺泡上皮细胞的凋亡是IPF形成的关键因素,这一观点已经引起了广泛认可和重视。最新研究表明内质网应激(endoplasmic reticulum stress, ERS)是导致Ⅱ型肺泡上皮细胞损伤、诱导细胞凋亡的关键分子机制,而内质网是蛋白分泌、折叠、成熟,钙储存以及脂质合成的重要场所[2]。在内质网中蛋白质折叠成原始的构象,经过修饰最终成为具有活性的功能性蛋白质[3]。一旦聚集在内质网内的未折叠或错折叠蛋白超过内质网的负荷能力,将会引起内质网平衡失调,从而导致ERS[4]。ERS需3种内质网跨膜蛋白即蛋白激酶R样内质网激酶(protein kinase R like endoplasmic reticulum kinase,PERK)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)和活化转录因子6(activating transcription factor 6,ATF6)介导[5]。正常情况下这3种蛋白都与免疫球蛋白重链结合蛋白GRP78结合而处于无活性状态。ERS发生时,GRE78即与这3种蛋白解离,因此,GRE78的急速上调被认为是ERS最敏感的指标[6]。IRE1是ERS的传感器,它可以将内质网的应激信号传递给细胞质和细胞核[7]。活化的IRE1与TRAF2结合,形成IRE1-TRAF2复合物,并结合凋亡信号调节激酶(TNF-dependent apoptosis-signaling kinase 1,ASK1)激活JNK通路。ASK1在内质网应激诱发细胞凋亡中起重要作用,它可以向下游分子传递多种应激信号[8]。JNK是一种丝裂原活化蛋白激酶,它可以调节凋亡相关基因bcl-2,甚至直接激活bcl家族中bax基因促进凋亡[9-10]。活化的IRE1-TRAF2-ASK1复合物会引起JNK磷酸化和激活炎性细胞因子,其随后引起的炎症反应导致细胞损伤和凋亡[7]。
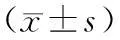
表2 各组肺组织中GRP78、IRE1α、p-JNK、
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
IPF在中医学的病名尚缺乏统一认识,通常将本病归“肺痿”或“肺痹”范畴,通过病证结合分析,IPF应属于“肺络微型癥瘕”范畴[11]。“肺为娇脏”,外邪入侵,首先犯肺,致使肺脏气机不利,宣发肃降失常,病变日久,邪毒入血入络,气血运行不畅,痰瘀互结,形成癥瘕,“久病多虚”,肺病日久,耗伤津血,日久导致肾脏虚损。“久病当以缓攻,不致重损”,故治当标本兼治,消补兼施,寓消于补,调畅气血,虚复痰消,瘀除毒解,而肺络癥消瘕复。补肾益肺消癥以补益肺肾、祛瘀化痰解毒为法,以经典名方金水六君煎为基本方化裁而成,方中当归、熟地滋阴养血,陈皮、半夏理气化痰,浙贝母化痰散结,水蛭解毒、软坚散结,连翘解毒散结,诸药合用,全方共奏补虚祛瘀、消痰解毒之功。
本实验结果显示,补肾益肺消癥方可以减轻肺泡结构破坏,减少成纤维细胞增生,延缓肺间质纤维化;中药治疗组和中药防治组GRP78基因表达拷贝数比值及蛋白含量和TRAF2基因表达拷贝数比值均明显低于模型组,阳性药物组和中药防治组IRE1α基因表达拷贝数比值均明显低于模型组,阳性药物组、中药预防组、中药治疗组和中药防治组IRE1α蛋白含量均明显低于模型组,中药防治组p-JNK蛋白含量明显低于模型组,尤以中药防治组效果最明显。由此笔者认为补肾益肺消癥方通过下调JNK信号传导通路关键因子的基因表达及蛋白含量,减轻ERS,减少Ⅱ型肺泡上皮细胞损伤和凋亡,抑制纤维增生及瘢痕形成,延缓肺间质纤维化进程,达到治疗效果。
[参考文献]
[1]陈瀛珠,林果为. 实用内科学[M]. 13版. 北京:人民卫生出版社,2009:1820
[2]冯利杰,沈玉先,李俊,等. 内质网应激与炎症[J]. 中国药理学通报,2013,29(6):756-760
[3]刘宝琴,王华芹. 内质网应激和未折叠蛋白反应的研究进展[J]. 中国肿瘤防治杂志,2010,17(11):869-872
[4]Fang DL,Wan Y,Shen W,et al. Endoplasmic reticulum stress leads to lipid accumulation through upregulation of SREBP-1c in normal hepatic and hepatoma cells[J]. Mol Cell Biochem,2013,381(1/2):127-137
[5]Hu F,Han J,Zhai B,et al. Blocking autophagy enhances the apoptosis effect of bufalin on human hepatocellular carcinoma cells through endoplasmic reticulum stress and JNK activation[J]. Apoptosis,2014,19(1):210-223
[6]赵珊,马迎春,刘亚坤,等. 姜黄素通过抑制内质网应激和JNK通路过度活化减轻小鼠肺缺血再灌注损伤[J]. 中国病理生理杂志,2013,29(2):308-313
[7]Wu L,Cai B,Zheng S,et al. Effect of emodin on endoplasmic reticulum stress in rats with severe acute pancreatitis[J]. Inflammation,2013,36(5):1020-1029
[8]Zhao H,Wu QQ,Cao LF,et al. Melatonin inhibits endoplasmic reticulum stress and epithelial-mesenchymal transition during bleomycin-induced pulmonary fibrosis in mice[J]. PloS One,2014,9(5):e97266
[9]赵晓彤,陈明卫,方朝晖,等. 丹蛭降糖胶囊对肥胖大鼠骨骼肌IRE1α-JNK信号通路的干预效应[J]. 中国医药导报,2014,11(36):9-12
[10] Sano R,Reed JC. ER stress-induced cell death mechanism[J]. Biochim Biophys Acta,2013,1833(12):3460-3470
[11] 柴立民,刘涓,王珍,等. 从"肺络微型症瘕"论治特发性肺纤维化[J]. 广西中医药,2012,35(2):44-45
Functional mechanism of prescription of Bushen Yifei Xiaozheng on the intervention of apoptosis JNK signaling pathway molecule expression to control mechanism of endoplasmic reticulum stress in pulmonary fibrosis rats
WU Tiantian,CHAI Limin,YANG Yingxi,GAO Weihua,ZHU Ziheng,XU Fang,YU Jiajun,WEI Yi,LI Xue,YAN Jun
(Dongzhimen Hospital,Beijing University of Traditional Chinese Medicine,Beijing 100700,China)
Abstract:Objective It is to explore functional mechanism of prescription of Bushen Yifei Xiaozheng decoction (BYXD)on the intervention of endoplasmic reticulum stress and signal pathway JNK in pulmonary fibrosis rats. Methods SD rats were randomly divided into control group, model group, positive drug group, traditional Chinese medicine prevention group,traditional Chinese medicine treatment group,traditional Chinese medicine prevention and treatment group,all the rats except in blank group were made into models by Bleomycin. The prevention group and prevention-treatment group were treated with BYXD 12.68 g/(kg·d) in 1 day after establishing, blank group and control group with normal saline. In 28 days after establishing, the rats in prevention group were killed to observe the effect on IPF, the positive group was treated with pirfenidone 53.57 mg/(kg·d), the treatment group and prevention-treatment group were treated with BYXD, blank group and model group were given normal saline. All the groups were treated for 28 days. Pathological changes in lung tissue was observed by HE staining, by real-time PCR and western-blot were used to detect lung tissue JNK signaling pathway related factors GRP78,IRE1α, p-JNK, TRAF2 gene expression changes and differences in protein content. Results HE staining of lung tissue sections: positive drug group, a group of Chinese medicine prevention and Chinese medicine treatment group with mild alveolar damage, there was a certain degree of fibroblast proliferation, a complete alveolar structure, a small amount of fibroblast proliferation was found in prevention-treatment group, compared with the model group;prescription of bushenyifeixiaozheng only significantly reduced GRP78, IRE1α,p-JNK, TRAF2 gene expression and protein content. Conclusion By down GRP78, IRE1α, p-JNK, TRAF2 level, the regulation of JNK signaling pathway, reducing the endoplasmic reticulum stress,it can reduce apoptosis and delay pulmonary fibrosis,which may be one of the mechanisms of prescription of bushenyifeixiaozheng.
Key words:prescription of bushenyifeixiaozheng;pulmonary fibrosis rats;endoplasmic reticulum stress;signal pathway JNK;the expression of gene and protein
[作者简介]吴甜甜,女,在读研究生,研究方向为中医药防治肺间质纤维化。 [通信作者]晏军,E-mail:dzmyyyj@126.com
[基金项目]国家自然科学基金资助项目(81373589)
doi:10.3969/j.issn.1008-8849.2016.19.001
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)19-2053-04
[收稿日期]2016-03-08

