重组绿豆LBBI的制备及其对小鼠的辐射防护作用
甘向东, 黄 锐, 李 飞, 王嘉玺, 刁爱坡*, 龙民慧*
(1.天津科技大学生物工程学院,天津 300457; 2.军事医学科学院基础医学研究所,北京 100850)
重组绿豆LBBI的制备及其对小鼠的辐射防护作用
甘向东1, 黄锐1, 李飞2, 王嘉玺2, 刁爱坡1*, 龙民慧1*
(1.天津科技大学生物工程学院,天津 300457; 2.军事医学科学院基础医学研究所,北京 100850)
摘要:在证实了绿豆胰蛋白酶抑制重组绿豆LBBI活性为689 U/mg的基础上,研究了重组绿豆LBBI蛋白对小鼠辐射损伤的防护作用.该研究把60只BALB/c小鼠分为3组(n=20),即生理盐水组、重组LBBI注射组和安多霖灌胃组,60 Coγ射线源,对小鼠进行一次性照射剂量为6.5 Gy全身照射,0.5 h后,对各组小鼠分别注射生理盐水、LBBI(50.0 mg·kg-1·d-1)和灌胃给药安多霖(3 g·kg-1·d-1),每隔24 h给药1次,连续给药1周,观察小鼠成活率及外周血象恢复的情况.结果显示:与生理盐水组小鼠相比,重组LBBI组和安多霖组小鼠的30 d存活率明显增高(P<0.01),平均生存时间延长(P<0.01),小鼠外周血红细胞、白细胞、血小板数目明显增加(P<0.05).说明重组LBBI蛋白具有治疗辐射损伤的作用.
关键词:重组LBBI; 表达; 纯化; 存活率; 抗辐射
辐射已成为继水、大气、噪音污染之后的第四大污染[1],预防和减轻辐射损伤的药物研发已经成为研究热点[2-4].近年来,抗辐射药物研究已取得显著成绩,如氨硫基类、蛋白类、激素类和中草药类等防护剂[5-7],但在临床的应用中存在许多不足,如含硫类防护药效虽高但毒性大,雌激素类防护药在使用的过程中出现副作用.蛋白类防护药物因其来源广泛、无毒、代谢产物是机体营养物质、无蓄积作用等,受到广泛关注[8].植物类胰蛋白酶抑制剂多数为多肽或蛋白质,它对胰蛋白酶、溶酶体酶、纤溶酶等蛋白酶均有抑制作用.绿豆胰蛋白酶抑制剂属于Bowman-Birk类胰蛋白酶抑制剂(Bowman-Birk inhibitor, 简称BBI)[9].BBI可以防护正常纤维细胞辐射损伤造成的放射性纤维化[10],显示BBI可能具有抗辐射的保护作用.我们的前期研究发现,绿豆BBI在大肠杆菌中可溶性表达(结果待发表).本研究拟通过基因工程的方法获得重组绿豆LBBI蛋白,通过与安多霖处理进行比较,得到其对小鼠经60 Coγ辐射损伤具有治疗效果和辐射保护作用,为临床抗辐射损伤药物研究提供新思路.
1材料与方法
1.1材料
菌株:由本实验室构建并保存重组LBBI表达菌株 pet32a-LBBI;实验动物:清洁级BALB/c小鼠60只,雄性,6~8周,体质量18~22 g,由军事医学科学院实验动物中心提供;大豆BBI、苯甲酰-DL-精氨酸对硝基苯胺(简称BAPNA)、氨苄青霉素购自sigma公司;所用纯化仪器为AKTA FPLC蛋白纯化系统;分光光度计购自美国Beckman公司(DU640型):电泳仪与垂直电泳槽购自天能公司(600PJ型);His·Bind Resin Ni-charged购自Novagen.
1.2方法
1.2.1重组LBBI蛋白的表达及分离纯化将含有重组质粒pET32a-LBBI的大肠杆菌BL21(DE3)活化,并按1∶50接种于1 L LB培养基中,37 ℃、200 r/min培养至OD600为0.4左右,加入0.5 mmol/L IPTG 震荡培养诱导6 h,4 ℃ 8 000 r/min 10 min离心收集菌体.加入50 mL 0.01 mol/L PBS重悬,冰上超声破碎(开5 s,关15 s)5 min;4 ℃、12 000 r/min离心10 min,将上清保留.根据His·Bind Resin Ni-charged说明书纯化目的蛋白.(1)取1 mL镍琼脂糖凝胶预装柱,加4倍柱体积的ddH2O洗柱;(2)6倍柱体积的1×Charge Buffer洗柱;(3)4倍柱体积的1×Bind Buffer(含8 M 尿素)平衡柱子;(4)取上述上清液以0.5 mL/min上样,反复上样;(5)9倍柱体积的1×Bind Buffer(含8 mol/L尿素)洗去未吸附的样品,流速0.5 mL/min,2 mL管收集;(6)6倍柱体积的1×Wash Buffer(含8 mol/L 尿素)洗去杂质,流速0.5 mL/min;(7)4倍柱体积的1×Elution Buffer(分别含20、50、100、250、500 mmol/L 咪唑,8 mol/L 尿素)梯度洗脱目的蛋白,流速0.5 mL/min,2 mL管收集;(8)收集的蛋白用12.5%的SDS-PAGE电泳检测纯度,考马斯亮蓝法测定纯化蛋白的浓度.最后将柱子存于20%乙醇中4 ℃保存.
1.2.2重组LBBI蛋白的活性测定[11]BBI抑制剂对胰蛋白酶的抑制活性通过底物BAPNA的水解速率测定.在3.5 mL活性测定体系中(50 mmol/L Tris-HCl缓冲液,pH8.0,含10 nmol/L CaCl2),一定量的抑制剂(sigma)和100 mmol/L胰蛋白酶(sigma)于37 ℃温育10 min.加入20 μL 250 mmol/L BAPNA,温浴10 min后加入200 μL 33%的HAc溶液停止反应.分光光度计在410 nm波长下测定体系中底物水解产物产生的吸光值.抑制活力单位定义为在上述条件下,反应体系加入抑制剂样品后,410 nm处吸光度每降低0.1为1个胰蛋白酶抑制活力单位(U).
取0.9 mg大豆BBI溶于 2 mL双蒸水中,稀释100倍即为胰蛋白酶抑制剂稀释液;同样方法配制纯化后的重组绿豆LBBI稀释液.分别取上述2种稀释液 0.1、0.3、0.5、0.7、0.9 mL稀释至1.0 mL.按上述方法测定溶液吸光度,并以胰蛋白酶抑制剂(Sigma)为标准品作胰蛋白酶抑制剂的量与吸光度变化的标准曲线图,根据标准曲线计算重组LBBI活力单位.
1.2.3辐射损伤模型的建立及辐射后的治疗作用将60只BALB/c小鼠适应性喂养1周后,按体质量随机分为3组,即生理盐水对照组、LBBI治疗组和阳性对照(安多霖)组,每组动物20只.军事医学科学院60 Coγ射线源照射,照射距离为4 m,照射剂量率为240.26 cGy/min;一次全身照射剂量6.5 Gy[12].在照射后0.5 h各组分别给药,其中LBBI(50.0 mg·kg-1·d-1)组尾静脉给药,生理盐水对照组尾静脉注射同剂量生理盐水,安多霖(3 g·kg-1·d-1)组经灌胃给药,每隔24 h给药1次,连续给药1周.每隔3 d取小鼠尾静脉血10 μL送至北京中同蓝博临床检验所检测白细胞、红细胞及血小板指标,连续动态观察30 d,并统计小鼠的存活率.
1.3数据处理及统计学分析
所得数据均用SPSS 13.0统计软件包处理,外周血象数据各个时间点比较采用ANOVA一元方差分析方法[13]进行统计分析,结果用均数±标准差表示.
2结果与分析
2.1重组绿豆LBBI蛋白的表达纯化
重组LBBI蛋白经IPTG诱导表达后,经His·Bind Resin Ni-charged亲和层析柱纯化,用12% SDS-PAGE检测,证实在2.8×104有1条目的条带(图1),将纯化后蛋白样品保存于-20 ℃.通过薄层扫描分析(TLC Scanner 3)表明其纯度在87%以上.
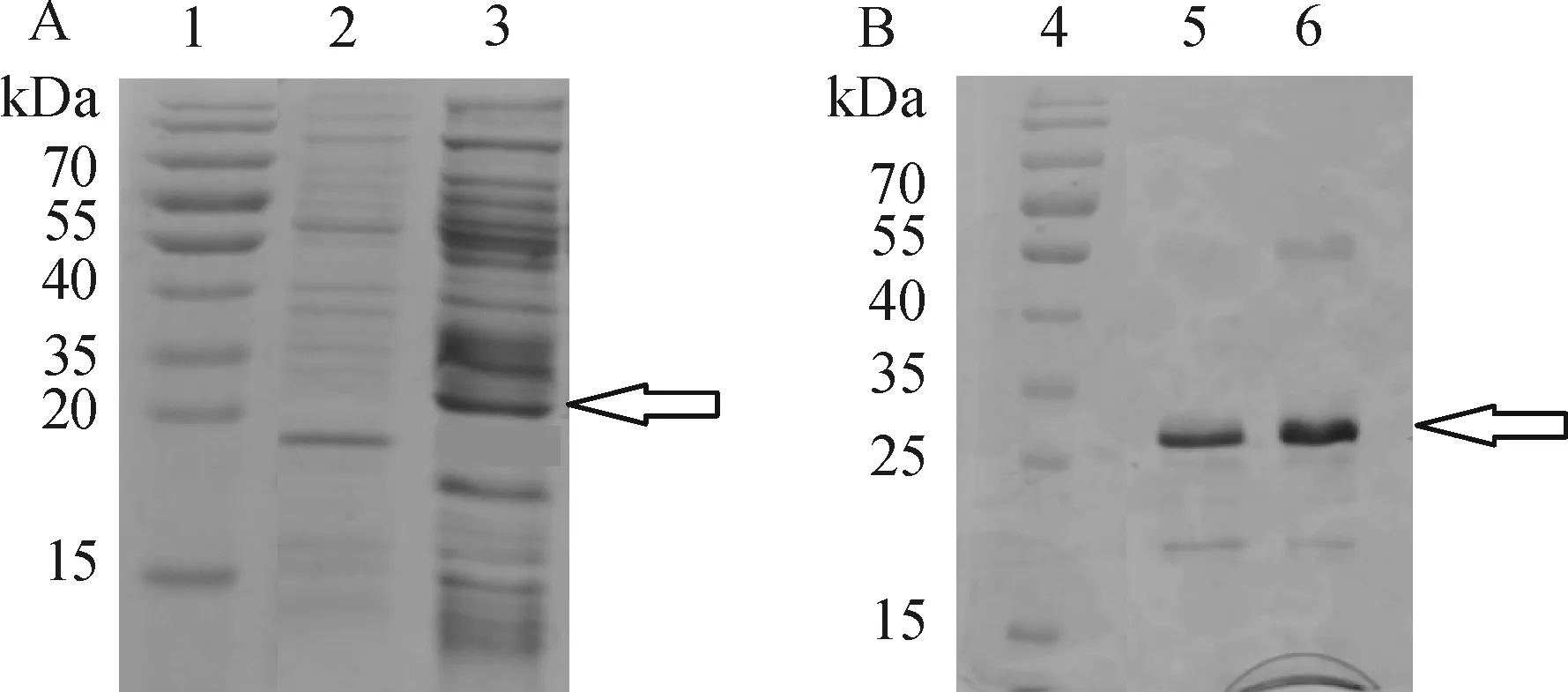
1、4:蛋白marker;2:空载体;3:重组LBBI蛋白;5、6:纯化蛋白.空心箭头表示目的蛋白条带.
图1重组绿豆LBBI蛋白的表达纯化
Figure 1Expression and purification of recombinant mung bean LBBI
2.2重组绿豆蛋白BBI的抑制活性
利用Bowman-Birk 型胰蛋白酶抑制剂(BBI)标准品抑制底物被BAPNA水解速率制作标准曲线,随着标准品浓度增高吸光度越小,但吸光度变化值越大,水解酶被抑制率增高,呈现出线性依赖关系(表1),绘制抑制剂标准曲线,得到拟合后大豆胰蛋白酶抑制剂的回归方程:y=-0.388 1x+0.382 4,R2=0.991 8;曲线相关性良好,即作为绿豆LBBI活性的分析依据.根据计算,大豆BBI标准品活性为956 U/mg.同样的方法对绿豆胰蛋白酶抑制剂重组LBBI的活性绘制标准曲线,重组绿豆蛋白LBBI抑制剂的回归方程:y=0.380 4-0.374 5x,R2=0.991 5.计算绿豆胰蛋白酶抑制剂重组LBBI活性为:689 U/mg.
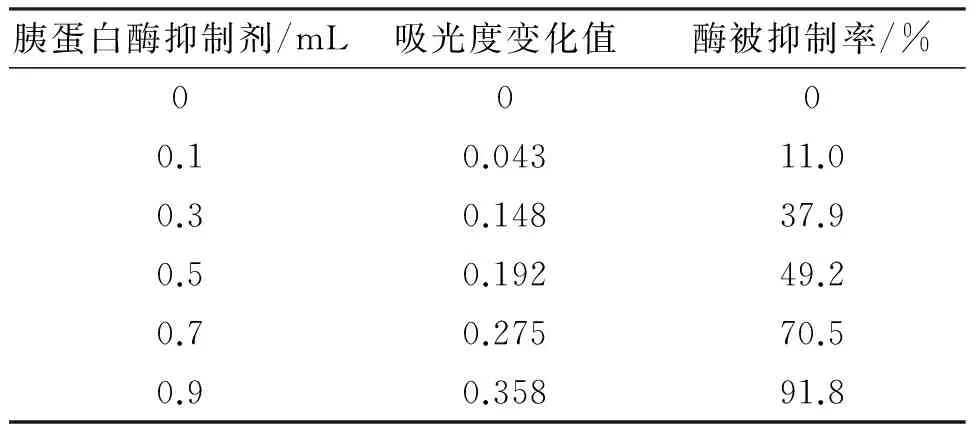
表1 胰蛋白酶抑制剂(BBI)对被水解酶抑制的影响
2.3照射后小鼠的存活率
生理盐水处理(对照组)的小鼠在照射后10 d时出现大量死亡,存活率约20%;13 d内仅存活2只,而安多霖组、重组LBBI组照射后分别存活6只和9只小鼠. 30 d 存活率分别为 10%、30%、45%,各组死亡小鼠平均生存时间分别为 13.45±1.57、19.75±2.24、24.80±3.09 d(表2).可见,LBBI在照射后早期给药可以提高被照射小鼠30 d存活率(P<0.01),明显延长死亡动物的平均生存时间(P<0.01),其中LBBI组活存率最高(45%),其平均生存时间也明显长于其他2组(P<0.01)(图2).
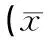
Table 2Effect of 60 Co γ-ray on survival rate and average survival time of mice treated with LBBI

处理死亡数生存时间/d30d存活率/%对照13.45±1.5710安多霖19.75±2.24*30LBBI24.80±3.09*45
注:与对照组比较,*P<0.01.
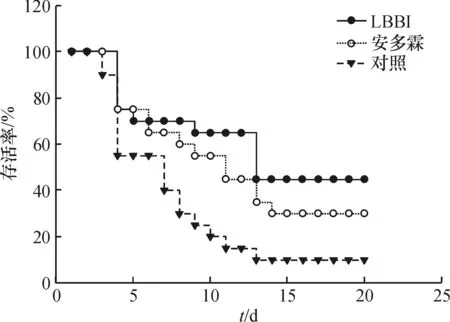
图2 LBBI对 60 Coγ 照射后小鼠存活率的影响
Figure 2Effect of 60 Co γ-ray on survival rate of mice treated with LBBI
2.4重组LBBI对60 Coγ 照射小鼠外周血象恢复的影响
对照组小鼠外周血白细胞数在照射后1 d开始下降,第12 d降至最低值,随后开始缓慢回升.安多霖组和LBBI组白细胞的变化规律基本一致,均在照射后5 d开始逐渐恢复,且在照射后9和12 d明显高于对照组(*P<0.05)(图3).
对照组小鼠外周血红细胞数在照射后急剧下降,13 d时达最低值,随后开始逐渐回升,第20天时红细胞数回复到照前值的50%.安多霖组和LBBI组红细胞的变化规律基本一致,均在照后12 d后开始逐渐回升,且在照射后12、16 d时均明显高于对照组(P<0.05)(图4).
对照组动物外周血小板数在照射后下降,第9天达最低值,随后开始回升,照射后第20天恢复至照前值(90%).2个治疗组的血小板变化规律均与对照组一致,其中安多霖组、LBBI组最低值明显高于对照组(P<0.05),在照射后9、12和16 d时明显高于对照组(*P<0.05)(图5).
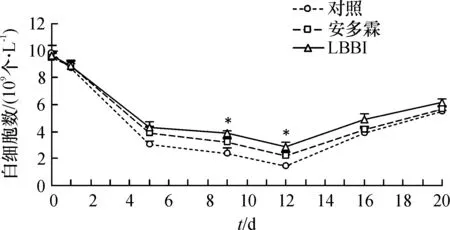
图3 LBBI对60 Coγ照射后小鼠外周血白细胞数的影响
Figure 3Effect of 60 Co γ-ray on white blood cells of mice treated with LBBI
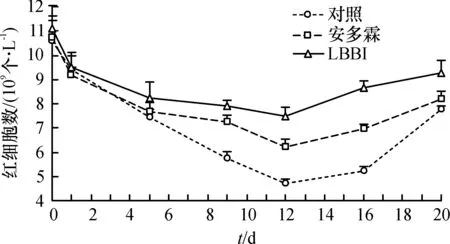
图4 LBBI对60 Coγ 照射后小鼠外周血红细胞数的影响
Figure 4Effect of 60 Co γ-ray on red blood cells of mice treated with LBBI
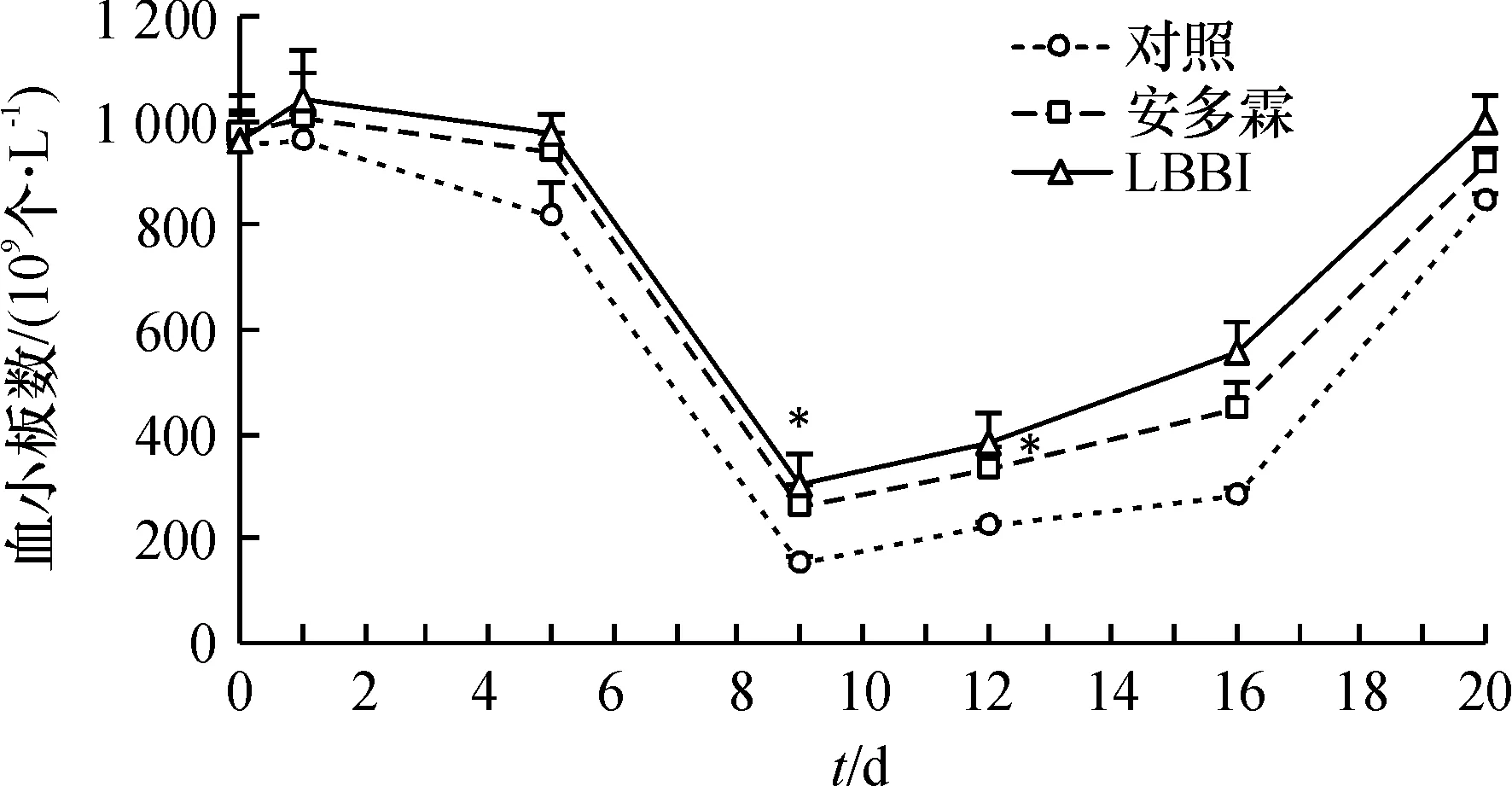
图5 LBBI对60 Coγ 照射后小鼠外周血血小板数的影响
Figure 5Effect of 60 Co γ-ray on blood platelets of mice treated with LBBI
3讨论
目前,动物与植物来源的蛋白酶抑制剂在临床可用于治疗肿瘤、血栓、胰腺炎等疾病[14].有临床试验证据显示该类蛋白酶抑制剂在放化疗的过程中能够降低辐射引发的机体损伤[15].天然的绿豆胰蛋白酶抑制剂是蛋白酶抑制剂的一种,它的成熟肽由72个氨基酸组成,并含有7对二硫键[16],二硫键在机体内可被硫氢还原蛋白还原酶降解形成-SH基,-SH基能够有效地清除多种自由基,而辐射损伤会使机体产生自由基.绿豆胰蛋白酶抑制剂有可能成为抗辐射的候选药物.其在植物种子中含量低,制备繁琐.大肠杆菌表达系统能够经济高效制备外源蛋白,利用该系统是生物制药的重要手段.本文制备了具有生物活性的重组绿豆LBBI.
存活率是反映抗辐射损伤作用最基本、最客观的综合性指标[17],重组绿豆LBBI是否具有抗辐射的作用可用存活率来评价.本研究运用致死剂量对小鼠进行照射.与对照组相比,辐射损伤小鼠在剂量为50.0 mg/(kg·d)的重组LBBI治疗后小鼠的存活率显著性提高,平均生存时间也明显延长(P<0.01);同时,证实了绿豆LBBI与安多霖相比在治疗辐射损伤中没有显著性差异(P>0.05).造血干细胞具有很高的辐射敏感性,受照射后其数量急剧减少,导致外周血中成熟血细胞来源匾乏[18].因此,外周血的白细胞、血小板、红细胞的数量会出现不同程度的降低.笔者的实验证实了小鼠经60 Coγ照射后它们的白细胞、血小板、红细胞数量均明显下降(P<0.05);但与对照组相比,绿豆LBBI不仅能显著抑制小鼠白细胞、红细胞、血小板数量的减少(P<0.05),而且还能明显提高血相的恢复.提示LBBI对受60 Coγ照射小鼠的血液系统具有保护作用.总之,本实验的结果证实LBBI具有较好的防辐射功效,可开发成相关的抗辐射新药,同时也为防辐射药物研发提供新思路.
参考文献:
[1]汪磊,朱波,王国泽,等.肽和蛋白抗辐射损伤作用研究进展[J].广东农业科学,2012(18):233.
WANG L,ZHU B,WANG G Z,et al.The research in the anti-radiation damage effects of peptide and protein[J].Guangdong Agricultural Sciences,2012(18):233.
[2]METREVELI N O,JARIASHVILI K K,NAMICHEISHVILI L O,et al.UV-vis and FT-IR spectra of ultraviolet irradiated collagen in the presence of antioxidant ascorbic acid[J].Ecotoxicology and Environmental Safety,2010,73(3):448-455.
[3]ALMEIDA I F,PINTO A S,MONTEIRO C,et al.Protective effect ofC.sativaleaf extract against UV mediated-DNA damage in a human keratinocyte cell line[J].The Journal of Photochemistry and Photobiology B,2015,144:28-34.
[5]KOUVARIS J R, KOULOULIAS V E,VLAHOS L J.Amifostine: the first selective-target and broad-spectrum radioprotector[J].Oncologist,2007,12(6):738-47.
[6]文镜,赵建,毕欣,等.金属硫蛋白抗辐射的实验研究[J]. 营养学报,2001,23(1):44-46.
WEN J, ZHAO J, BI X, et al. The experimental study on anti-radiation effect of metallothionein[J]. Acta Nutrimenta Sinica, 2001,23(1):44-46.
[7]STICKNEY D R,DOWDING C,AUTHIER S,et al.5-androstenediol improves survival in clinically unsupported rhesus monkeys with radiation-induced myelosuppression[J].International Immunopharmacology,2007,7(4):503.
[8]ATAMAN O U,SAMBROOK S J,WILKS C,et al.The clinical development of molecularly targeted agents in combination with radiation therapy: a pharmaceuticalperspective[J].International Journal of Radiation Oncology, Biology, Physics,2012,84(4):e447-e454.
[9]HOUT R V D, POUW M, GRUPPEN H, et al.Inactivation kinetics study of the kunitz soybean trypsin inhibitor and the bowman-birk inhibitor[J].Journal of Agricultural and Food Chemistry,1998,46(1):282.
[10]DITTMANN K,LÖFFLER H,BAMBERG M,et al.Bowman-Birk proteinase inhibitor (BBI) modulates radiosensitivity and radiation-induced differentiation of humanfibroblasts in culture[J].Radiotherapy and Oncology,1995,34(2):137-143.
[11]COSTA H M,FREITAS JUNIOR A C,AMARAL I P,et al.Metal-sensitive and thermostable trypsin from the crevalle jack (Caranxhippos) pyloric caeca: purification and characterization[J].Chemistry Central Journal,2013,7:6.
[12]LI Q,SUN H,XIAO F,et al.Protection against radiation-induced hematopoietic damage in bone marrow by hepatocyte growth factor gene transfer[J].International Journal of Radiation Biology,2014,90(1):37.
[13]ASSAAD H I, ZHOU L, CARROLL R J,et al.Rapid publication-ready MS-Word tables for one-way ANOVA[J].Springerplus, 2014,3(1):1-8.
[14]SCOTT C J,TAGGART C C.Biologic protease inhibitors as novel therapeutic agents[J].Biochimie,2010,92(11):1681-1688.
[15]RENGAN R,MICK R,PRYMA D,et al.A phase I trial of the HIV protease inhibitor nelfinavir with concurrent chemoradiotherapy (CT-RT) for unresectable stage IIIA/IIIB non-small cell lung cancer: a report of toxicities and clinical response[J].Journal of Thoracic Oncology,2012,7(4):709-715.
[16]QI R F,SONG Z W,CHI C W.Structural features and molecular evolution of Bowman-Birk protease inhibitors and their potential application[J].Acta Biochimicaet Biophysica Sinica,2005,37(5):283-292.
[17]HU Z Q,XING Y L,QIAN Y Y,et al.Anti-radiation damage effect of polyethylenimine as a toll-like receptor 5 targeted agonist[J].Journal of Radiation Research,2013,54(2):247.
[18]TANORI M, PASQUALI E,LEONARDI S, et al.Developmental and oncogenic radiation effects on neural stem cells and their differentiating progeny in mouse cerebellum[J].Stem Cells,2013,31(11):2507.
【中文责编:成文英文责编:李海航】
Preparation of the Recombinant Mung Bean LBBI and Defense of Anti-Radiation in Mice
GAN Xiangdong1, HUANG Rui1, LI Fei2, WANG Jiaxi2, DIAO Aipo1*, LONG Minhui1*
(1. College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China;2. Laboratory of Genomic Engineering, Beijing Institute of Basic Medical Sciences, Beijing 100850, China)
Abstract:On the basis of the confirmed inhibitory activity of the recombinant mung bean LBBI (689 U/mg), the therapeutical effect of recombinant mung bean LBBI protein on radiation injury of mice was investigated. The 60 BALB/c mice were randomly divided into normal saline control, recombinant LBBI and anduolin groups, all of which were irradiated with 60 Coγ at 6.5 Gy for whole body. Half an hour latter, the mice in every group received intravenous injection with normal saline and LBBI (50.0 mg·kg-1·d-1), and intragastric administration with anduolin (3 g·kg-1·d-1) for first time. The treatments were carried out every 24 h for one week. Then, the survival rate and peripheral hemogram recovery of mice were observed. The results indicated that compared to the normal saline group, the 30 days survival rate of group mice injected with LBBI protein was increased significantly (P<0.01), and its average survival time was prolonged (P<0.01). It was confirmed that the number of red blood cell, white blood cells and platelets in LBBI treated group mice were increased significantly than that of normal saline group (P<0.05). This work indicates that the recombinant LBBI can prevent mice from radiation injury.
Key words:recombinant mung bean LBBI; expression; purification; survival rate; anti-radiation
收稿日期:2015-06-19《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
基金项目:国家自然科学基金项目(31271476)
*通讯作者:龙民慧,副研究员,Email:longminhui2006@126.com;刁爱坡,研究员,Email:Diaoaipo@tust.edu.cn.
中图分类号:R963
文献标志码:A
文章编号:1000-5463(2016)01-0079-05

