CFTR基因多态性对男性生殖影响的研究进展
胡春风 综述 刘红英 审校
潍坊医学院生物科学与技术学院(潍坊 261053)
CFTR基因多态性对男性生殖影响的研究进展
胡春风 综述 刘红英 审校
潍坊医学院生物科学与技术学院(潍坊261053)
囊性纤维化(cystic fibrosis, CF)是白种人中常见的致死性常染色体隐性遗传病,是由囊性纤维化跨膜转导调节因子(cystic fibrisis transmembrane conductance regulator, CFTR)基因的突变引起的[1,2],CFTR基因编码的蛋白质具有多种功能,包括cAMP依赖的氯离子通道,碳酸氢盐的分泌和上皮细胞钠通道的调节[3,4]。同时,CFTR也参与了先天性双侧输精管缺如、梗阻性无精子症和男性不育[5]。CFTR基因多态性导致的临床疾病一直以来备受人们关注。通过对CFTR基因多态性引起疾病机制的深入研究,我们可以对携带这些遗传病的夫妇在应用辅助生殖技术(assisted reproductive technology, ART)之前,先进行胚胎植入前遗传学诊断(preimplantation genetic diagnosis, PGD)[6],这将提高后代基因的健康率。本文主要综述了CFTR基因多态性的研究进展。
一、CFTR的结构
CFTR基因于1989年被Riordan等[7]首先克隆并鉴定,全长230kbp[8],定位于人类7q31.2,有27个外显子[9](见表1),编码一条含1480个氨基酸残基的蛋白质。
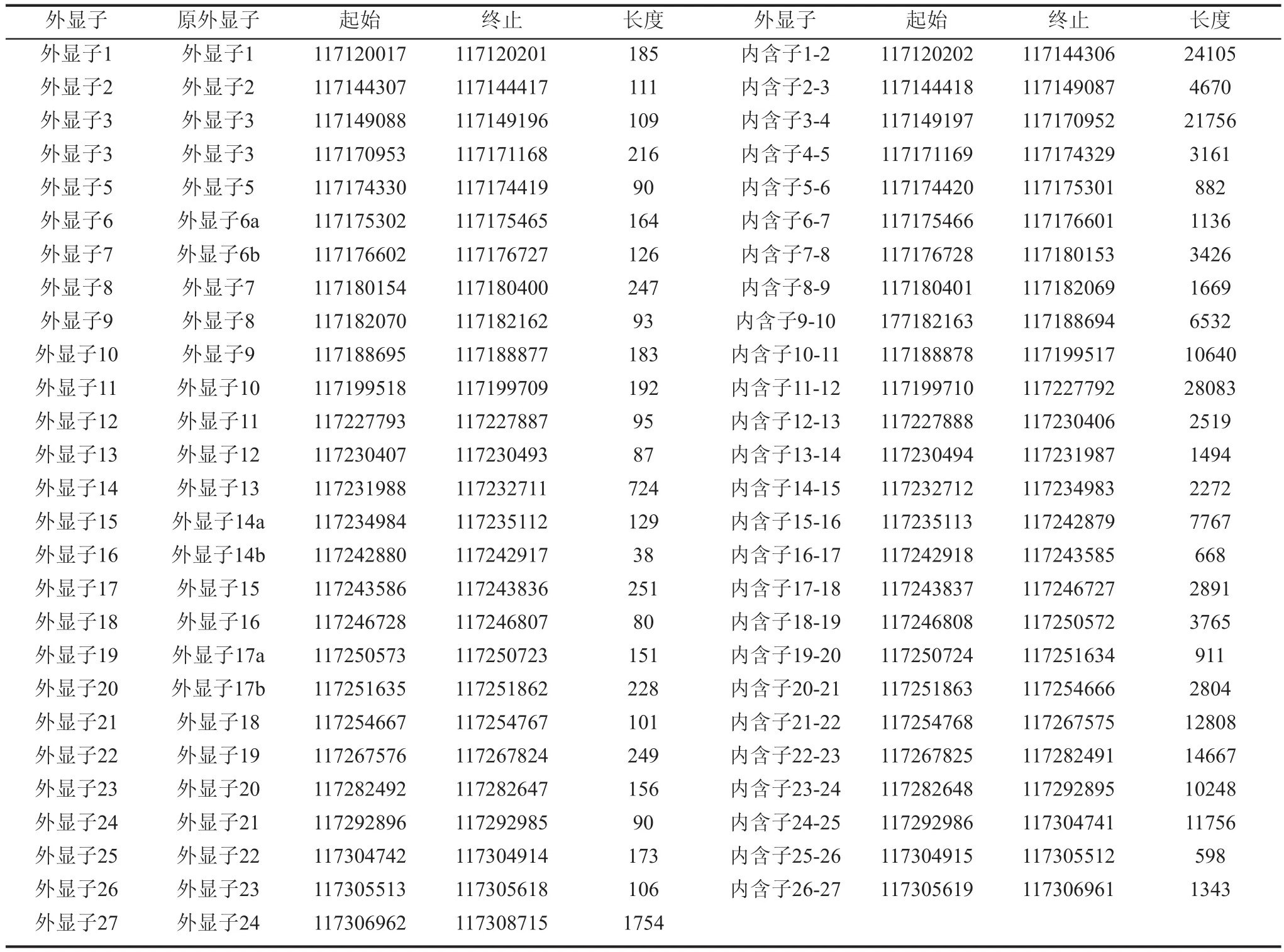
表1 CFTR编码区外显子情况[9]
CFTR是一种位于脂质上皮细胞顶膜依赖cAMP调控的氯离子通道蛋白[10],属于ATP结合盒转运体(ATP-binding cassette transporter,ABC)家族的一种跨膜蛋白质[11]。结构上具有该家族成员的特征:两个跨膜结构域(membrane spanning domains,MSDs)MSD1和MSD2;两个核苷酸结合结构域(nucleotide binding domains,NBDs)NBD1和NBD2;一个调节结构域R domain(如图1)。跨膜结构域MSD1和MSD2共同构成选择性通道。正常情况下,该通道被阴离子或调节结构域R domain阻断,当胞内氯离子浓度升高时,高浓度氯离子激活cAMP依赖的蛋白激酶,通道打开,进而调节通道的开闭;另外,胞外的氯离子浓度也可影响通道的门控,它的浓度升高也可以促进通道的打开,CFTR允许氯离子双向通透[12]。
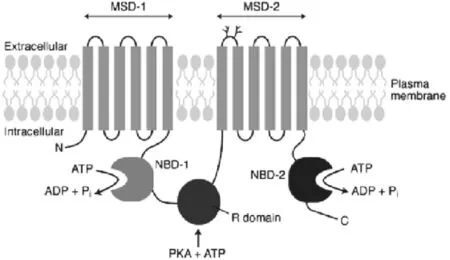
图1 CFTR氯离子通道推测的结构模型[12]
CFTR广泛存在于上皮组织如胰腺、肠道、汗腺、输精管等多个器官中,胞内定位于上皮细胞的顶膜[4]。在这些部位参与物质和液体的分泌,维持管腔内电解质及内稳态的平衡。
二、CFTR的功能与调节
CFTR氯离子通道的开放及关闭是通过细胞内激酶和磷酸酶活性[13]的平衡以及细胞ATP水平严格控制的。CFTR的主要功能是调节cAMP依赖的氯离子跨膜转运,cAMP水平的提高能够激活蛋白激酶A(PKA),蛋白激酶A的活化将引起R domain中丝氨酸的磷酸化,这是CFTR被激活的先决条件[11,14,15]。一旦R domain被磷酸化,ATP随之结合NBD2,当NBD1末端的磷酸基被剪切时,CFTR立体构象发生改变,通道打开氯离子流出。随后,NBD2的ATP被水解,促使通道还原到不活动状态(见图2)。由此可见,磷酸化后的CFTR氯离子通道需要ATP维持通道的开放和关闭。此外,有研究表明一种R domain缺失的CFTR突变,在ATP存在的情况下,并不依赖磷酸化而使通道开放或关闭,R domain与NBDs相互作用并调节其与ATP的亲和力[12]。目前越来越多的研究结果支持氯离子浓度的变化会使CFTR的立体构象改变,从而影响CFTR的磷酸化。
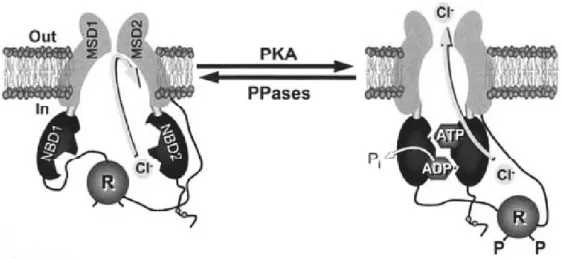
图2 CFTR氯离子通道的门控机制模式图
在正常上皮细胞中,CFTR通道开放,氯离子和钠离子分别从细胞顶膜和细胞侧面的通路先后离开细胞,随后水分子也离开细胞。当CFTR结构异常时,氯离子不能正常输出,此时钠离子、水分子的排出也受到阻滞,致使细胞外堆积更多的粘液,在一些器官(如胰腺、呼吸道)的腔道中形成栓塞。同时,细菌也会在黏液中寄生,造成感染,使嗜中性粒细胞释放大量蛋白酶,进而引起免疫介导的炎症反应[16]。长期的感染和炎症最终造成病情的恶化,疾病晚期会出现器官功能衰竭等症状。研究CFTR在临床疾病病理发生中的作用对于疾病的诊断和治疗具有重要的应用价值。
CFTR主要功能是调节上皮细胞顶膜cAMP依赖的氯离子跨膜转运,此外CFTR还具有调节上皮细胞钠离子通道,促进碳酸氢盐分泌以及调节钾通道[17]等功能,对体内液体转运起着至关重要的作用。但在突变的囊性纤维化细胞中,就不能激活这些氯离子通道了,因此可见CFTR的结构功能在细胞膜离子转运中的重要性并非一般。
三、CFTR基因多态性与囊性纤维化
(一)囊性纤维化
囊性纤维化(cystic fi brosis, CF)是白种人[18]中常见的致死性常染色体隐性遗传病。CF在欧美新生儿的发病率为1/(2 000~3 000),我国则极为罕见[19]。田欣伦等[20]发现,中国人CF患者的CFTR基因突变类型与西方有很大差异,采用欧美国家CFTR基因的筛查突变谱很难发现中国的CF患者,因此西方医生对中国CF患者的诊断也有困难。CF是由CFTR基因突变致其编码的CFTR蛋白功能缺陷所引起的[19]。可导致黏液增多而致全身外分泌腺阻塞及功能紊乱。并累及肺脏、胰腺、肝脏及生殖系统等多个脏器,以呼吸系统损害最为突出[21]。近年来,对CF的治疗取得了很大进展,特别是针对功能缺陷的CFTR蛋白进行靶向治疗以及个性化治疗[22]。
(二)CFTR基因突变类型
引起CFTR结构变异的突变种类繁多,已有超过1900多种不同的CFTR基因突变类型,影响蛋白质的转运、合成、运输、CFTR的功能[11]。为更好的理解基因型及表型关系,近年研究者根据这些基因突变的分子机制及产生后果将突变的CFTR基因分为6类[18]:Ⅰ类和Ⅱ类突变的典型特征是使CFTR表达的数量减少。Ⅰ类突变即无义突变,由于移码突变或错义突变等出现新的终止密码子(PTCs),产生不稳定的mRNA,或是出现经过删减的,缩短的功能缺陷蛋白;Ⅱ类突变是CFTR折叠或成熟的缺陷,致使缺陷CFTR在内质网被过早的降解而不能被正确地运输至顶膜处,包括CF最常见突变类型F508del[23];然而,Ⅲ类和Ⅳ类突变主要表现为通道异常。Ⅲ类突变是破坏CFTR的调节区,使CFTR的磷酸化和与ATP结合不能正常进行,影响通道的激活; Ⅳ类突变的CFTR通道能打开及关闭,但其孔隙构象的异常,导致氯离子的转运降低;V类突变,RNA剪接异常,同时产生正常和异常的转录子,使正常CFTR蛋白数量减少;Ⅵ类突变是由于CFTR蛋白的C-末端截断所致。
(三) CF基因突变体F508del
在德国最常见的CFTR基因突变体是△F508,位于外显子Exonl0中三对碱基的缺失,即引发蛋白质508F位点苯丙氨酸的编码基因缺失[24]。此类突变体引起蛋白质空间构象的异常折叠,当在核糖体内合成的CFTR蛋白原转移到内质网表面进行加工时,内质网表面的泛素连接酶多酶复合体可以识别出,由于△F508缺陷基因的错误表达而被删除的CFTR蛋白中的第二个MSD错误折叠结构区域,然后多酶复合体将被错误表达的CFTR蛋白区域降解,从而使得CFTR蛋白无法照常运送到细胞膜中形成氯离子运输通道[2],即使其中有少数被正确翻译的CFTR蛋白被运送到细胞膜中也不能使原本的氯离子通道有效形成,因此造成氯离子以及其他相关离子及小分子物质(如钠钾离子等)运输的严重障碍。
四、CFTR基因突变与生殖
研究表明,CFTR基因突变可使健康男性出现先天性双侧输精管缺如、先天性单侧输精管缺如或精子质量下降造成男性不育。先天性输精管缺如(congenital absence of the vas deferens,CAVD)临床上又分为先天性双侧输精管缺如(congenital bilateral absence of the vas deferens,CBAVD)和先天性单侧输精管缺如(congenital unilateral absence of the vas deferens,CUAVD)。CUAVD患者多数同时合并无精子症 ,其原因往往是除了缺如的一侧输精管病变外,对侧生殖系存在先天性或后天感染等病理因素[25]。CBAVD目前普遍认为CFTR基因突变是其重要病因,M470V多态性为CFTR基因在外显子10上323位点A→G多态导致的氨基酸替换,属于错义突变,碱基为A则编码甲硫氨酸(Met),碱基为G则编码缬氨酸(Val)。M470V多态性能影响CFTR蛋白氯离子通道内在活性,同时也与生育能力相关,Met470相比Val470生育能力更低。曾国华等[26]应用PCR-单链构象多肽(PCR-SSCP)及DNA测序技术,发现了CFTR基因的外显子10上225位点C碱基的缺失,这是我国人群中首次发现CBAVD患者的CFTR基因突变,通过对该患者的睾丸超微结构进行研究发现,精子细胞头部畸形,胞核染色质呈现明显颗粒状结构,出现核内空泡。精子细胞中段线粒体鞘部分或完全缺失。CBAVD对不育的影响也有睾丸的因素。CBAVD患者通常存在睾丸生精功能障碍,因此其治疗的有效方法是应用穿刺技术吸取精子结合卵胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)技术助孕。然而,Lu等[27]对实施ICSI的945例无精子症患者的研究显示,携带CFTR突变基因的CBAVD患者其辅助生殖下一代出现流产或死胎的概率更高。研究发现,女性CF患者伴有月经失调,宫颈黏液增稠,精子获能下降并影响CF女性的生育能力。
目前,在美国及一些欧洲国家,CFTR基因突变检测已应用于植入前遗传学诊断(preimplantation genetic diagnosis, PGD),将CFTR基因突变筛查作为我国PGD的检查项目,能挑选出携带健康CFTR基因的胚胎,对CAVD患者生育健康下一代具有一定的临床意义。目前国内外部分研究采取对CFTR全外显子基因突变筛查[28],但大多数研究实施的CFTR基因突变检测只是检测一些常见的突变位点,很可能造成漏检。
五、研究前景
目前,人们对于CFTR基因多态性研究最多的是呼吸道和消化道的病变,而对于生殖系统的研究时间尚短。就CF而言,无论是中国还是西方医生,都应注意中国患者CFTR突变谱的特异性[20],且不能忽视漏检基因的存在,其次疾病发生的原因也并非单一,如发病的地域性,发病的轻重及个体差异。对不育症的治疗,最常用最有效的是ICSI技术,但也存在一定的问题,ICSI技术可能会将突变的CFTR基因不可避免的遗传给后代,致使后代不育。因此,携带遗传病的夫妻在进行ICSI技术之前,应先进行胚胎种植前遗传学诊断,若存在CFTR基因突变还需进行基因治疗。
在基因治疗方面,其效果远没有预期的好,加上一些器官(如肺)结构复杂且难以靶向,目前基因治疗尤其个性化治疗还没有根本上的突破。或许可从表观遗传学、mRNA、蛋白质的修饰加工方面考虑,找到更多更有效的治疗方法。总之,在临床工作中要提高对CFTR基因多态性的重视,尽可能多的寻找我国患者CFTR基因突变位点,临床医生应多关注那些表型并不典型的患者,对他们进行更深入的诊治。因此,我们应该竭尽全力扩大调查人群的样本量,建立适合我国国情的CFTR基因突变谱,以使更多患者得到及时的诊断和治疗。期待CFTR基因多态性在疾病诊断和治疗方面有新的突破。
致谢:本课题受国家计生委科研项目资助 (项目编号:C1-89)
关键词囊性纤维化跨膜传导调节因子; 不育,男性;多态现象, 遗传
doi∶10.3969/j.issn.1008-0848.2016.02.016
参 考 文 献
1Griesenbach U, Pytel KM, Alton EW. Hum Gene Ther 2015; 26(5)∶ 266-275
2徐颢溪. 蚌埠医学院学报 2014; 39(10)∶ 1449-1451
3Field PD, Martin NJ. Aust N Z J Obstet Gynaecol 2011;51(6)∶ 536-539
4Collawn JF, Matalon S. Am J Physiol Lung Cell Mol Physiol 2014; 307(12)∶ L917-L923
5Ghorbel M, Baklouti-Gargouri S, Keskes R, et al. Andrologia 2012; 44 suppl 1∶ 376-382
6Biazotti MC, Pinto Junior W, Albuquerque MC, et al. Einstein (Sao Paulo) 2015; 13(1)∶ 110-113
7Riordan JR, Rommens JM, Kerem B, et al. Science 1989;245(4922)∶ 1066-1073
8Guillot L, Beucher J, Tabary O, et al. Int J Biochem Cell Biol 2014; 52∶ 83-93
9Tsui LC, Dorfman R. Cold Spring Harb Perspect Med 2013; 3(2)∶ a009472
10Esmaeili Dooki MR, Tabaripour R, Rahimi R, et al. Gene 2015; 564(2)∶ 193-196
11Linsdell P. World J Biol Chem 2014; 5(1)∶ 26-39
12Sheppard DN, Welsh MJ. Physiol Rev 1999; 79(1 Suppl)∶S23-S45
13Moran O. Int J Biochem Cell Biol 2014; 52∶ 7-14
14Hwang TC, Kirk KL. Cold Spring Harb Perspect Med 2013; 3(1)∶ a009498
15Hunt JF, Wang C, Ford RC. Cold Spring Harb Perspect Med 2013; 3(2)∶ a009514
16 Nousia-Arvanitakis S. J Clim Gastroenterol 1999; 29(2)∶138-142
17Frizzell RA, Hanrahan JW. Cold Spring Harb Perspect Med 2012; 2(6)∶ a009563
18Wilschanski M. Discov Med 2013; 15(81)∶ 127-133
19Derichs N. Eur Respir Rev 2013; 22(127)∶ 58-65
20田欣伦, 徐凯峰. 协和医学杂志 2015; 6(3)∶ 165
21Delatycki MB, Burke J, Christie L, et al. Twin Res Hum Genet 2014; 17(6)∶ 578-583
22Eldredge LC, Ramsey BW. Lancet Respir Med 2014;2(12)∶ 962-964
23Kumar S, Tana A, Shankar A. Eur J Intern Med 2014;25(9)∶ 803-807
24Cai ZW, Liu J, Li HY, et al. Acta Pharmacol Sin 2011;32(6)∶ 693-701
25杨晓健, 袁萍, 吴晓, 等. 中华男科学杂志 2015; 21(3)∶229-233
26曾国华, 邓春华, 林正, 等. 新医学 2000; 31(1)∶ 17-18
27Lu S, Cui Y, Li X, et al. Fertil Steril 2014; 101(5)∶ 1255-1260
28Li H, Wen Q, Li H, et al. J Cyst Fibros 2012; 11(4)∶ 316-323
(2015-12-05收稿)
中图分类号R 698.2

