男性原发性骨质疏松患者VEGF、HIF-1α与骨代谢指标的相关性研究
赵光宗,孙子伟,方军,张龙强,崔好才
(1.潍坊市益都中心医院 脊柱创伤骨科,山东 潍坊 262500;2.青州市人民医院 骨科,山东 潍坊 262500)
男性原发性骨质疏松患者VEGF、HIF-1α与骨代谢指标的相关性研究
赵光宗1Δ,孙子伟1,方军1Δ,张龙强1,崔好才2
(1.潍坊市益都中心医院 脊柱创伤骨科,山东 潍坊 262500;2.青州市人民医院 骨科,山东 潍坊 262500)
目的 观察男性原发性骨质疏松患者血管内皮生长因子(vascular endothelial growth factor,VEGF) 及缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)与骨代谢相关指标的水平,并探讨其相关性。方法 共纳入潍坊市益都中心医院脊柱创伤骨科2013年1月~2014年12月男性病例123例,其中骨量正常组34例、低骨量组39例、骨质疏松组50例,测定HIF-1α、VEGF及骨代谢及骨转化指标水平[骨碱性磷酸酶(bone alkaline phosphatase,BALP)、抗酒石酸酸性磷酸酶5b(tartrate-resistant acid phosphatase 5b,TRACP 5b)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、骨钙素(bone Gla-protein,BGP)、Ⅰ型胶原交联羧基末端肽(human cross-linked carboxy-terminal telopeptide of type Ⅰ collagen,CTX-I)],并进行相关性分析。结果 骨量正常组与低骨量组BALP指标差异无统计学意义,骨质疏松组BALP指标显著低于其余2组(P<0.05)。3组间HIF-1α、VEGF及TRACP 5b、TGF-β1及CTX-I指标随骨量降低而升高,BGP随骨量降低而降低(P<0.05)。HIF-1α与VEGF呈正相关(P<0.05),与BALP、TRACP 5b、TGF-β1及CTX-I呈正相关,与BGP呈负相关(P<0.05)。VEGF与TGF-β1及CTX-I呈正相关,与BGP呈负相关(P<0.05)。结论 HIF-1α及VEGF与骨代谢、骨转化指标显著相关,是骨质疏松病理生理过程的重要影响因素。
骨质疏松;男性;VEGF;HIF-1α;骨代谢
骨质疏松是以骨量减少、骨组织显微结构退化(松质骨骨小梁变细、断裂、数量减少;皮质骨多孔、变薄)为特征,以致骨的脆性增高及骨折危险性增加的一种全身性骨病[1]。目前,随着我国人口老龄化的加剧,我国老年男性原发性骨质疏松症患病率明显升高。骨质疏松引起的疼痛及骨折危险性增加,对老年人的生活质量构成了严重的威胁。研究表明[2],良好的氧浓度是维持骨代谢平衡的重要基础,而低氧状态是导致骨重建及骨转换异常的重要因素。低氧诱导因子(hypoxia-inducible factor 1,HIF-1)作为组织细胞低氧状态下调节氧稳定的核转录因子,可直接调节血管内皮生长因子(vascular endothelial growth factor,VEGF)等的表达参与骨代谢相关信号转导。为此,本研究旨在观察和分析男性原发性骨质疏松患者HIF-1及VEGF与骨代谢相关指标的变化及相关性,现报道如下。
1 资料与方法
1.1 一般资料 潍坊市益都中心医院脊柱创伤骨科2013年1月~2014年12月期间诊治的男性患者123例,年龄63~73岁,平均年龄(68.72±8.16)岁。本研究中123例患者骨量正常组、低骨量组及骨质疏松组分别为34、39、50例。骨量正常组年龄60~71岁,平均年龄(67.02±8.12)岁;低骨量组年龄62~74岁,平均年龄(67.58±8.01)岁;骨质疏松组年龄62~73岁,平均年龄(68.01±7.95)岁。 参照WHO提出的骨质疏松的诊断标准[3],应用双能X线吸收骨密度仪(DEXA)测量L2-4(腰二至四椎体)骨密度,T值<-2.5SD为骨质疏松,T值在-1.0SD~-2.5SD为骨量减少,T值>-1.0SD为骨量正常。排除标准:合并心脑血管、肝、肾功能不全及造血系统等严重原发性疾病者;内分泌疾病(性腺功能减退及Ⅰ型糖尿病等)引起的继发性骨质疏松者;合并肠吸收不良综合征、肌营养不良症、风湿性关节炎、白血病及系统性红斑狼疮等全身性疾病者;因骨折使用石膏外固定期间或拆除后不满半年者;有腰椎间盘突出、腰椎管狭窄症、强直性脊柱炎等原发性骨关节疾病者;合并老年痴呆、精神病及严重神经官能症等无法配合本次研究者;在研究前半年内接受雌激素受体调节剂等可能对检验结果造成影响者。
1.2 研究方法 取纳入病例次日晨空腹静脉血5 mL,离心后取血清置于-70 ℃保存待检,采用ELISA(酶联免疫法)进行骨代谢、骨转化指标及HIF-1α、VEGF测定,骨代谢及骨转化指标主要包括[4]骨碱性磷酸酶(bone alkaline phosphatase,BALP)、抗酒石酸酸性磷酸酶5b(tartrate-resistant acid phosphatase 5b,TRACP 5b)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、骨钙素(bone Gla-protein,BGP)、Ⅰ型胶原交联羧基末端肽(human cross-linked carboxy-terminal telopeptide of type Ⅰ collagen,CTX-I)。ELISA试剂盒购自武汉中美科技有限公司,酶标仪为EXL-200型。

2 结果
2.1 3组患者HIF-1α、VEGF及骨代谢、骨转化指标比较 骨量正常组与低骨量组BALP指标差异无统计学意义,骨质疏松组BALP指标显著低于其余2组(P<0.05)。3组间HIF-1α、VEGF及TRACP 5b、TGF-β1及CTX-I指标随骨量降低而升高,BGP随骨量降低而降低(P<0.05)。见表1。

表1 3组患者HIF-1α、VEGF及骨代谢、骨转化指标比较
*P<0.05,与骨量正常组比较,compared with normal group;#P<0.05,与低骨量组比较,compared with low bone mass group
2.2 HIF-1α、VEGF与骨代谢、骨转换指标的相关性分析 HIF-1α与VEGF呈正相关(P<0.05)。与BALP、TRACP 5b、TGF-β1及CTX-I呈正相关,与BGP呈负相关(P<0.05)。VEGF与TGF-β1及CTX-I呈正相关,与BGP呈负相关(P<0.05)。见表2。
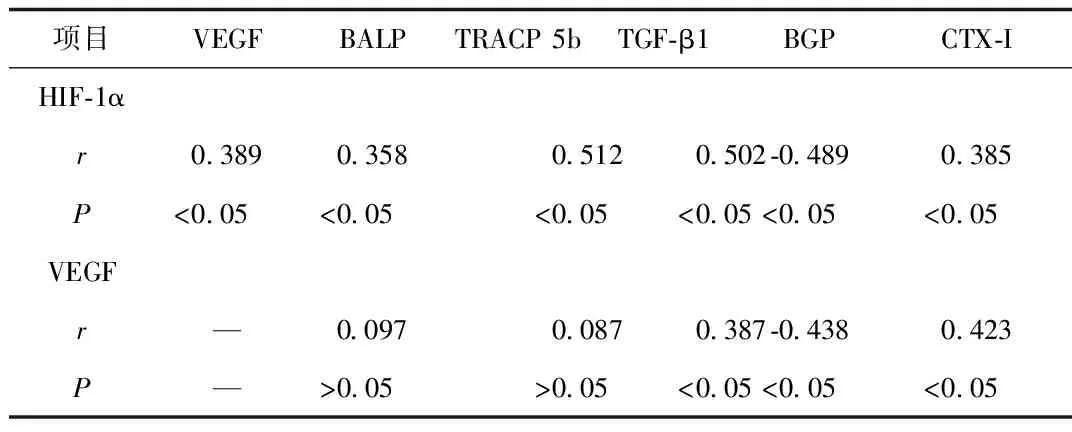
表2 HIF-1α、VEGF与骨代谢、骨转换指标的相关性分析
3 讨论
2003~2006年我国卫生部调查显示,50岁以上中老年人骨质疏松患病率为15.7%,预计2020年我国骨质疏松及骨量减少的居民人数将达2.9亿,目前,骨质疏松症已被确定为“十一五”期间重点攻关的三大老年性疾病之一,近年来,其发病机制及防治也成为医学界关注的热点[5]。
氧稳态的维持是细胞生命活动的前提,丰富的血供是维持正常骨代谢的必要条件。人体心输出量的10%用来参与骨骼系统的血供[6]。在供血不足时,骨组织内氧分压降低会诱导HIF-1表达增高,HIF-1在低氧信号转导过程中起重要作用。成骨细胞是骨形成的主要功能细胞,分泌骨形成过程中的重要细胞因子及酶类,诱导新骨形成。成骨细胞对骨组织氧压力的变化最为敏感,随着年龄增长后,体循环水平的下降,骨组织出现相对低氧的环境,低氧环境下骨组织内过度表达的HIF-1α与HIF-1β在细胞核内形成聚合体,作用于VEGF靶基因,诱导VEGF与成骨细胞内的VEGF受体结合,促进VEGF mRNA的表达及上调,刺激VEGF生成,以便驱化血管长入软骨内,增加软骨内成骨作用[7]。国外学者分别在氧体积分数为 21%, 15%, 10%, 5%, 1%条件下培养 MC3T3-E1 成骨样细胞 6 h,发现VEGF mRNA 在 5%和 1%条件下增加显著[8]。
破骨与成骨过程的平衡是维持骨正常代谢的关键,研究显示[9],低氧可通过诱导HIF-1α产生并激活VEGF影响成骨细胞的增殖、分化外,还可通过VEGF及血管生成素样蛋白4等在内的多种下游基因,直接影响破骨细胞的生成。而VEGF还可直接增强破骨细胞骨吸收功能和延长破骨细胞的存活。研究表明[10],敲除HIF-1α基因的小鼠,成骨细胞骨量明显降低,破骨细胞的数量及骨吸收面积增加,骨脆性也增加,当HIF-1α激活后,骨量及骨内血管也随之明显增加。由此可见,VEGF可同时作用于成骨细胞及破骨细胞,并维持两者的动态平衡。
然而,HIF-1α并不都是通过VEGF来调节骨代谢的,研究显示,低氧等因素可诱导机体产生低氧诱导因子α1,进而通过Osterix因子、表皮生长因子、骨形态发生蛋白、前列腺素2及其受体EP1影响成骨细胞的生成,进而影响骨代谢的平衡[11]。BMPs属TGF-β超家族成员,TGF-β具有多种生物学活性,可促进成骨细胞增殖,促进破骨细胞凋亡, 在维持骨吸收与骨形成的平衡中发挥着重要的作用[12]。文献报道[13],绝经后骨质疏松患者血清TGF-β1显著降低,其水平与骨密度呈正相关。低氧环境下HIF-1α与TGF-β1也有一定的联系,TGF-β1是HIF-1α的主要靶基因,HIF-1α可促进其表达。本研究显示,骨质疏松组TGF-β1水平最高,且HIF-1α及VEGF与TGF-β1呈正相关(P<0.05)。
本研究结果还显示,3组患者HIF-1α及VEGF水平组间比较差异有统计学意义(P<0.05),以骨质疏松组HIF-1α及VEGF水平最高(P<0.05)。提示骨质疏松患者骨骼系统出现了明显的低氧状态,这一低氧诱导了VEGF的表达,成骨及破骨作用均有所增加,但骨吸收大于骨形成,这也可能是骨质疏松发病的重要病理基础。
TRACP 5b是第2代骨吸收标志物,特异性及敏感性较高,均来源于破骨细胞。CTX-1是反映I型胶原分解的特异性指标,I型胶原降解形成C-末端肽,进一步降解形成CTX-1,在骨代谢正常时,I型胶原降解量极微,血中CTX-1水平极低,而当骨转换加快,破骨细胞活性增强时,I型胶原降解增加,即可检测到血清中高水平的CTX-1。Obrant 等研究发现[14],骨质疏松骨折妇女TRACP显著升高,50~79岁女性CTX-1与TRACP与BMD呈负相关,本研究与其报道相符。
BALP来源于成骨细胞,是反映成骨细胞活性并作为骨形成的标志物之一,可提高局部磷酸含量并为骨基质矿化所必须。BGP是成骨细胞成熟的标志,主要出现在矿化期,二者可一定程度反映成骨细胞分化的程度及功能的表达。研究显示[15],敲除HIF-1α基因的小鼠,其体内BALP及BGP表达降低,而vHL基因敲除,HIF-1α蛋白表达升高后,BALP及BGP也随之升高。研究显示[16],50~64岁年龄段女性BGP、BALP明显高于其他年龄组,与骨密度(bone mineral density,BMD)呈负相关,而65岁以后二者水平开始下降。本研究中男性为60~75岁年龄组,结果显示,HIF-1α、VEGF与BGP均呈负相关(P<0.05),HIF-1α与BALP呈正相关(P<0.05),但并未显示65岁以后BALP又有下降趋势,有待进一步大样本分层研究。
双能X线吸收法测量骨密度是诊断骨质疏松和骨量减少的主要技术手段,但大量骨丢失至少6~12个月后才能观察到骨密度的改变,而骨密度正常的案例也有发生骨折的危险,而骨代谢指标可实时反映骨代谢状态,其变化也早于骨密度的改变,而且其与BMD存在重要关联。而HIF-1α、VEGF与骨代谢、骨转换也密切相关,因此,了解老年男性患者相关指标的变化,对于骨质疏松的早期诊断及预防治疗具有重要临床价值。
[1] 黄公怡.骨质疏松性骨折[J].老年医学与保健,2003,9(2):79-81.
[2]张学翠,金小岚,刘东方.低氧对成骨细胞骨形成的影响[J].中华骨质疏松和骨矿盐疾病杂志,2013(2):184-188.
[3]WHO:Guidelines for preclinical evaluation and clinical trials in osteoporosis[M].World Health Organization,1998.
[4]喻晶,余学锋.骨代谢标志物和骨矿密度在骨质疏松症中的应用[J].临床内科杂志,2009,26(3):155-157.
[5]王洪复.老年性骨质疏松症病理机制与防治原则[J].中华保健医学杂志,2010,12(1):1-4.
[6]郑青,梁宁.老年性骨质疏松患者血清细胞因子水平与OPG/RANKL/RANK轴的相关性[J].中国老年学杂志,2012,32(9):3651-3653.
[7]蔡婧,郭常辉,低氧诱导因子-1α与骨质疏松[J].中国老年学杂志,2013,33(3):741-743.
[8]Kular J,Tickner J,Chim SM,et al.An Overview of the Regulation of Bone Remodelling at the Cellular Level[J].Clinical biochemistry,2012,45(12): 863-873.
[9]杨峰.低氧诱导因子-1α介导鼠胚成骨细胞血管内皮生长因子表达的实验研究[D].大连:大连医科大学,2009.
[10]刘晓东.成骨细胞的低氧感应机制及其在代谢性骨病中的调控作用[D].上海:上海交通大学,2007.
[11]赵星辰,田京.低氧与成骨及破骨细胞代谢[J].中国组织工程研究志,2012,14(12):1489-1490.
[12]黄生高,闰颖,促成骨细胞的增殖和分化效应[J].中国现代医学杂志,2009,19(20):189-190.
[13]韦朝晖,周美荷.绝经后骨质疏松症患者细胞因子、骨密度及雌激素水平的关系[J].放射免疫学杂志,2008,21(1):49-50.
[14]Obrant KJ,Ivaska KK,Gerdhem P,et al.Biochemical markers of bone turnover are influenced by recently sustained fracture[J]. Bone,2005,36(5):786-792.
[15]刘晓东,邓廉夫,王君,等,低氧诱导因子1α在骨形成过程中对成骨细胞功能的调控[J].中华医学杂志,2007,87(47):3357-3361.
[16]张萌萌,张艳会,毛未贤,等.1084例女性TRACP、CTX-1、BALP、BGP、钙磷代谢指标与BMD相关性[J].中国骨质疏松杂志,2013,19(9):902-906.
(编校:王俨俨)
Correlation of VEGF, HIF-1α and bone metabolic markers in male patients with primary osteoporosis
ZHAO Guang-zong1Δ, SUN Zi-wei1, FANG Jun1Δ, ZHANG Long-qiang1, CUI Hao-cai2
(1. Department of Spine Trauma and Orthopedics, Weifang Yidu Central Hospital, Weifang 262500, China; 2. Department of Orthopedics, Qingzhou City People’s Hospital, Weifang 262500, China)
ObjectiveTo observe the levels of vascular endothelial growth factor (VEGF) and hypoxia-inducible factor 1α (HIF-1α) and bone metabolism related indicators in male patients with primary osteoporosis, and explore their relevance.MethodsA total of 123 cases of male patients selected from January 2013 to December 2014, of which 34 cases in normal bone mass group, 39 cases in low bone mass group, 50 cases in osteoporosis group. The HIF-1α and VEGF and bone metabolism related indicators [tartrate-resistant acid phosphatase 5b (TRACP 5b), transforming growth factor-β1 (TGF-β1), bone Gla-protein (BGP) and human cross-linked carboxy-terminal telopeptide of type Ⅰ collagen (CTX-I)] were determined, and their correlations were analyzed.ResultsThere were no significant difference in BALP levels between normal bone mass group and low bone mass group. The BALP level in osteoporosis group was lower than the other two groups(P<0.05). The HIF-1α, VEGF, TRACP 5b, TGF-β1 and CTX-I levels increased with the decreasing of bone mass, BGP level decreased with the decreasing of bone mass(P<0.05). HIF-1α was positively correlated with VEGF, BALP, TRACP 5b, TGF-β1 and CTX-I, and negatively correlated with BGP(P<0.05). VEGF was positively correlated with TGF-β1 and CTX-I, and negatively correlated with BGP(P<0.05).ConclusionHIF-1α, VEGF and bone metabolism related indicators is closely related, which are confirmed to be an important factor of pathology and physiology of osteoporosis.
osteoporosis; male; VEGF; HIF-1α; bone metabolism
赵光宗,男,硕士,主治医师,研究方向:脊柱创伤外科E-mail:tjhqlbo@126.com;方军,通信作者,男,主任医师,研究方向:脊柱创伤外科,E-mail:45156106@qq.com。
R681
A
1005-1678(2016)01-0068-03

