亚慢性苯吸入暴露抑制小鼠单倍体精子核蛋白基因的表达
张亚亚,覃琼玉,林冲,孙书强,朱华,杨新军,闫洪涛
(温州医科大学,浙江 温州 325035,1.环境与公共卫生学院预防医学系;2.基础医学院)
亚慢性苯吸入暴露抑制小鼠单倍体精子核蛋白基因的表达
张亚亚1,覃琼玉1,林冲1,孙书强1,朱华2,杨新军1,闫洪涛1
(温州医科大学,浙江温州325035,1.环境与公共卫生学院预防医学系;2.基础医学院)
[摘 要]目的:探讨苯对小鼠精子生成损伤的主要阶段。方法:6~8周龄C57BL/6J雄性小鼠,按体质量随机分为3组,对照组、1 ppm和100 ppm苯暴露组,模拟职业暴露情况,实施每天8 h,每周5 d,共13周的亚慢性动式吸入染毒。HE染色观察睾丸组织病理学改变。选取精子发生中阶段特异性表达基因作为不同阶段精子的marker,选定的marker基因有代表未分化型精原细胞的Plzf,分化型精原细胞的Stra8,初级精母细胞的Sycp3,圆形精子的过渡蛋白Tnp1、Tnp2,长形精子的Akap4,以及鱼精蛋白Prm1、Prm2,采用实时荧光定量PCR(RT-PCR)检测marker基因mRNA表达。结果:苯暴露组小鼠睾丸组织呈现嗜酸性染色增强,1 ppm组出现少量核溶解、细胞脱落等改变;100 ppm组小鼠睾丸生殖细胞变性、坏死明显增多,管腔中心无(或少)细胞的曲细精管数量明显增多,表明亚慢性苯暴露可引起小鼠睾丸的病理改变。苯暴露组Plzf、Stra8、Sycp3、Akap4 的mRNA表达均未显示统计学差别,而1 ppm组鱼精蛋白Prm2的mRNA表达显著降低(P<0.01);100 ppm组过渡蛋白Tnp1、Tnp2,鱼精蛋白Prm1、Prm2的mRNA表达均显著降低(P<0.05)。结论:亚慢性苯吸入暴露可导致小鼠睾丸组织的病理改变,下调Tnps和Prms mRNA表达,主要影响单倍体精子细胞核内组蛋白被鱼精蛋白取代的过程。
[关键词]苯;精子;精子生成;过渡蛋白;鱼精蛋白;小鼠
苯被广泛应用于工业生产和日常生活,从作为原料、溶剂、稀释剂等工业应用,到香烟烟雾、室内装修、汽车尾气等生活环境污染,苯几乎无处不在,暴露难以避免[1]。尽管苯主要损害造血系统,但苯的雄性生殖毒性也被一些研究所报道。有研究表明,苯接触工人呈现精子数量下降,异常形态精子比例增加[2],以及精子DNA损伤、非整倍体和染色体结构畸变精子的比率升高[3-4]等现象。毒理学研究显示,亚慢性苯暴露可导致实验小鼠的精子浓度降低、活力下降[5],提示苯对精子生成具有明确的毒性作用。然而,苯对生精过程不同阶段的影响特征还不清楚。本研究通过观察亚慢性苯暴露小鼠睾丸组织病理学改变,以及检测睾丸各类精细胞中阶段特异性表达基因(即不同生精阶段精子的marker基因)mRNA的表达,以探讨苯对精子生成损伤的主要阶段。
1 材料和方法
1.1材料 C57BL/6J雄性小鼠6~8周龄,由温州医科大学实验动物中心提供,许可证编号:SCXK(沪)2007-0005。HOPE-MED液气类动式染毒系统(天津合普,中国);QC9800气相色谱仪(上海科创色谱仪器厂,中国);Leica CM1950冰冻切片机(Leica,德国);Olympus CX41显微镜(Olympus,日本);实时荧光定量PCR(qPCR)仪(Bio-Rad,美国)。苏木素伊红(HE)染色试剂盒(Beyotime,中国);Trizol试剂(Sigma,美国);ReverTra Ace qPCR RT Kit (TOYOBO,日本);qPCR反应试剂盒(TaKaRa,日本)。
1.2方法
1.2.1亚慢性苯吸入毒性实验:将30只小鼠随机分为3组,即对照组(0 ppm)、1 ppm组和100 ppm组,每组10只。实施每天8 h,每周5 d,共13周的亚慢性苯动式吸入毒性实验。染毒期间,应用气相色谱检测染毒柜内苯浓度,确保柜内浓度不超过设计浓度的10%。于最后染毒日,处死小鼠,取双侧睾丸[5]。
1.2.2冰冻切片:睾丸固定于多聚甲醛24 h,蔗糖脱水,OCT冷冻包埋,置冷冻切片机速冻至适宜硬度,以4 μm厚度连续切片,每个标本连续切片4张。
1.2.3HE染色:冰冻切片固定10~30 s,自来水洗1 min,苏木素染色1 min,流水冲洗3 s,1%盐酸乙醇分化3 s,自来水浸泡返蓝15 min,伊红染色1 min,75%、95%、100%乙醇梯度脱水各1 min,二甲苯透明10 min,中性树胶封片,显微镜下观察。
1.2.4RNA抽提、反转录和qPCR:采用Trizol法提取小鼠睾丸细胞总RNA,取1 μg总RNA进行反转录,按试剂盒说明书操作。选取精子发生中阶段特异性表达基因作为不同阶段精子的marker,选定的marker基因有代表未分化型精原细胞的Plzf,分化型精原细胞的Stra8,初级精母细胞的Sycp3,圆形精子的过渡蛋白Tnp1、Tnp2,长形精子的Akap4,以及鱼精蛋白Prm1、Prm2,选取GAPDH作为内参基因,设计相应引物进行qPCR扩增鉴定,引物至少跨一个内含子,以避免基因组DNA污染。qPCR引物序列和产物大小见表1。qPCR反应体系:SYBR Premix Ex TapTM(2×)10 μL;引物(10 μmol/L)各0.6 μL;cDNA 1 μL;加去离子水至20 μL。反应条件:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s,共40个循环。PCR产物经溶解曲线与琼脂糖凝胶电泳分析,以保证产物的特异性。每个样品做3个平行管,使用2-△△CT法进行数据处理。

表1 qPCR引物序列和产物大小
1.3统计学处理方法 采用SPSS16.0统计软件进行分析。计量资料以±s表示,组间差异比较分析采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1睾丸HE染色 苯暴露组小鼠睾丸组织呈现嗜酸性染色增强,1 ppm组偶见核溶解、细胞脱落等改变;100 ppm组小鼠睾丸生殖细胞变性、坏死的表现明显,曲细精管管腔内长形精子的数量明显减少,管腔中心无(或少)细胞的曲细精管数量显著增多,见图1。
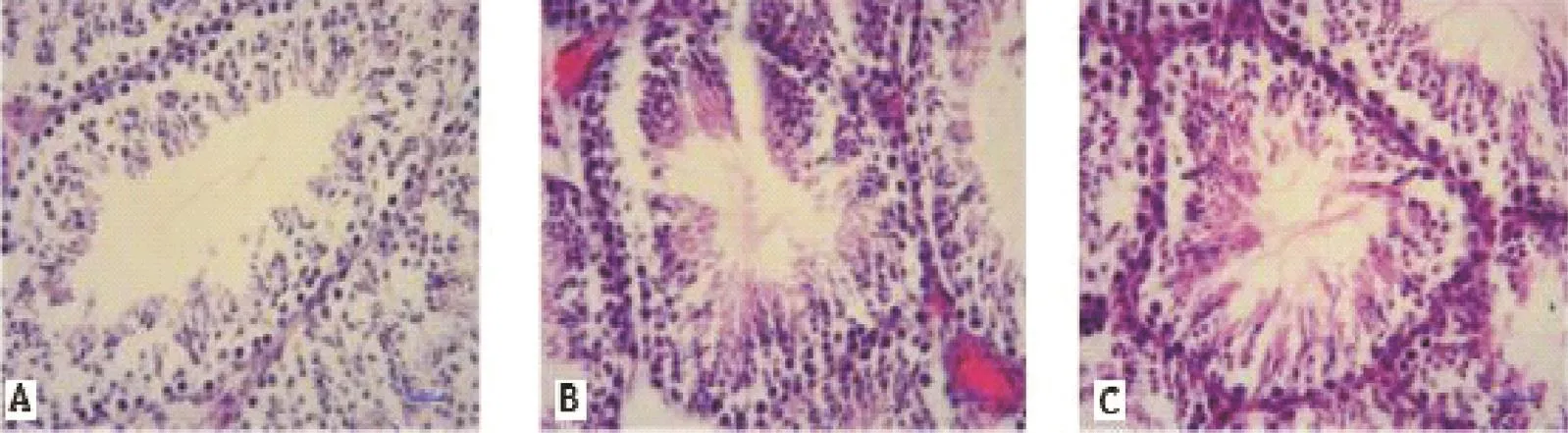
图1 睾丸组织病理学HE染色(×400)
2.2生精阶段特异性表达基因mRNA表达 与对照组相比,苯暴露组marker基因Plzf、Stra8、Sycp3、Akap4 mRNA表达差异均无统计学意义(P>0.05);1 ppm组鱼精蛋白Prm2的mRNA表达显著降低,差异有统计学意义(P<0.01);100 ppm组过渡蛋白Tnp1、Tnp2以及鱼精蛋白Prm1、Prm2的mRNA表达均显著降低,差异有统计学意义(P<0.05或P<0.01),见图2。
3 讨论
本研究显示,在100 ppm苯暴露组小鼠睾丸呈现明显的生殖细胞变性、坏死,曲细精管管腔内长形精子的数量减少,管腔中心无(或少)细胞的曲细精管数量增多等病理学改变,该结果与先前的报道[6-7]结果相似。早在1985年,Ward等[6]进行的亚慢性苯动式吸入毒性实验中,发现300 ppm苯暴露组小鼠双侧睾丸萎缩、附睾中精子数量显著减少、非正常精子比例增加等变化。在江俊康等[7]应用更高浓度(400、2 000、10 000 mg/m3)苯的静式染毒实验中,观察到小鼠精子畸形率增加、睾丸各级生精细胞减少等病理变化。综合这些研究,表明高浓度(100 ppm及以上)苯吸入暴露可导致小鼠睾丸生精细胞出现病理学改变,这为我们先前在100 ppm苯亚慢性吸入毒性实验中发现的小鼠精子浓度降低提供了病理学支持[5]。然而,本项研究在1 ppm苯暴露组并未发现有明确意义的组织学改变,该结果也与Ward等[6]在低浓度(1、10、30 ppm)苯吸入观察的结果一致。
精子发生是一个高度复杂的细胞分化过程,经历了有丝分裂、减数分裂和精子形成3个阶段:①有丝分裂期:A型精原细胞通过增殖产生A、B两型精原细胞,A型精原细胞不进入分化途径,保持有丝分裂能力;B型精原细胞进入分化途径,产生初级精母细胞;②减数分裂期:初级精母细胞进入第1次减数分裂,形成2个次级精母细胞,次级精母细胞进入第2次减数分裂,形成单倍体的圆形精子细胞;③精子形成期:圆形精子细胞进行一系列复杂的形态学变化,包括核的浓缩成型,顶体及鞭毛、轴丝的发生以及核蛋白转型和修饰,发育为成熟的精子。
在精子发生过程中,伴随许多睾丸基因的阶段特异性表达,其表达受严格的时空调节,在精子发生过程中发挥着关键性的作用。本研究所检测的8个基因都具有明显的睾丸组织表达特征,同时也是精子发生中特异表达的基因,具有显著的阶段表达特异性。这些基因被用做不同生精阶段精子的marker的合理性已在其他一些研究中得到证实[8-11],marker基因的表达变化可以反映相应细胞数量的变化。
本研究结果显示,苯暴露组未分化型精原细胞marker基因Plzf、分化型精原细胞marker基因Stra8、初级精母细胞marker基因Sycp3、长形精子marker基因Akap4的mRNA表达均未有明显差异,提示苯暴露并未对精子生成过程中未分化型精原细胞、分化型精原细胞、精母细胞、长形精子产生明显损伤作用。
初级精母细胞分裂产生单倍体的圆形精子细胞,标志着精子变态过程的开始。过渡蛋白特异表达于圆形精子,是圆形精子marker基因[12],鱼精蛋白阶段特异表达于精子变态过程中。过渡蛋白和鱼精蛋白在哺乳动物精子发生中精细胞组蛋白的置换和染色质的凝结中发挥着重要作用。在精子细胞变态早期,伴随着核浓缩现象出现了核组蛋白-Prms的转换,体细胞组蛋白逐渐被睾丸特异性组蛋白(H1T)代替,随后Tnps又代替了H1T,Prms又代替Tnps,完成精子细胞核蛋白的转换。随着精子的成熟,Prms与精子核DNA的结合越来越紧密,最后形成高度浓缩的精子特异性染色质,从而保护精子DNA免受氧化应激和其他内外因素的影响[13]。
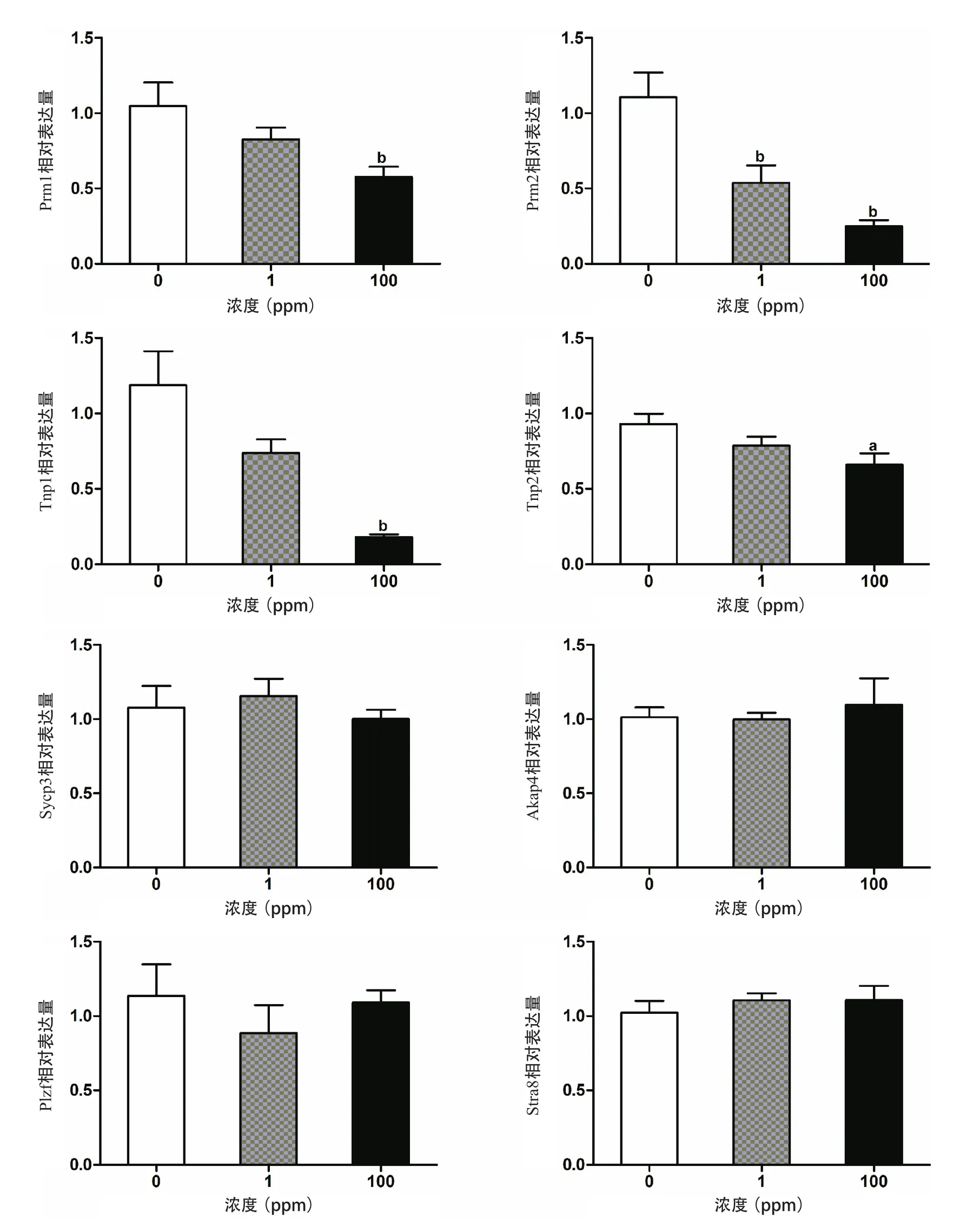
图2 小鼠睾丸精子生成阶段特异性表达基因mRNA表达
本研究结果显示,1 ppm组Prm2的mRNA表达显著降低;100 ppm组Prm1、Prm2、Tnp1、Tnp2的mRNA表达均明显降低,提示苯对生精的影响主要发生在单倍体精子阶段,可能主要影响精子细胞核内组蛋白被Prms的取代过程,造成核蛋白组型转换异常。有研究表明,核蛋白组型转换异常,使染色质的结构变得松散,精子DNA链上的电荷无法中和,从而对精子DNA产生损伤[14-15]。精子核蛋白成熟度和精子DNA完整性存在显著正相关[16],Prms缺乏比例高时,精子DNA碎片化程度显著升高,精子头部异常比例显著升高[17]。该结果对于已有的一些有关苯精子毒性的研究报道给予了一个合理的解释,如苯接触工人呈现精子数量下降,异常形态精子比例增加[2],以及精子DNA损伤、非整倍体和染色体结构畸变精子的比率升高[3-4],实验小鼠的精子浓度降低、活力下降等[5]。
综上所述,苯暴露可引起小鼠睾丸病理学改变,主要影响单倍体精子细胞核内组蛋白被Prms取代的过程。该研究丰富了苯对精子毒性机制的认识,对已经报道的苯对精子的损伤效应提供了合理的解释。
参考文献:
[1] 林冲, 刘政, 于秀远, 等. 亚慢性苯吸入小鼠凋亡相关基因Survivin、Bcl2L13的表达与甲基化状态分析[J]. 温州医科大学学报, 2014, 44(7)︰ 480-484.
[2] KATUKAM V, KULAKARNI M, SYED R, et al. Effect of benzene exposure on fertility of male workers employed in bulk drug industries[J]. Genet Test Mol Biomarkers,2012, 16(6)︰ 592-597.
[3] XING C, MARCHETTI F, LI G, et al. Benzene exposure near the U.S. permissible limit is associated with sperm aneuploidy[J]. Environ Health Perspect, 2010, 118(6)︰ 833-839.
[4] MACHETTI F, ESKENAZI B, WELDON R H, et al. Occupational exposure to benzene and chromosomal structural aberrations in the sperm of Chinese men[J]. Environ Health Perspect, 2012, 120(2)︰ 229-234.
[5] 刘政, 刘子巍, 林冲, 等. 亚慢性低浓度苯暴露对小鼠精子活力的影响[J]. 毒理学杂志, 2013, 27(3)︰ 207-209.
[6] WARD C O, KUNA R A, SNYDER N K, et al. Subchronic inhalation toxicity of benzene in rats and mice[J]. Am J Ind Med, 1985, 7(5-6)︰ 457-473.
[7] 江俊康, 翁诗君. 苯对雄性小鼠生殖系统的影响[J]. 中国工业医学杂志, 2004, 17(2)︰ 94-96.
[8] COSTOYA J A, HOBBS R M, BARNA M, et al. Essential role of Plzf in maintenance of spermatogonial stem cells[J]. Nat Genet, 2004, 36(6)︰ 653-659.
[9] SADATE-NGATCHOU P I, PAYNE C J, DEARTH A T, et al. Cre recombinase activity specific to postnatal, premeiotic male germ cells in transgenic mice[J]. Genesis, 2008, 46 (12)︰ 738-742.
[10] SCHALK J A, DIETRICH A J, VINK A C, et al. Localization of SCP2 and SCP3 protein molecules within synaptonemal complexes of the rat[J]. Chromosoma, 1998, 107(8)︰540-548.
[11] BROWN P R, MIKI K, HARPER D B, et al. A-kinase anchoring protein 4 binding proteins in the fi brous sheath of fl agellum[J]. Biol Reprod, 2003, 68(6)︰ 2241-2248.
[12] ULLAS K S, RAO M R. Phosphorylation of rat spermatidal protein TP2 by sperm-specific protein kinase A and modulation of its transport into the haploid nucleus[J]. J Biol Chem, 2003, 278(52)︰ 52673-52680.
[13] BRAUN R E. Packaging paternal chromosomes with protamine[J]. Nat Genet, 2001, 28(1)︰ 10-12.
[14] EVENSON D P, LARSON K L, JOST L K. Sperm chromatin structure assay︰ Its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques[J]. J Androl, 2002, 23(1)︰ 25-43.
[15] 黄学锋, 金建远, 费前进, 等. 精子DNA损伤︰ 独立的精子质量评价指标[J]. 温州医学院学报, 2010, 40(3)︰ 239-242.
[16] 陈康, 周宇林, 余波澜, 等. 精子核蛋白组型异常及DNA损伤与精子活动力的相关性研究[J]. 中华临床医师杂志(电子版), 2013, 7(2)︰ 575-578.
[17] UTSUNO H, MIYAMOTO T, OKA K, et al. Morphological alterations in protamine-defi cient spermatozoa[J]. Hum Reprod, 2014, 29(11)︰ 2374-2381.
(本文编辑:赵翠翠,丁敏娇)
·读者·作者·编者·
Expressions inhibition of haploid sperm nucleoprotein genes in mice sub-chronically exposed to benzene via inhalation
ZHANG Yaya1, QIN Qiongyu1, LIN Chong1, SUN Shuqiang1, ZHU Hua2, YANG Xinjun1, YAN Hongtao1. 1.Department of Preventive Medicine, Environmental Science and Public Health College, Wenzhou Medical University, Wenzhou, 325035; 2.Basic Medicine College, Wenzhou Medical University, Wenzhou, 325035
Abstract:Objective: To explore the major damage stage of spermatogenesis in mice submitted to subchronic inhalation of benzene. Methods: C57BL/6J mice were randomly divided into control, 1 ppm and 100 ppm benzene exposure group. Simulated occupational exposure condition, a subchronic inhalation exposure test was carried out using the dynamic control equipment. The pathological change of testicular tissue was observed with HE staining. The mRNA expression of marker genes of spermatogenesis was quantitatively tested with real-time polymerase chain reaction, the selected marker genes included Plzf of undifferentiated spermatogonia, Stra8 of differentiated spermatogonia, Sycp3 of primary spermatocyte, Tnp1 and Tnp2 of round spermatid, Akap4 of elongating spermatid, as well as Prm1 and Prm2. Results: Enhanced eosinophilic staining were observed in mice testicular tissue section of benzene exposure groups, a few karyolysis and exfoliative cells were found in 1 ppm exposure group,the phenomenon of mice testis germ cell degeneration and necrosis were more obvious in 100 ppm exposure group,the number of seminiferous tubules with no or few germ cells were increased obviously. It suggested that subchronic benzene exposure could induce pathological change in mice testis. The mRNA expression of Plzf, Stra8, Sycp3,Akap4 did not show statistical difference in all groups, Prm2 expression was signifi cantly reduced in 1 ppm group than that of control group (P<0.01). The mRNA expression of transition protein Tnp1 and Tnp2, protamine Prm1 and Prm2 were signifi cantly reduced in 100 ppm exposure group than that of the control and 1 ppm group. Conclusion:Subchronic benzene exposure can induce the pathological change in mice testis, down-regulate the mRNA expression of Tnps and Prms, mainly infl uence the process of histone replaced by protamine in round spermatid nuclei.
Key words:benzene; sperm; spermatogenesis; transition protein; protamine; mice
[中图分类号]R114
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.04.004
收稿日期:2015-09-17
基金项目:国家自然科学基金资助项目(30972510);浙江省自然科学基金资助项目(LY13H260003)。
作者简介:张亚亚(1990-),女,河北石家庄人,硕士生。
通信作者:闫洪涛,教授,Email:htyan@wmu.edu.cn。

