低氧预处理通过激活AKT通路提高老年hBM-MSCs对氧化应激损伤的耐受能力*
宋慧芳, 郭 蕊, 张 亮
(山西医科大学 1人体解剖学教研室, 2形态学实验室, 3第二医院,山西 太原 030001)
低氧预处理通过激活AKT通路提高老年hBM-MSCs对氧化应激损伤的耐受能力*
宋慧芳1△,郭蕊2,张亮3△
(山西医科大学1人体解剖学教研室,2形态学实验室,3第二医院,山西 太原 030001)
[摘要]目的: 探讨低氧预处理对老年人骨髓间充质干细胞(hBM-MSCs)的保护作用,为提高老年自体干细胞移植治疗效果提供实验支持。方法: 老年hBM-MSCs于低氧培养箱中培养24 h进行低氧预处理,实验分为年轻hBM-MSCs组(young组),老年hBM-MSCs组(old组)及低氧预处理老年hBM-MSCs组(old+hypoxia组)。300 μmol/L H2O2作用30 min建立细胞氧化应激模型,50 μmol/L LY294002作用2 h阻断PI3K/AKT信号通路,BrdU掺入实验检测细胞增殖能力; CCK-8法检测细胞活力,Western blot检测凋亡相关蛋白Bax、Bcl-2表达水平和AKT磷酸化水平。结果: BrdU掺入实验显示低氧预处理的老年hBM-MSCs细胞阳性率为39.85%±3.45%,与old组相比增殖能力显著提高(P<0.05)。300 μmol/L H2O2作用30 min诱导细胞氧化应激后,old+hypoxia组与old组比较,细胞活力显著提高(P<0.05),凋亡相关蛋白Bax表达量显著降低(P<0.05),抑制凋亡的Bcl-2蛋白表达量显著增高(P<0.05),且AKT磷酸化水平显著增高,差异有统计学显著性(P<0.05);应用LY294002抑制PI3K/AKT信号通路后,细胞活力下降(P<0.05)。结论: 低氧预处理可以通过激活AKT信号通路提高老年人骨髓间充质干细胞活力及增殖能力。
[关键词]低氧; PI3K/AKT信号通路; 骨髓间充质干细胞; 氧化应激
骨髓间充质干细胞易分离培养,体外扩增,并具有多向分化潜能,是干细胞移植治疗的理想种子细胞。自体干细胞移植能够克服移植远期免疫排斥及伦理学等问题,是针对冠状动脉粥样硬化、脑梗死等缺血性疾病较为有前景的治疗手段[1-4]。但老年患者自体干细胞增殖能力差,同时移植局部的缺血缺氧环境使得活性氧簇生成增多,引起局部氧化还原水平失调,老年干细胞对此氧化应激的微环境耐受力差,使得移植到损伤局部的细胞存活率低,增殖能力不足,影响治疗效果[5-6]。
已有研究报道低氧预处理可减轻心肌细胞、内皮细胞等体细胞的缺血损伤,同时经过低氧预处理的间充质干细胞移植后,也能够提高移植受体的干细胞对体细胞的保护作用,对干细胞本身亦具有一定的保护作用[7],但老年干细胞反应性降低,本研究拟探讨低氧预处理能否提高老年骨髓间充质干细胞自身的存活及增殖能力及其可能的机制。
材料和方法
1人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBM-MSCs)的分离及体外培养
在病人知情同意的前提下,无菌条件收集无明显血液系统及全身系统性疾病患者骨髓3~5 mL,并依据患者年龄分为年轻(20~30岁)和老年(大于60岁)2组。采用我室建立的全贴壁法[8]于10% FBS-IMDM培养基中分离培养2组人骨髓间充质干细胞。培养基中含青霉素1×105U/L, 链霉素1×105U/L及2 mmol L-谷氨酰胺。常规体外培养,传代至第3~4代用于相关实验检测。
2主要方法
2.1细胞分组实验细胞分为老年(old)组(大于60岁的老年供体来源hBM-MSCs,常氧培养)、年轻(young)组(20~30岁之间年轻供体来源hBM-MSCs,常氧培养)、氧预处理老年(old+hypoxia)组(大于60岁的老年供体来源hBM-MSCs,低氧预处理24 h)。
2.2细胞低氧预处理细胞在Thermo Scientific低氧(1% O2、5% CO2)培养箱中培养24 h进行低氧预处理,而后进行后续干预实验及相关指标检测,正常对照组使用同样培养基(10% FBS-IMDM)于常氧培养箱中培养。
2.3过氧化氢(H2O2)诱导细胞氧化应激 hBM-MSCs中加入300 μmol/L H2O2于常氧培养箱中作用30 min以诱导细胞氧化应激后,即刻进行后续相关检测。
2.4LY294002抑制PI3K/AKT信号通路细胞贴壁后,在进行低氧预处理及H2O2诱导细胞氧化应激前加入含50 μmol/L LY294002的培养基培养2 h以阻断PI3K/AKT信号通路的激活。
2.5BrdU掺入实验检测细胞增殖能力无菌24孔板接种细胞,内附无菌圆玻片,各组细胞贴壁后,加入含10 μmol/L BrdU的10% FBS-IMDM培养基常规培养72 h后4%多聚甲醛固定。 PBS洗3次后用2 N盐酸37 ℃孵育10 min使DNA变性,10%山羊血清封闭,湿盒中I抗4 ℃孵育过夜(小鼠抗BrdU,1∶100, Abtech),II 抗37 ℃避光孵育2 h(山羊抗小鼠Cy3荧光 II 抗,1∶100,康为公司),DAPI染核,水溶性抗荧光淬灭封片剂封片。显微镜拍片、计数BrdU阳性细胞数(红色)及DAPI着色的细胞总数(蓝色),计算BrdU阳性率以检测细胞增殖能力。
2.6CCK-8实验检测细胞活力无菌96孔板接种细胞,各组细胞接种密度一致,均为每孔2 000个,依照CCK-8实验试剂盒检测流程操作,酶标仪读取450 nm处吸光度(A)值反映细胞活力。
2.7Western blot实验含蛋白酶抑制剂及磷酸酶抑制剂的磷酸化蛋白提取裂解液提取蛋白,蛋白定量后行SDS电泳,湿转法转膜,5% BSA封闭,I 抗于4 ℃过夜孵育,TBST充分清洗后相应II 抗37 ℃孵育2 h,ECL显影曝光,使用Image J计算条带灰度值,以β-actin作为内参照计算相对蛋白量。
3统计学处理
使用SPSS 16.0统计分析软件,数据均用均数±标准差(mean±SD)表示,经过或未经过低氧预处理的两组老年hBM-MSCs 检测指标的均数比较采用配对样本t检验,3组比较使用单因素方差分析,随后用Bonferroni校正的t检验进行两两比较,以P<0.05为差异有统计学意义。
结果
1低氧预处理对老年人骨髓间充质干细胞增殖能力的影响
BrdU掺入实验结果显示,old组hBM-MSCs的BrdU阳性率为24.55%±6.17%, 较young组显著降低(P<0.01)。经低氧预处理的老年hBM-MSCs BrdU阳性率增高至39.85%±3.45%,与old组比较,差异有统计学显著性(P<0.05),但仍显著低于young组(P<0.01),见图1。
2低氧预处理对氧化应激条件下老年hBM-MSCs活力的影响
3组细胞经300 μmol/L H2O2作用30 min诱导氧化应激后,CCK-8法检测细胞活力,结果显示在氧化应激条件下,old组细胞活力显著降低,相当于young组的49.81%±7.80%(P<0.01),经过低氧预处理的老年hBM-MSCs虽然其活力仍然低于young组(P<0.01),但较old组显著提高,相当于young组的66.30%±6.24%(P<0.05),见图2。
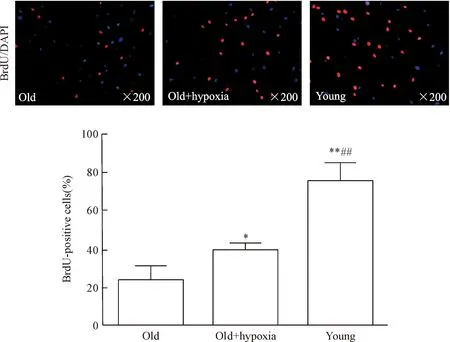
Figure 1.The effect of hypoxic preconditioning on the proliferation of old hBM-MSCs by BrdU incorporation. Mean±SD. n=5.*P<0.05,**P<0.01 vs old group;##P<0.01 vs old+hypoxia group.
图1BrdU掺入法检测低氧预处理对老年hBM-MSCs增殖能力的影响

Figure 2.The effect of hypoxic preconditioning on the cell viability of H2O2stimulated-old hBM-MSCs by CCK-8 assay. Mean±SD. n=5.*P<0.05,**P<0.01 vs old group;##P<0.01 vs old+hypoxia group.
图2CCK-8法检测低氧预处理对氧化应激条件下老年hBM-MSCs活力的影响
3低氧预处理有效降低氧化应激引起的老年hBM-MSCs凋亡
3组细胞经300 μmol/L H2O2作用30 min诱导氧化应激后,Western blot检测凋亡相关蛋白Bax和Bcl-2的表达水平。实验结果显示与old组相比,低氧预处理组细胞凋亡相关蛋白Bax表达量显著降低(P<0.05),同时抑制凋亡的Bcl-2蛋白表达量显著增高(P<0.05),见图3。
4低氧预处理可激活老年hBM-MSCs中AKT蛋白
低氧预处理的老年人骨髓间充质干细胞中磷酸化AKT(p-AKT)蛋白显著增强,与正常培养的老年人骨髓间充质干细胞相比,差异有统计学显著性(P<0.05),提示低氧预处理可以激活AKT信号通路,见图4。
5抑制AKT活化减弱低氧预处理对老年hBM-MSCs的保护作用
CCK-8法实验结果显示,低氧预处理可以提高氧化应激条件下老年hBM-MSCs的细胞活力(P<0.01),抑制剂LY294002组细胞活力低于未使用抑制剂组(P<0.05),但仍高于未经过低氧预处理的普通老年hBM-MSCs组(P<0.05),见图5。

Figure 3.The effect of hypoxic preconditioning on the apoptosis of H2O2stimulated-old hBM-MSCs.Mean±SD. n=5.*P<0.05,**P<0.01 vs old group;##P<0.01 vs old+hypoxia group.
图3低氧预处理对氧化应激条件下老年hBM-MSCs凋亡水平的影响

Figure 4.AKT protein phosphorylation in hypoxically preconditioned old hBM-MSCs. Mean±SD. n=3.*P<0.05 vs old group.
图4低氧预处理对老年hBM-MSCs中AKT蛋白磷酸化的影响
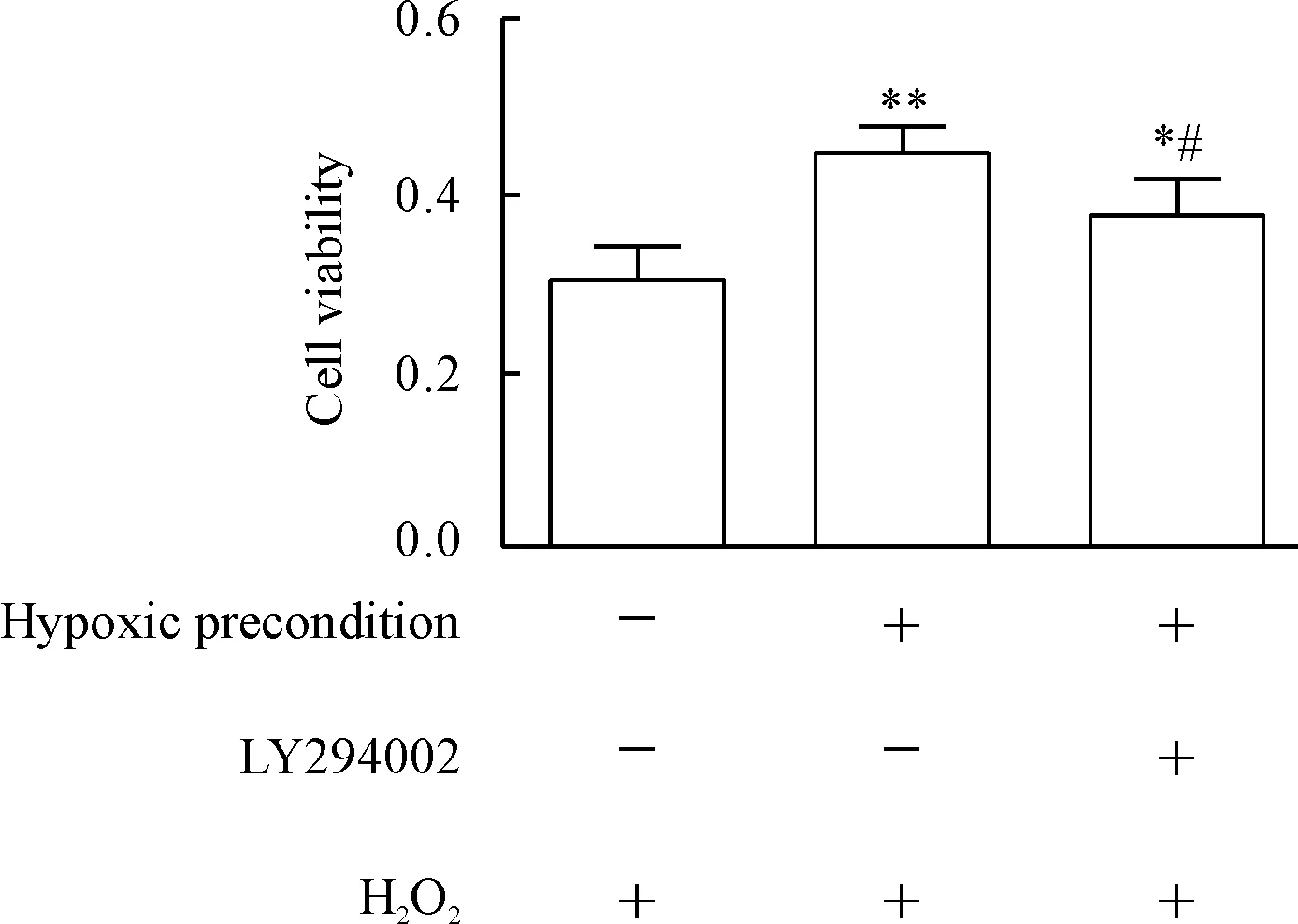
Figure 5.The cell viability of old hBM-MSCs in the presence or absence of PI3K/AKT pathway inhibitor (LY294002). Mean±SD. n=5.*P<0.05,**P<0.01 vs H2O2group;#P<0.05 vs hypoxic precondition+H2O2group.
图5PI3K/AKT通路抑制剂LY294002对氧化应激条件下老年hBM-MSCs活力的影响
讨论
冠状动脉粥样硬化、脑梗死等缺血性疾病发病率高,致死率高,是危害人类健康的主要疾病,尤其是随着年龄增长,其发病风险和死亡率随之增高,已成为老年人群的高发病和主要死亡原因[9]。自体干细胞移植治疗是新的较有前景的治疗手段,但作为缺血性疾病自体干细胞移植的主要受众——老年患者,其老年干细胞对于移植局部氧化应激的微环境耐受能力差,移植细胞凋亡率高,存活率低,活力差,成为限制其治疗效果的主要瓶颈[5-6]。因而迫切需要寻找提高干细胞尤其是老年自体干细胞移植后局部干细胞数量和活力的有效手段,为改善老年患者自体干细胞移植治疗效果提供技术支持。
已有研究显示,利用番茄红素等药物处理干细胞,c-Maf、血红素加氧酶等基因改建干细胞或是micro-RNAs等干预干细胞可以提高移植干细胞的存活率[5, 10-13],但我们提高干细胞存活率的主要目的是指向改善临床移植治疗预后,因而需要更加具有临床应用安全性的非化学试剂处理,非基因修饰等方式。低氧预处理是在细胞应用前于低氧培养环境中培养,使之对低氧高活性氧簇的生长环境预适应,从而提高细胞活力的干预方式,已有研究证实此种处理方式对肝细胞、脑细胞、心肌细胞等体细胞以及年轻干细胞具有保护作用[7],我们的研究结果证实给予老年人骨髓干细胞低氧预处理24 h同样可以显著降低凋亡水平,增加细胞活力。
PI3K/AKT信号通路是生物体内非常重要的信号通路,参与细胞增殖、分化、凋亡等生物学功能的调节,亦是应激状态下影响细胞存活的重要信号通路。 已有研究报道证实间充质干细胞衰老进程中AKT磷酸化水平显著降低,通过增强AKT信号通路的活化,可以显著抑制老年间充质干细胞凋亡,提示PI3K/AKT通路活化不足可能是干细胞衰老众多机制中的一环[14-17]。本文观察到低氧预处理老年骨髓间充质干细胞,可显著提高AKT磷酸化水平,提示AKT信号通路被激活是低氧预处理提高老年人骨髓间充质干细胞存活及增殖能力的可能机制;同时应用LY294002阻断PI3K/AKT信号通路,低氧预处理对老年骨髓间充质干细胞的保护作用明显降低,更进一步证实AKT通路参与了这一过程。但我们亦观察到阻断PI3K/AKT信号通路后,低氧预处理对老年干细胞的保护作用虽明显减弱但并未完全丧失,提示可能尚有其它信号通路及分子机制参与此过程,因此尚需要在今后课题进展中进一步探讨。
[参考文献]
[1] Chen B, Zhang F, Li QY, et al. Protective effect of Ad-VEGF-bone mesenchymal stem cells on cerebral infarction[J]. Turk Neurosurg, 2016, 26(1):8-15.
[2]Kim SW, Houge M, Brown M, et al.Cultured human bone marrow-derived CD31(+) cells are effective for cardiac and vascular repair through enhanced angiogenic, adhesion, and anti-inflammatory effects[J]. J Am Coll Cardiol, 2014, 64(16):1681-1694.
[3]宋慧芳,杨佳超,牛晓洁,等. 叔丁基对苯二酚激活骨髓间充质干细胞蛋白酶体活性延缓复制性衰老[J]. 中国病理生理杂志, 2015, 31(9):1647-1651.
[4]Russo V, Young S, Hamilton A, et al. Mesenchymal stem cell delivery strategies to promote cardiac regeneration following ischemic injury[J]. Biomaterials, 2014, 35(13):3956-3974.
[5]Kim JY, Lee JS, Han YS, et al. Pretreatment with lycopene attenuates oxidative stress-induced apoptosis in human mesenchymal stem cells[J]. Biomol Ther (Seoul),2015, 23(6):517-524.
[6]Li SH, Sun Z, Brunt KR, et al. Reconstitution of aged bone marrow with young cells repopulates cardiac-resident bone marrow-derived progenitor cells and prevents cardiac dysfunction after a myocardial infarction[J]. Eur Heart J, 2013, 34(15):1157-1167.
[7]Bader AM, Klose K, Bieback K, et al. Hypoxic preconditioning increases survival and pro-angiogenic capacity of human cord blood mesenchymal stromal cellsinvitro[J]. PLoS One, 2015, 10(9):e0138477.
[8]Zhai XY, Yan P, Zhang J, et al. Knockdown of SIRT6 enables human bone marrow mesenchymal stem cell senescence[J]. Rejuvenation Res, 2016 Mar 14. [Epub ahead of print]
[9]Moran AE, Forouzanfar MH, Roth GA, et al. The global burden of ischemic heart disease in 1990 and 2010: The Global Burden of Disease 2010 Study[J]. Circulation, 2014, 129(14):1493-1501.
[10]Chen PM, Lin CH, Li NT, et al. C-Maf regulates pluripotency genes, proliferation self-renewal, and lineage commitment in ROS-mediated senescence of human mesenchymal stem cells[J]. Oncotarget, 2015, 6(34):35404-35418.
[11]Tsubokawa T, Yagi K, Nakanishi C, et al. Impact of anti-apoptotic and anti-oxidative effects of bone marrow mesenchymal stem cells with transient overexpression of heme oxygenase-1 on myocardial ischemia[J]. Am J Physiol Heart Circ Physiol, 2010, 298(5):H1320-H1329.
[12]胡明,黎佼,刘宁宁,等. miR-486-5p 在氧化应激引起人骨髓间充质干细胞凋亡中的作用[J]. 中国病理生理杂志, 2015, 31(3):524-529.
[13]Shi XF, Wang H, Xiao FJ, et al. MiRNA-486 regulates angiogenic activity and survival of mesenchymal stem cells under hypoxia through modulating Akt signal[J]. Biochem Biophys Res Commun, 2016, 470(3):670-677.
[14]Park BK, Gonzales EL, Yang SM, et al. Effects of triclosan on neural stem cell viability and survival[J]. Biomol Ther (Seoul), 2016, 24(1):99-107.
[15]Hu Y, Zhang Y, Tian K, et al. Effects of nerve growth factor and basic fibroblast growth factor dual gene modification on rat bone marrow mesenchymal stem cell differentiation into neuron-like cellsinvitro[J]. Mol Med Rep, 2016, 13(1):49-58.
[16]Yang L, Wu Z, Yin G, et al. Stem cell factor (SCF) protects osteoblasts from oxidative stress through activating c-Kit-Akt signaling[J]. Biochem Biophys Res Commun, 2014, 455(3-4):256-261.
[17]Zhang Z, Zhao C, Liu B, et al. Inositol pyrophosphates mediate the effects of aging on bone marrow mesenchymal stem cells by inhibiting Akt signaling [J]. Stem Cell Res Ther, 2014, 5(2):33.
(责任编辑: 林白霜, 余小慧)
Hypoxic preconditioning increases tolerant ability of old human bone marrow mesenchymal stem cells to oxidative stress injury through AKT pathway
SONG Hui-fang1, GUO Rui2, ZHANG Liang3
(1Department of Anatomy,2Morphology Laborator,3The Second Hospital, Shanxi Medical University, Taiyuan 030001, China. E-mail: songhuifang0111@yeah.net; ZL81vip@126.com)
[ABSTRACT]AIM: To investigate the protective effect of hypoxic preconditioning on human bone marrow mesenchymal stem cells (hBM-MSCs), and to provide basic experimental support for more effective autologous stem cell transplantation in aged patients. METHODS: The old hBM-MSCs were subjected to hypoxic preconditioning using a hypoxia incubator chamber for 24 h. The cells were divided into young group, old group and old+hypoxia group (with 24 h hypoxic preconditioning). Hydrogen peroxide (H2O2, 300 μmol/L) was applied to simulate the oxidative stress. The cells were treated with 50 μmol/L LY294002 for 2 h to inhibit PI3K/AKT pathway. BrdU incorporation and CCK-8 assay were used for analyzing the cell proliferation and viability. The protein levels of Bax, Bcl-2 and p-AKT were measured by Western blot. RESULTS: BrdU-positive cells, which represented the cell proliferation, and the cell viability were significantly increased in old+hypoxia group compared with old group (P<0.05). The protein level of Bax decreased (P<0.05) and Bcl-2 increased (P<0.05) in old+hypoxia group compared with old group after using 300 μmol/L H2O2 simulate. the oxidative stress. The phosphorylation of AKT was enhanced by hypoxic preconditioning in old group (P<0.05). The protective effect of hypoxic preconditioning on the cell survival was decreased after treated with LY294002 (inhibitor of the PI3K/AKT pathway) (P<0.05). CONCLUSION: Hypoxic preconditioning increases the survival and proliferation of old hBM-MSCs by activation of AKT pathway.
[KEY WORDS]Hypoxia; PI3K/AKT signal pathway; Bone marrow mesenchymal stem cells; Oxidative stress
[文章编号]1000- 4718(2016)05- 0912- 05
[收稿日期]2016- 02- 18[修回日期] 2016- 04- 07
*[基金项目]山西医科大学青年基金资助项目(No. 02201002);山西医科大学基础医学院331基金资助项目(No. 201217)
通讯作者△宋慧芳 Tel: 0351-4135787; E-mail: songhuifang0111@yeah.net; 张亮 Tel: 0351-3365402; E-mail: ZL81vip@126.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.024
杂志网址: http://www.cjpp.net

