RNA干扰endophilin A2抑制大鼠海马神经元突触囊泡内吞*
张吉凤, 尹义臣, 杨万勇, 谭明会, 郭国庆
(暨南大学医学院 1解剖学教研室, 2中西医结合博士后流动站,广东 广州 510632; 3广州市红十字会医院,暨南大学附属第四医院神经内科,广东 广州 510220; 4暨南大学附属第一医院神经内科,广东 广州 510632)
RNA干扰endophilin A2抑制大鼠海马神经元突触囊泡内吞*
张吉凤1,2,尹义臣3,杨万勇4,谭明会1,2,郭国庆1△
(暨南大学医学院1解剖学教研室,2中西医结合博士后流动站,广东 广州 510632;3广州市红十字会医院,暨南大学附属第四医院神经内科,广东 广州 510220;4暨南大学附属第一医院神经内科,广东 广州 510632)
[摘要]目的: 探讨内吞蛋白(endophilin)A2对大鼠海马神经元突触囊泡内吞的影响。方法: 设计干扰endophilin A2的小分子干扰片段,通过Western blot的方法筛选出针对endophilin A2有效的特异性干扰片段;用免疫荧光的方法验证干扰片段对神经元内源性endophilin A2的干扰效果;利用双全细胞膜片钳的方法,记录不同刺激方案下的兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)的情况,以明确endophilin A2对突触囊泡循环的影响。结果: (1)免疫荧光结果显示endophilin A2的干扰片段能显著减少海马神经元内源性endophilin A2的表达(P<0.05);(2)双全细胞膜片钳结果显示,0.1 Hz的低频刺激下,干扰endophilin A2表达的神经元EPSCs大小与阴性对照组没有明显差异;而无论是单串高频刺激下还是多串高频刺激下,干扰endophilin A2表达的神经元标准化EPSCs的下降程度都明显增强(P<0.05)。结论: (1)成功筛选出特异性干扰endophilin A2的有效干扰片段;(2)干扰endophilin A2的表达不影响海马神经元突触囊泡胞吐;(3)干扰endophilin A2的表达可抑制大鼠海马神经元突触囊泡内吞。
[关键词]内吞蛋白 A2; 突触囊泡; 内吞; RNA干扰
网格蛋白(clathrin)介导的细胞内吞作用是真核细胞内在化营养、抗原、生长因子、受体和囊泡的重要机制之一[1],尤其在神经元突触前膜突触囊泡的内吞以及突触后膜受体的内吞中都发挥着重要的作用[2]。内吞蛋白(endophilin) A是网格蛋白依赖型内吞中的重要成员,其3个亚型endophilin A1、endophilin A2和endophilin A3都存在于脑组织中,且在突触前后膜均丰富表达[3-4]。结构上endophilin A蛋白家族成员之间具有很高的同源性,拥有共同的结构特点,均包含N端的BAR结构域、中间的可变区及C端的SH3结构域,这些结构域是endophilin A蛋白参与蛋白质相互作用,执行生理功能的基础[5]。目前endophilin A1被证实在突触囊泡内吞和膜表面受体内吞中发挥着正性调节的作用[6-7],而结构相似的endophilin A3则被证实在受体内吞中发挥着负性调节的作用[8]。我们关于endophilin A另外一个亚型endophilin A2的研究发现,其能与N型钙离子通道钙离子依赖性结合来调节突触囊泡的内吞[9]。为了进一步明确endophilin A2在内吞中的作用,本实验利用小分子RNA干扰原代培养大鼠海马神经元内源性endophilin A2的表达,利用双全细胞膜片钳检测突触传递的变化,来进一步探讨endophilin A2在突触囊泡内吞中的作用。
材料和方法
1动物
SPF级新生1 d内的SD大鼠,购于中山大学实验动物中心,合格证编号为 SCXK (粤) 2011-0029:44008500008204、44008500008259、44008500008420、44008500008743、44008500008826、44008500008897、44008500009088和44008500009242。
2主要试剂
细胞培养用相关试剂:DMEM培养基、DMEM/F12培养基、谷氨酰胺、Neurobasal-A培养基和B27添加剂均为Gibco产品;胎牛血清购自HyClone;胰蛋白酶购自USB;多聚赖氨酸购自BD Biosciences公司。
抗体:抗endophilin A2多克隆抗体购自Santa Cruz;免疫印迹用Ⅱ抗购自ZYMED;免疫荧光用Ⅱ抗DyLight 549为Jackson产品。
免疫印迹及免疫荧光试剂:化学发光底物试剂及PVDF膜购自Pierce;封片剂购自EMS;预染蛋白Marker 购自NEB;封闭用驴血清购自Jackson;多聚甲醛购自Sigma。
电生理用试剂:NaCl、葡萄糖、KCl、CaCl2、MgCl2、HEPES、MgATP、Na2-phosphocreatine、Na2GTP、EGTA和EDTA均购自Sigma。
3主要方法
3.1siRNA序列设计利用在线软件(www.promega.com/siRNADesigner/)针对endophilin A2亚型共设计了2条干扰片段,每个片段含19个核苷酸,分别为 si2-1(5’-GAGGTTCTATTACCTTTCT-3’)和 si2-2(5’-GCTTCGTCATCATTTAGAT-3’)二者均通过BLAST 验证其特异性。2条干扰片段及阴性对照(negative control,NC)均由上海吉玛制药技术有限公司合成。
3.2HEK293细胞的培养、转染及Western blot 检测传代后的HEK293细胞用含10%胎牛血清的DMEM培养基接种,置37 ℃、5%CO2培养箱内培养。待细胞达到70%~80%融合度时,将100 pmol siRNA 或 NC 与2 μg 的endophilin A2-pEGFPC1表达载体共转染HEK293细胞。细胞转染采用磷酸钙的方法,首先转染前2 h换成无血清培养基饥饿细胞,然后制备磷酸钙-DNA沉淀,方法是将等量的质粒氯化钙混合液逐滴加入到用移液管一直吹打着的等量的2×HEPSE缓冲液中,室温避光静置15 min,以形成细小的磷酸钙-DNA沉淀,将沉淀溶液逐滴均匀加入无血清的培养基中,轻轻晃动,使DNA沉淀均匀分布在细胞培养皿中。37°C培养箱孵育4 h后,洗去沉淀,换含5%胎牛血清的DMEM培养基继续培养,24~48 h后,用Suspension Buffer收集细胞。取出100 μL细胞裂解液用BCA法进行定量。 利用Western blot对蛋白表达进行检测,endophilin A2 Ⅰ抗1∶1 000稀释,Ⅱ抗1∶10 000稀释。
3.3原代海马神经元的培养和转染新生1 d内的SPF级SD大鼠,去除颅骨和大脑皮质,取海马并用解剖液清洗剪成小块,入15 mL离心管中,加0.125%的胰酶37℃、5% CO2中消化10 min。终止消化,用抛光的玻璃吸管吹打10次,800 r/min离心5 min,弃上清,用含10%胎牛血清DMEM/F12培养液重悬细胞,400目筛网过滤,调整细胞密度并接种到PDL包被过的载玻片上,24 h后全量换2% B27的Neurobasal-A无血清培养液,以后每隔3 d半量换液。待神经元生长到8~9 d, 用磷酸钙方法进行转染,每孔加入1 μg GFP及30 pmol siRNAs或者NC,待48~72 h后用于后续实验。所有实验过程符合暨南大学医学院实验动物伦理规定的要求。
3.4endophilin A2的免疫荧光染色神经元转染48~72 h后用4%PFA固定,洗后用含3%驴血清的TBS封闭1 h,用endophilin A2 Ⅰ抗按1∶100稀释后过夜孵育,donkey anti-goat IgG (H+L) Dylight 549Ⅱ抗按1∶500稀释孵育神经元1 h,最后用Fluoro Gel II with DAPI封片。用LSM710 63×油镜进行拍照,GFP和endophilin A2荧光的采集通道分别为488 nm和543 nm,分辨率为1 024×1 024。
3.5电生理记录所用电极为10 cm长,外径为1.5 mm,内径为0.86 mm的玻璃毛细管,在P-97水平拉制仪上用四步法拉制记录用的微电极。尖端直径一般为2.5~3.0 μm,入液阻抗3~5 MΩ。取转染48~72 h后的神经元进行实验。把培养液换成标准细胞外液后,置于OLYMPUS IX71倒置相差显微镜载物台上。在400倍视野下找到胞体饱满均匀,边界清楚,突起较长,距离合适的2个神经元。所用放大器为HEKA EPC 10.0,软件为PatchMaster。所得数据用FitMaster进行整理和分析。
4统计学处理
所有数据用均数±标准误(mean±SEM)表示,用SPSS 13.0 软件进行t检验,以P<0.05为差异有统计学意义。
结果
1Endo2 siRNA可有效抑制内源性endophilin A2的表达
我们针对endophilin A2设计了2条小分子干扰片段,为了筛选出有效干扰片段,我们将endophilin A2过表达载体与其对应的干扰片段共转染HEK293细胞, 用Western blot的方法来检测它们的干扰效果。Endophilin A2的2条干扰片段中,si2-1并没有有效抑制endophilin A2的表达,而si2-2明显抑制了endophilin A2的表达,于是我们选择si2-2命名为Endo2 siRNA用于后续实验。
为明确干扰片段是否有效干扰了培养神经元内endophilin A2的表达,我们将Endo2 siRNA与GFP共同转染培养成熟的海马神经元,共转GFP的目的是用于标记转染了干扰片段的海马神经元,这种共转方法已经得到了广泛认同,共转效率在90%以上[10]。我们将转染48~72 h后的神经元固定后,用endophilin A2特异性的抗体对其进行免疫荧光染色。Endophilin A2在转染了阴性对照的海马神经元及未转染神经元均有表达,红色荧光均匀分布在各神经元的胞体及突起部位,而转染了Endo2 siRNA干扰片段的海马神经元,endophilin A2的染色并不明显,看不见或者仅见较弱的红色荧光分布在胞体部位,这些结果表明内源性endophilin A2的表达受到特异性siRNA的干扰。为进一步明确Endo2 siRNA对内源性endophilin A2的干扰效果,我们将转染了阴性对照和干扰片段的细胞的平均荧光强度与其周围未转染神经元平均荧光强度进行了对比分析,转染Endo2 siRNA的相对荧光强度明显低于阴性对照组Endo2(P<0.05)。以上结果表明,endophilin A2干扰片段有效降低了培养海马神经元内源性endophilin A2的表达,见图1。
2干扰endophilin A2的表达不影响海马神经元的胞吐过程
神经递质的释放与突触囊泡的活动密切相关,所以通过记录不同刺激模式下兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)的大小,可以分析突触囊泡胞吐和内吞的情况。为检测突触囊泡活动的情况,我们首先建立了双全细胞膜片钳的方法。图2A显示的是荧光相差显微镜下存在突触联系的2个神经元,其上为与2个神经元胞体形成紧密封接的玻璃电极,带有绿色荧光的神经元是转染了干扰片段或者阴性对照的细胞,作为突触前细胞,未转染的神经元作为突触后,当给予突触前神经元200~300 pA、 2 ms的刺激时,能够引起突触前神经元爆发一个动作电位,从而能够在突触后神经元记录到EPSCs。囊泡内吞紧随胞吐之后发生,我们首先要明确endophilin A2的干扰是否影响了胞吐过程,当给予突触前细胞0.1 Hz的低频刺激时,我们发现转染NC组的神经元所激发的EPSCs幅度为(433.289±128.131) pA,而转染Endo2 siRNA干扰片段的神经元所激发的EPSCs幅度为(416.886±113.522) pA,二者所激发的EPSCs强度没有差异,这些结果表明干扰endophilin A2的表达并没有影响到胞吐的过程,见图2。
3干扰endophilin A2的表达抑制了海马神经元突触囊泡的内吞
高频刺激可以使待释放囊泡池(readily relea-sable pool,RRP)的突触囊泡由于耗竭而产生短时程突触抑制(short-term synaptic depression,STD),突触抑制的程度与突触囊泡回收的速率相关,通过比较突触抑制的程度可以了解内吞是否受到影响。为检测endophilin A2干扰后是否影响了突触囊泡的内吞,我们给予了突触前神经元5 Hz、20 s即100个高频刺激,并记录下这100个刺激产生的EPSCs的大小,我们将记录到的100个EPSCs对第1个EPSCs进行标准化处理,可见转染Endo2 siRNA的神经元短时程突触抑制的程度明显大于阴性对照组。同时我们对每组第81~100个的EPSCs进行平均化,结果显示Endo2 siRNA组的平均的EPSCs的大小为 0.271±0.026,明显低于NC组平均的EPSCs大小(0.577±0.032)(P<0.05)。以上结果表明,干扰endophilin A2的表达明显影响突触囊泡的内吞进程,见图3。
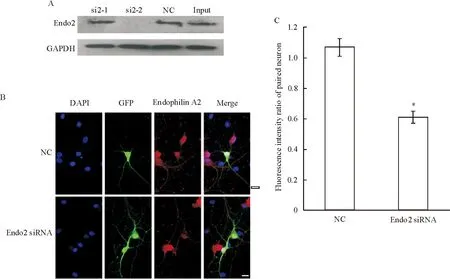
Figure 1.Screening and verification of the efficacy of endophilin A2 siRNAs.A: HEK293 cells were co-transfected with endophilin A2-pEGFPC1 plasmids and endophilin A2 siRNAs or NC, and 48 h later, endophilin A2 and GAPDH as a control in the cell lysates were probed by the designated antibodies; B:images of neurons co-transfected with GFP (green) and NC or Endo2 siRNA (scale bar=20 μm); C: fluorescence intensity of endophilin A2 in the cytoplasm transfected with Endo2 siRNA or NC was normalized to that of a paired untransfected neuron.Mean±SEM.n=10.*P<0.05vsNC.
图1Endophilin A2 siRNAs有效片段的筛选及干扰效果验证
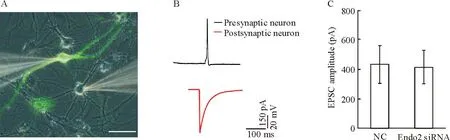
Figure 2.The impact of endophilin A2 isoform knockdown on neurotransmitter release. A: image of a pair of neurons obtained from dual patch recording transfected with siRNA or NC (green) and non-transfected neuron (gray). Scale bar=50 μm. B: representative traces from pairs of neurons. Presynaptic neuron exhibited an action potential (AP) at 2 ms, 200~300 pA current injection (black line); excitatory postsynaptic current (EPSC) was evoked in postsynaptic neuron by single AP of presynaptic neuron (red line). C: EPSC amplitude evoked in postsynaptic neuron by single AP of presynaptic neuron transfected with NC and Endo2 siRNA. Mean±SEM.n=9~12.
图2干扰endophilin A2的表达对神经元递质释放的影响
如果突触囊泡的内吞受损,那么待释放囊泡池的再填充也将受到影响。为进一步明确endophilin A2在突触囊泡内吞中的作用,我们采取了多串高频刺激方案。 首先记录在0.1 Hz刺激3 min时间内,突触后神经元产生的平均EPSCs的大小,紧接着给予5 Hz、20 s即100个高频刺激,然后再记录0.1 Hz刺激3 min时间内,突触后神经元产生的平均EPSCs,如此反复,记录到4个高频串刺激后的平均EPSCs,4个高频串刺激后的平均EPSCs分别都对第1个高频串刺激前的平均EPSCs进行均一化,通过比较各组高频刺激后EPSCs的大小来判断突触囊泡的再填充情况。 多串高频刺激方案的结果显示,在每个高频刺激后记录到的EPSCs都呈现出稳定的下降趋势, Endo2 siRNA组从第1个串刺激到第4个串刺激的EPSCs都比NC组降低得更为明显(P<0.05)。串刺激后明显降低的EPSCs表明, Endo2 siRNA组神经元囊泡待释放池的囊泡再填充过程受到了阻抑,见图4。以上这些结果表明干扰endophilin A2能明显抑制大鼠海马神经元突触囊泡的内吞过程。
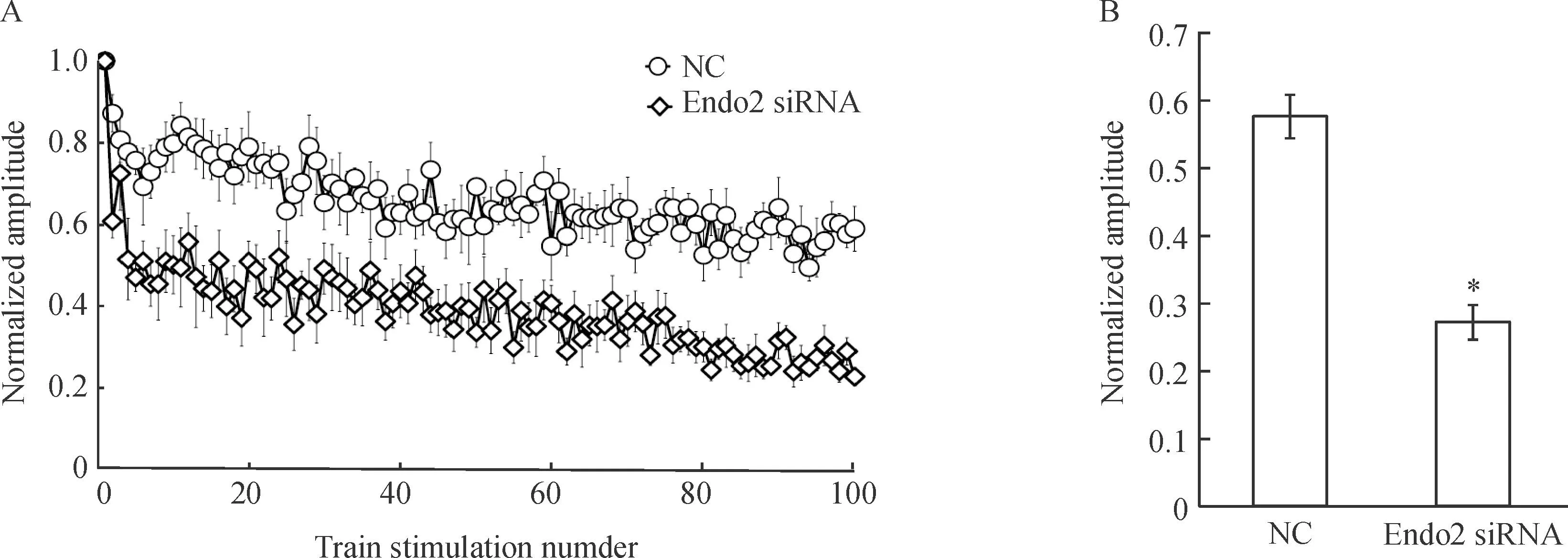
Figure 3.The impact of endophilin A2 isoform knockdown on short-term synaptic depression (STD). A:the changes of STD in postsynaptic neurons evoked by 100 pulses at 5 Hz from presynaptic neurons transfected with NC and Endo2 siRNA; B: the average normalized amplitude of the last 20 points from Endo2 siRNA compared with NC.Mean±SEM.n=7.*P<0.05vsNC.
图3干扰endophilin A2对短时程突触抑制的影响

Figure 4.The impact of endophilin A2 isoform knockdown on the replenishment of the readily releasable pool(RRP). Normalized amplitude of EPSCs evoked by multiple train stimulations in neurons transfected with NC or Endo2 siRNA. Mean±SEM.n=11~13.*P<0.05vsNC.
图4干扰endophilin A2对待释放囊泡池再填充影响
讨论
Endophilin A蛋白家族在哺乳类动物细胞中存在3种亚型endophilin A1、A2和A3,三者在中枢神经系统都丰富表达,在亚细胞水平,它们在突触前后膜均有分布[3-4]。Milosevic等[11]为研究endophilin A在哺乳类动物突触囊泡内吞中的功能,将小鼠endophilin A 3个亚型的基因全部敲除掉,在基因敲除老鼠体外培养的神经元上进行电生理实验,结果发现基因敲除小鼠体外培养神经元突触传递的效能明显减弱,在给予突触前神经元1 Hz 30个刺激的情况下,基因敲除组相比对照组就表现出明显的突触抑制。我们为了明确endophilin A2亚型是否在突触前突触囊泡内吞中发挥作用,采用了小分子干扰手段在培养的海马神经元内特异性干扰endophilin A2的表达,同时转染和双全细胞膜片钳的有效结合,使我们能够保证干扰掉endophilin A2亚型的细胞作为突触前,而其周围未转染且与转染细胞有突触联系的神经元作为突触后。当给予突触前神经元5 Hz 100个电刺激时,突触后记录到的100个EPSCs随着刺激个数的增加而逐渐下降,表现出明显的突触抑制,而干扰了endophilin A2亚型表达的神经元其突触抑制的程度比对照组明显增强,表明干扰endophilin A2的表达抑制了突触前突触囊泡的内吞。Milosevic等[11]由于将突触前后膜的所有endophilin A亚型都敲除掉了,所以在他们的研究中应用更低频率更少的刺激个数,实验组与对照组就表现出了明显的差异,而在我们的研究中仅仅是干扰了突触前endophilin A2的表达。
研究显示, endophilin A蛋白的3个亚型具有很高的同源性,均含有N段的BAR结构域、中间的可变区和C端的SH3结构域,这2个结构域被认为是endophilin A调控内吞的分子基础[5]。例如BAR结构域能够引起和稳定膜的弯曲,而SH3结构域能够与dynamin等其它内吞蛋白相互作用,在囊泡剪切和脱包被中发挥作用[5, 12]。然而目前的一些报道显示这3个亚型的功能并不一致,科学家通过向七鳃鳗的巨型轴突显微注射endophilin A1抗体,发现突触囊泡膜内陷反应停滞[7]。过表达endophilin A1增加了受体介导的多巴胺D2受体的内吞,相比而言,过表达endophilin A3则阻止了多巴胺D2受体的内吞[8]。在293T细胞中过表达endophilin A2促进了表皮生长因子受体(epidermal growth factor receptor,EGFR)的内吞[13]。我们的结果显示在神经元内干扰endophilin A2的表达,抑制了突触囊泡的内吞。从这些研究可以看到endophilin A1和endophilin A2在内吞中发挥了正性调控的作用,而endophilin A3发挥的是负性调控的作用。有分析显示它们的不同功能可能源于其可变区的结构不同,endophilin A1和endophilin A2的可变区含有短α螺旋,然而endophilin A3的可变区则为β折叠[8]。如此,我们是否可以认为虽然endophilin A的BAR结构域和SH3结构域是内吞中发挥重要作用的分子基础,然而位于二者之间的可变区对于调控endophilin A是否发挥功能以及发挥怎样的功能上具有更关键的作用呢?由于这些研究都是在不同细胞的实验中得出的结论,具体这3个亚型是不是存在这样的差异,还有待我们在同一细胞体系中用同样的实验方法对三者的功能加以证实。
总而言之,我们的研究证实了在培养的大鼠海马神经元上干扰endophilin A2的表达能够抑制突触前膜突触囊泡的内吞。
[参考文献]
[1]Doherty GJ, Mcmahon HT. Mechanisms of endocytosis[J]. Annu Rev Biochem,2009,78:857-902.
[2]Jung N, Haucke V. Clathrin-mediated endocytosis at sy-napses[J]. Traffic,2007,8(9):1129-1136.
[3]Giachino C, Lantelme E, Lanzetti L, et al. A novel SH3-containing human gene family preferentially expressed in the central nervous system[J]. Genomics,1997,41(3):427-434.
[4]Chowdhury S, Shepherd JD, Okuno H, et al. Arc/Arg3.1 interacts with the endocytic machinery to regulate AMPA receptor trafficking[J]. Neuron,2006,52(3):445-459.
[5]Kjaerulff O, Brodin L, Jung A. The structure and function of endophilin proteins[J]. Cell Biochem Biophys,2011,60(3):137-154.
[6]Majumdar S, Gong EM, Di Vizio D, et al. Loss of Sh3gl2/endophilin A1 is a common event in urothelial carcinoma that promotes malignant behavior[J]. Neoplasia,2013,15(7):749-760.
[7]Ringstad N, Gad H, Low P, et al. Endophilin/SH3p4 is required for the transition from early to late stages in clathrin-mediated synaptic vesicle endocytosis[J]. Neuron,1999,24(1):143-154.
[8]Sugiura H, Iwata K, Matsuoka M, et al. Inhibitory role of endophilin 3 in receptor-mediated endocytosis[J]. J Biol Chem,2004,279(22):23343-23348.
[9]Zhang J, Fan J, Tian Q, et al. Characterization of two distinct modes of endophilin in clathrin-mediated endocytosis[J]. Cell Signal,2012,24(11):2043-2050.
[10]Song B, Lai B, Zheng Z, et al. Inhibitory phosphorylation of GSK-3 by CaMKII couples depolarization to neuronal survival[J]. J Biol Chem,2010,285(52):41122-41134.
[11]Milosevic I, Giovedi S, Lou X, et al. Recruitment of endophilin to clathrin-coated pit necks is required for efficient vesicle uncoating after fission[J]. Neuron,2011,72(4):587-601.
[12]Gortat A, San-Roman MJ, Vannier C, et al. Single point mutation in Bin/Amphiphysin/Rvs (BAR) sequence of endophilin impairs dimerization, membrane shaping, and Src homology 3 domain-mediated partnership[J]. J Biol Chem,2012,287(6):4232-4247.
[13]Lua BL, Low BC. Activation of EGF receptor endocytosis and ERK1/2 signaling by BPGAP1 requires direct interaction with EEN/endophilin II and a functional RhoGAP domain[J]. J Cell Sci,2005,118(Pt 12):2707-2721.
(责任编辑: 林白霜, 罗森)
RNA interference of endophilin A2 inhibits synaptic vesicle endocytosis in rat hippocampal neurons
ZHANG Ji-feng1, 2, YIN Yi-chen3, YANG Wan-yong4, TAN Ming-hui1,2, GUO Guo-qing1
(1Department of Anatomy,2Postdoctoral Station of Integrated Traditional and Western Medicine, School of Medicine, Jinan University, Guangzhou 510632, China;3Department of Neurology, Guangzhou Red Cross Hospital, The Fourth Affiliated Hospital of Jinan University, Guangzhou 510220, China;4Department of Neurology, The First Affiliated Hospital of Jinan University, Guangzhou 510632, China. E-mail: tgqguo@jnu.edu.cn)
[ABSTRACT]AIM: To investigate the effect of endophilin A2 on synaptic vesicle endocytosis in rat hippocampal neurons.METHODS: The siRNAs for endophilin A2 isoform were designed, and the efficacy and specificity of these siRNAs were determined by Western blot. Immunostaining was performed to verify the interference efficiency of the siRNA for endogenous endophilin A2 in the hippocampal neurons. Excitatory postsynaptic currents (EPSCs) were recorded on cultured hippocampal neurons using dual whole-cell recordings by evoking the transfected presynaptic neurons in various stimulation patterns. RESULTS: The result of immunostaining in cultured hippocampal neurons demonstrated that the siRNA of endophilin A2 inhibited the expression of endogenous endophilin A2 significantly (P<0.05). The results of dual whole-cell recordings showed that no significant difference in the EPSCs amplitude evoked between endophilin A2 knockdown neurons and control was observed when stimulated at low frequency (0.1 Hz). The amplitude of normalized EPSCs evoked in endophilin A2 knockdown neurons decreased significantly for both single-train and multiple-train stimulations (P<0.05).CONCLUSION: An effective siRNA of endophilin A2 was screened out successfully. Knockdown of endophilin A2 isoform does not affect synaptic vesicle exocytosis, but inhibits synaptic vesicle endocytosis in rat hippocampal neurons.
[KEY WORDS]Endophilin A2; Synaptic vesicle; Endocytosis; RNA interference
[文章编号]1000- 4718(2016)05- 0819- 06
[收稿日期]2015- 08- 27[修回日期] 2016- 03- 07
*[基金项目]国家自然科学基金资助项目(No.31300885; No.81571191);广东省自然科学基金资助项目(No.S2013040013256);广东省科技计划(No.2013B021800036);中国博士后科学基金资助项目(No.2015M570750);2015年暨南大学第一临床医学院科研培育专项基金资助项目(No.2015109)
通讯作者△Tel: 020-85220251; E-mail: tgqguo@jnu.edu.cn
[中图分类号]R338.1+3; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.008
杂志网址: http://www.cjpp.net

