rd1小鼠视网膜退变中期节细胞功能的变化*
刘 峰, 张 佳, 许 迪, 项宗勤, 徐 颖
(暨南大学粤港澳中枢神经再生研究院,广东 广州 510632)
rd1小鼠视网膜退变中期节细胞功能的变化*
刘峰,张佳,许迪,项宗勤,徐颖△
(暨南大学粤港澳中枢神经再生研究院,广东 广州 510632)
[摘要]目的: 探讨视网膜色素变性模型rd1小鼠视网膜退变中期各类视网膜节细胞(retinal ganglion cells, RGCs)功能的变化情况。方法: 运用多电极阵列(multi-electrode arrays,MEA)记录方法,记录视网膜退变中期(出生后20 d,P20)的rd1小鼠或正常对照小鼠视网膜中多个节细胞动作电位的发放,并比较自发发放和光反应特征等指标,评价幸存的节细胞功能变化。另外,采用免疫组化染色方法验证视网膜感光细胞的退化情况。结果: 免疫组化的结果表明rd1小鼠视网膜感光层的厚度显著低于正常小鼠。根据节细胞光反应特性的不同,可以将其分成6类:ON sustained、ON transient、ON-OFF sustained、ON-OFF transient、OFF sustained和OFF transient RGCs,但OFF sustained RGCs所占比重极小(1.0%~3.1%)。rd1小鼠视网膜中保持光反应的节细胞比例显著低于正常小鼠。rd1小鼠节细胞的自发发放显著高于正常小鼠,而不同类型的节细胞变化情况有所不同。rd1小鼠视网膜各类节细胞的光反应强度及光敏感度均显著低于正常小鼠。结论: 在rd1小鼠退变的中期,视网膜感光层明显退变;rd1小鼠退变中期的视网膜节细胞发生明显的功能退变,而且不同类型的节细胞变化情况有所不同。
[关键词]多电极阵列; 视网膜色素变性; 视网膜节细胞; rd1小鼠
视网膜色素变性(retinitis pigmentosa, RP)是一种最常见的遗传性致盲眼病,主要是由编码视杆细胞的磷酸二酯酶(phosphodiesterase,PDE)β亚基突变引起,导致患者的感光细胞死亡和视野的收缩,最终失明。同样的突变也存在于rd1小鼠中:在rd1小鼠中,视网膜视杆细胞磷酸二酯酶Pde6bβ亚基的7号外显子突变[1],导致细胞内环鸟苷酸(cyclic guanosine monophosphate,cGMP)累积,从而在出生后几周内引起大量视杆细胞的死亡。因此rd1小鼠是一种理想的RP动物模型。研究表明视杆细胞在rd1小鼠出生后第8天左右开始快速凋亡,紧接着是视锥细胞,到6周的时候感光细胞几乎完全消失[2-3]。视网膜感光细胞的死亡导致视网膜外层结构完全消失,但内层神经元(双极细胞、水平细胞、无长突细胞、节细胞)基本保留完好;许多视网膜节细胞(retinal ganglion cells, RGCs)和与其相连的中央视觉神经系统仍然保持部分功能[4],然而感光细胞的死亡导致视网膜内层神经元的二次重构,即神经元突起的损失或萌芽、细胞的迁移和反应性胶质增生[5-8],从而直接影响内层神经元的功能变化。
在视网膜退变的早期,患者很难意识或者检查到自己患有视网膜色素变性等相关疾病,故视杆细胞大量死亡,而视锥细胞大部分尚存的退变中期将是一个非常重要的治疗时期。目前仅有少量文献简单报道在rd1小鼠的感光细胞退变的早期,整体节细胞自发的增加和ON、ON-OFF和OFF 3大类节细胞光反应的减少[9];但在rd1小鼠退变的中期,视网膜6类节细胞的神经电生理的特性尚不清楚。因此,本研究将主要运用多电极记录系统,记录rd1小鼠退变的中期视网膜各类节细胞的功能的变化,为临床研究提供更为具体、更为可靠的依据,为探索新的有效治疗方案提供一定的理论基础。
材料和方法
1动物
SPF级C57BL/6野生型(wild type, WT)小鼠,雌雄不限,出生20天(postnatal 20 days,P20),由广东省实验动物中心提供,许可证号为SCXK(粤)2013-0002。SPF级C3H/HeJ(rd1)小鼠,雌雄不限,P20,由南京大学-南京生物医药研究院引进,许可证号为SCXK(苏)2015-0001。本研究中使用的所有小鼠均在正常的光照环境中饲养,即12 h/12 h明暗交替,保证小鼠正常的生理周期。
2主要试剂
艾姆斯试剂(Ames’ Medium)和NaHCO3购自Sigma;DAPI购自Electron Microscopy Sciences;包埋剂(optimal cutting temperature compound,OCT)购自广州瑞千生物科技有限公司;混合氧气(95% O2+5%CO2)购自广州市英莱气体有限公司。
3主要方法
3.1视网膜的剥离在微弱的红光中,暗适应后的小鼠采用快速颈椎脱臼方法处死并取出眼球,立即转移至通氧的AMES溶液中。剥离出视网膜后,从中心处分为4部分,进一步将其修整为边长为2 mm的正方形,使其与视神经乳头的距离约0.3 mm,从而保证每次记录的位置是相近的。
3.2多电极陈列(multi-electrodes arrays,MEA)记录本实验中所用的多电极阵列(MED64)系统的记录电极为内嵌64个电极通道,每个电极直径为10 μm,间距为100 μm,并排列成8×8的平面矩阵。将修整好的视网膜用吸管转移至灌有AMES溶液的电极槽内,使节细胞层朝下紧贴电极阵列;轻轻盖上锚并平稳转移至MEA connector,通AMES灌流液。在记录的过程中,视网膜需一直浸在AMES溶液中且其周围温度为31~33 ℃,保持流速为4.5 mL/min。每片视网膜开始记录前均需孵育至少30 min,绝大部分实验在3~6 h内均能记录到稳定的动作电位(又称spike)发放。
3.3视觉刺激通过MED64主放大器输出电压的大小和中性滤光片控制投射到视网膜上的光强的大小,从而得到实验所需的光刺激强度:1.50×104~3.61×107photons·μm-2·s-1;本实验中采用的视觉刺激均为全视野闪光刺激,刺激模式为2 s(撤光)+2 s(给光)+6 s(撤光),每个刺激循环时间为10 s,共30次。
3.4数据分析采用阈值检测法从原始数据中检测出动作电位,选取基线噪音水平4.5倍的标准差(4.5σ)作为阈值。当记录信号峰值超过阈值时,判断为有动作电位产生。通常单个电极会记录到多个RGCs动作电位的发放,因此需要使用Offline Sorter 软件(Plexon Inc)将单个电极所记录到的多个RGCs发放的信号进行分开,即为spike sorting。因为神经元有1 ms的不应期间隔, 对于分开的单个RGCs,去掉峰电位间隔<1 ms的spikes。另外还需手动移除那些不规则的spikes,比如2个或者更多spikes在极短时间内的累加或者部分重叠。
3.5视网膜节细胞分类将分开后单个RGCs所发放的spikes,通过Spike2编程以10 ms的时间窗(bin)做刺激前后反应直方图(peristimulus time histograms,PSTH),然后统计各个时段spikes发放的数目。
3.5.1优势响应指标(response dominance index,RDI)根据节细胞对给光(ON)、撤光(OFF)的反应,可以将节细胞分为ON(仅给光时兴奋)、OFF(仅撤光时兴奋)及ON/OFF(对给光和撤光均反应)。我们根据以下公式定量判断节细胞的ON-OFF 反应类型[10]:
其中,RON、ROFF分别代表给光和撤光2 s内spike平均发放频率,减去给光前节细胞的自发频率。通过RDI值将记录到的RGCs分成3类:若RDI≥0.6,则此类为ON RGCs;若RDI≤-0.6,则此类为OFF RGCs; RDI介于两者之间,则为ON-OFF RGCs。
3.5.2响应时程指标(response time index,RTI)根据节细胞对光反应的持续时间,可以将节细胞分为2大类,短暂型(transient) 及持久型(sustained)。根据以下公式定量判断节细胞的反应类型[10]:
其中, Rpeak代表在给光(或撤光)500 ms内spike的最大发放频率,Rmaintained是给光(或撤光)1 s~2 s内spike的平均发放频率;因为ON-OFF RGCs在给光和撤光时均会有较强的spikes的发放,故RTION-OFF为RTION和RTIOFF的平均值。对于ON或OFF RGCs来说,如果RTI值小于5,则表示该类为sustained RGCs;相反,则为transient RGCs。而对于ON-OFF RGCs而言,RTI值的判断标准为10,即:如果RTI值小于10,则表示该类为sustained RGCs;相反,则为transient RGCs。
3.5.3统计指标通过RDI和RTI指标,将所记录到的RGCs分成6类,即:ON transient、ON sustained、ON-OFF transient、ON-OFF sustained、OFF transient和OFF sustained RGCs。判断RGC是否有光反应时,如果给光或撤光引起的最大反应强度大于自发水平3倍的标准差,则认为是较好光反应的RGCs;相反,则为光反应极差或无光反应,即无效的RGCs。通过统计每类节细胞的自发、平均光反应和最大光反应,可以衡量各类RGCs的电生理特性。定义如下:节细胞的自发是给光前2 s内平均每秒spikes的发放数目;而平均光反应和最大光反应则分别为给光5 s内spikes减去自发后的平均发放频率和最大反应频率。
3.6免疫组化
3.6.1冰冻切片每次MEA记录后的视网膜片均需要进行免疫组化并统计形态学上是否有差异。首先将视网膜放入4%的多聚甲醛中,固定30 min;用0.1% PBS洗涤3遍,每遍5 min;然后将固定后的视网膜放入30%蔗糖溶液中脱水,直至沉入EP管底;将视网膜放入已填充OCT的包埋盒中,然后迅速放入-80 ℃冰箱。使用 Leica 切片机切片时,每个视网膜厚度为10 μm;切片完成后,烘片2 h,保存于-20 ℃冰箱。
3.6.2DAPI染色取出切好的玻片,用0.1% PBST洗涤3次,每次5 min;将DAPI加入0.3%PBST中,然后滴加到玻片上,孵育5~10 min后将液体倒去;接着使用荧光封片剂封片。最后,处理好的玻片在Confocal显微镜(Zeiss LSM700)下进行拍照,并使用Imag J进行统计分析。
4统计学处理
用SPSS 19.0统计软件进行分析。数据均采用均数±标准误(Mean±SEM)表示,组间比较采用两样本独立t检验,以P <0.05为差异有统计学意义。
结果
1免疫组化结果
在rd1小鼠视网膜退变的中期,感光层(outer nuclear layer, ONL)的厚度显著低于正常小鼠(P<0.01)。同龄正常小鼠视网膜感光层的厚度为(63.50±1.25)μm,有多层感光细胞,而rd1小鼠感光层的厚度为(3.03±0.07)μm,仅保留了一层细胞,但二级神经元层(inner nuclear layer, INL)和三级神经元层(ganglion cell layer, GCL)却基本保存了下来,见图1。
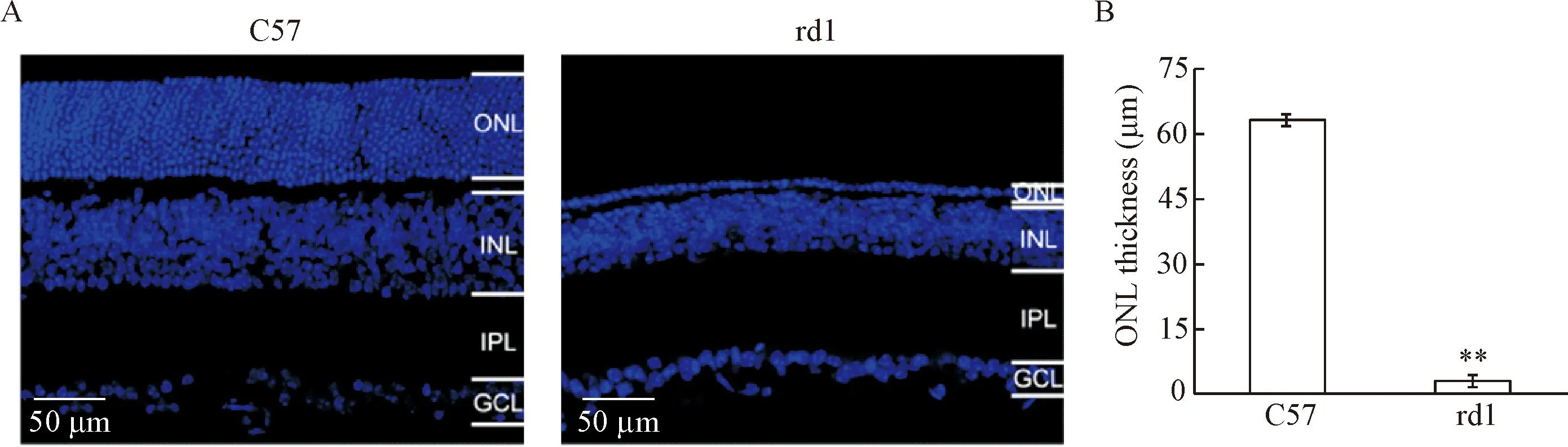
Figure 1.Most photoreceptors degenerate in rd1 mice at P20. A: representative photomicrographs of DAPI stained retinal sections (nuclei) from wide type mice and rd1 mice at P20; B: comparison of the thickness of outer nuclei layer where photoreceptors locate. The ONL thickness in rd1 mice is significantly lower than that in C57 mice. ONL: outer nuclear layer; INL: inner nuclear layer; IPL: inner plexiform layer; GCL: ganglion cell layer.Mean±SEM. n=5.**P<0.01 vs C57.
图1rd1小鼠在P20时大部分视网膜感光细胞已经退变
2MEA记录与视网膜节细胞的分类
本研究中,我们将边长为2 mm左右的视网膜平铺在8×8的MEA电极面上,使节细胞紧贴电极,这样可同时记录多个视网膜节细胞的活动,并且能够直接比较视网膜一定区域内相邻节细胞的spikes发放和光反应特性(第64通道红色标记时刻表示给光时间,从图中可以观察到很多通道均有较好的光反应)。为了能够比较视网膜同一类型的节细胞spikes发放特性,我们根据它们对光反应的不同,将视网膜节细胞分为6类:ON sustained、ON transient、ON-OFF sustained、ON-OFF transient、OFF sustained和OFF transient RGCs(红色区域为给光时间),见图2。

Figure 2.Multi-electrode array (MEA) recording from the normal mouse retina and classification of retina ganglion cells. A: picture shows a piece of retina mount on the MEA recording system; B: a sample recording of light-evoked spike activities from the retina of a C57 mouse at P20.The red vertical bar in the right bottom grid shows the onset of light stimulus, while other channels exhibit corresponding spiking to the light stimulus; C: typical classification of 6 types of RGCs in wild-type retinas.Light stimulus(2 s) is indicated by red region.
图2C57小鼠视网膜的多电极阵列记录及其节细胞的分类
3rd1与正常小鼠视网膜中对光反应的节细胞的百分比及其6类节细胞所占百分比的比较
在视网膜感光细胞凋亡的中期,大量感光细胞的死亡,可能使部分节细胞的光反应消失。因此,我们首先统计有明显光反应的RGCs占总数的百分比。在rd1小鼠中,我们总共记录到587个RGCs,但只有410个RGCs有较好光反应,所以有光反应节细胞的百分比为(69.4±3.8)%;而正常野生型小鼠有效比为(96.5±2.3)%,明显高于rd1小鼠(P<0.01)。因此在视网膜退变中期,rd1小鼠视网膜中保持光反应的节细胞比例已经显著低于正常小鼠。
接着我们比较了rd1和C57小鼠视网膜6类节细胞所占的百分比,这是首次在rd1小鼠视网膜退变模型中根据功能将节细胞分成6类。在正常小鼠中,记录到的ON RGCs占68.4%,ON-OFF RGCs占24.5%;而在rd1小鼠视网膜中,所记录到的ON RGCs占48%,ON-OFF RGCs占38.4%;此外,OFF sustained RGCs型细胞所占比重和数目极小(rd1 1.0%;C57 3.1%),故后续的分析我们将OFF sustained和OFF transient合并为OFF RGCs进行统计分析。初步分析6类RGCs显示:相比正常小鼠,rd1小鼠的ON sustained型比例显著下降(P<0.05),而ON-OFF sustained 的比例显著上升(P<0.01),提示rd1小鼠在感光细胞退变过程中,不同类型的节细胞的变化情况可能不一致,见图3。
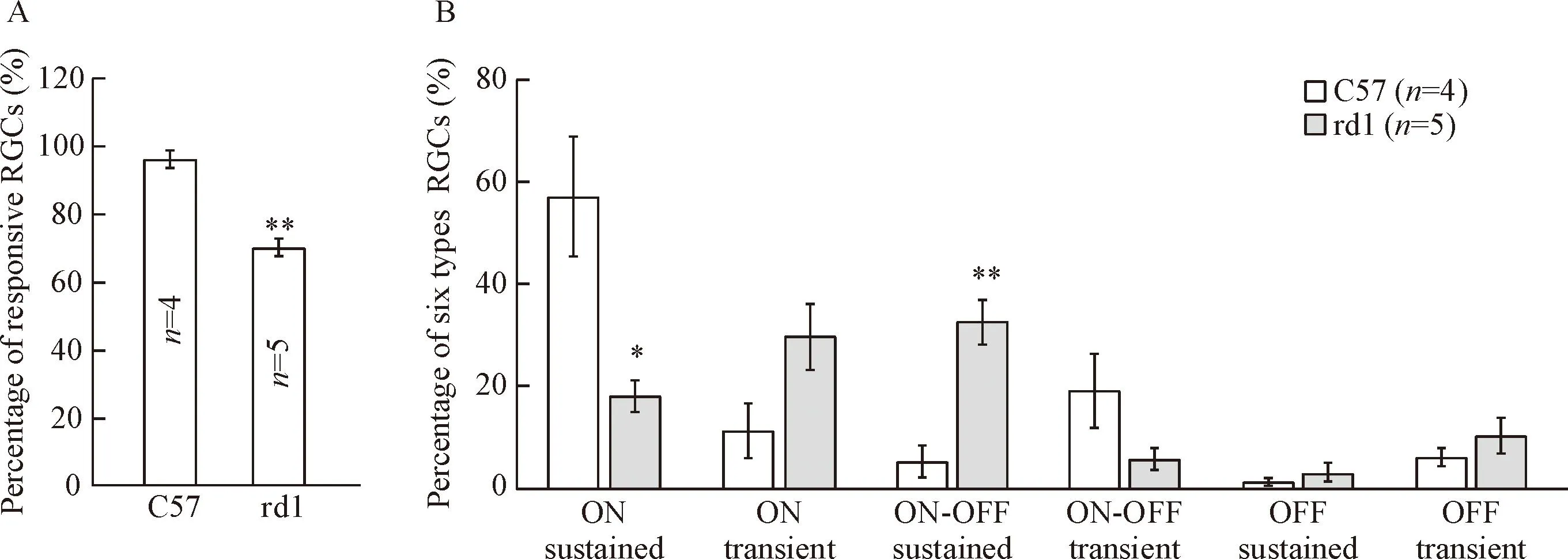
Figure 3.The percentage of responsive RGCs and six types of RGCs in C57 and rd1 mice at P20. A:percentage of visually responsive RGCs in response to flashes for wild-type and rd1 retinas; B:percentage of 6 classes of RGCs among light responsive cells in C57 and rd1 mice. Mean±SEM.*P<0.05,**P<0.01 vs C57.
图3rd1与正常小鼠视网膜中对光反应的节细胞的有效百分比及其6类节细胞所占百分比
4视网膜退变中期最大光强下节细胞的自发增强、平均和最大光反应强度显著降低
为了评估视网膜退变中期各类节细胞功能的变化情况,我们将在最大光强下(3.61×107photons·μm-2·s-1)所记录到的RGCs根据功能分成5类,分别统计各类的自发发放、平均光反应和最大光反应,观察各类RGCs的变化。
首先我们比较了视网膜节细胞自发发放的变化。当统计全部RGCs时, rd1小鼠节细胞的自发发放显著高于正常小鼠(P<0.01)。而当我们具体观察每一种类型的节细胞时,仅有ON sustained、ON transient和ON-OFF sustained RGCs 3类RGCs的自发发放显著高于正常小鼠(P<0.01);但ON-OFF transient和OFF RGCs 2类并没有显著差异。这是首次报道视网膜退变过程中,小鼠各类节细胞自发发放的变化有所不同。
随后我们比较了各类型节细胞对光反应强度的变化。由于至今仍然没有很统一的指标去统计节细胞光反应的变化,我们采用了目前最常用的2种方法,即平均反应强度(average response)和最大反应强度(peak response)。两种统计指标均显示相似的趋势:在rd1小鼠退变的中期,视网膜各类节细胞的光反应强度及幅度都显著低于正常小鼠,见图4。

Figure 4.Comparison of spontaneous and light responses between RGCs of rd1 and C57 mice at P20. Light stimulus is a 2 s flash with intensity of 3.6×107photons·μm-2·s-1. A: average spontaneous spiking rate for rd1 RGCs is overall significantly increased than that in C57 RGCs, but is differentially affected among different RGC types.There was significant difference in ON sustained, ON transient and ON-OFF sustained RGCs between normal and degenerated retina, whereas no difference is observed in both ON-OFF transient and OFF RGCs; B: comparison of the average and peak response of all types of RGCs between normal and degenerated retina. For all types of RGCs, the light-induced responses are decreased significantly for both the average and the peak in rd1 retina compared with those in C57 mice. Numbers inside histograms represent number of recorded cells. Mean±SEM.*P<0.05,**P<0.01 vs C57.
图4最大光强下rd1小鼠与C57小鼠视网膜节细胞的自发、平均和最大光反应强度的比较
5视网膜退变中期节细胞的光敏感度显著降低
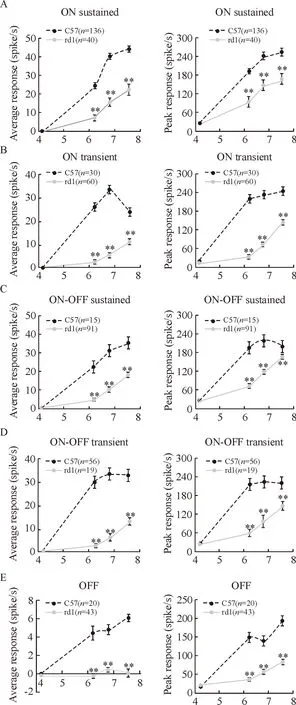
最后,我们探讨了rd1小鼠视网膜退变的中期,各类节细胞的光敏感度的变化情况。如图5所示,视网膜6类节细胞的平均光反应和最大光反应幅度有着相似的趋势:在各种能激发spike发放的刺激光强下,rd1小鼠所有RGCs的光反应幅度显著低于正常组(P<0.01)。随着光强的增加,节细胞光反应幅度均会随着增加。除了OFF 型节细胞,正常小鼠的其它类型节细胞在最大光强前已经达到饱和,即已经达到最大反应强度。但rd1小鼠视网膜的所有类型节细胞的光反应并没有达到饱和且正处在上升支,说明rd1小鼠节细胞需要更高的光强刺激才有可能达到最大发放。因此,在rd1小鼠视网膜退变的中期,各类节细胞光反应的敏感度均显著低于正常C57小鼠。
讨论
1rd1小鼠视网膜节细胞光反应强度及光敏感度减弱、自发发放增强
在rd1小鼠退变的中期,视网膜的各类节细胞光反应强度及光敏感度均显著低于正常小鼠,而且光反应强度并未达到最大值并正处在上升支,这可能是来自视网膜最外层感光层的信号减少所致,这和形态学结果相一致。在rd1小鼠出生后17 d左右时,仅2%左右的视杆细胞保存下来,而此时至少还有75%的视锥细胞保留下来;大部分视锥感光细胞至第36天才逐渐消失[2]。因此,到视网膜凋亡中期第20天时,尚存的视锥细胞和少量视杆细胞,也许可以维持整个视觉通路功能。通过多电极记录我们发现约69.4%的节细胞保持明显的光反应,表明较少感光细胞的存留仍然能够维持较多节细胞的光反应。一方面可能由于突变过程中神经回路的重组,比如双极细胞树突的迁移及其突起的增生,另一方面细胞级联放大系统可以将感光细胞层的信号进行放大输出[11],从而使较多的节细胞能够有效地接收残存感光细胞的输入信号。
同时,我们也观察到节细胞有着极度活跃的自发发放。rd1小鼠较高的自发发放并非是由于组织准备时视网膜受损致使的敏感度增高或者MEA记录时活性降低所致;因为:第一,这种较高的自发和光反应均能够稳定地持续3~6 h,表明不受组织活性的影响;第二,在不同的rd1小鼠视网膜中均能观察到较高的自发发放,因此不是个别现象;第三,有文献报道极度活跃的自发发放是来自于视网膜内部通路的变化,并且能够引起上丘神经元发放的增加[12]。超强的自发也不是由于不同品系小鼠的背景不同造成的,因为在rd1/C57背景的小鼠视网膜节细胞也观察到类似的现象[9]。另外,退行性视网膜这种超强的自发在其它几种小鼠品系中均有报道,包括rd10[13]、P23H-1大鼠[14]和RCS大鼠[15]。这种视网膜退行性疾病模型的自发目前被认为是来自于AII无长突细胞[16-17],并且通过AII无长突细胞和其它细胞类型(比如ON-Cone双极细胞)耦合的缝隙连接向视网膜网络传播[16,18]。视网膜退变过程中自发发放的增强将干扰正常信号的传导,因此如何有效抑制自发发放成为临床治疗视网膜退变的一个重要考虑因素。
Log light intensity (photons·μm-2·s-1)
Figure 5.Average (left) and peak (right) light intensity response curves of all RGCs types from C57 and rd1 mice.The average and peak response of light-evoked spikes increase with the increase of light intensity. By the maximum light intensity, the light-evoked response in C57 RGCs saturate, while the response of rd1 retinas is still rising. The average and peak responses in rd1 RGCs are both significantly lower than those of C57 RGCs.Numbers in each graph indicate number of cells recorded. Mean±SEM.*P<0.05,**P<0.01 vs C57.
图5视网膜五类节细胞的平均和最大光强响应曲线
2视网膜退变中期不同类型节细胞功能的变化
在视网膜退变的中期,各类节细胞占具有光反应的节细胞总数的百分比与正常小鼠相比有所不同。rd1小鼠ON sustained RGCs的比例显著低于正常C57小鼠,而ON-OFF sustained RGCs的比例却显著高于正常小鼠,其它类型的RGCs却没有显著变化。同时,各类节细胞的自发变化也是不同的。rd1小鼠视网膜ON sustained、ON transient和ON-OFF sustained RGCs 3类RGCs的自发发放要显著高于正常小鼠;但ON-OFF transient和OFF RGCs两类并没有显著变化。因此,我们首次发现了视网膜退变过程中,不同类型节细胞的自发变化有所不同。然而,不同类型节细胞的光反应强度和光敏感度的影响却是一致的,均显著低于正常C57小鼠。以上的差异可能与内层神经元谷氨酸受体表达不同[19]和不同类型节细胞接受的信号输入不同有关。比如大量ON型节细胞接受视杆系统的输入,而中期视杆细胞大量凋亡,信号中断,大量的视杆双极细胞转而与残存的视杆及视锥细胞建立联系,产生异常突触连接[20-21],从而导致下游的信号变化。
3视网膜退行性疾病的治疗
300人中大约有1人是患有全盲或半盲的视网膜退行性疾病,比如色素性视网膜炎、年龄相关性黄斑变性(age-related macular degeneration,AMD)、糖尿病视网膜病变等。在这些疾病中,感光细胞变性凋亡,导致患者失明,严重影响患者的生活质量,从而带来巨大的社会、经济问题。目前,有两类可能的治疗方法:其中一个主要是针对于非常早期的疾病状态,目的是运用药物疗法[22]和基因替代疗法[23]去减缓或者停止光感光器的退变进程;另外一个治疗方案是在光感受器完全消失后采取一些治疗手段从而恢复视觉,这些治疗方法包括干细胞疗法[24]、电子假体[25]和光遗传学法[26-27]等。不管采用哪种治疗手段,一个理想的治疗视网膜退行性疾病的方案应该满足以下要求:(1)恢复视网膜的光敏感度;(2)在周围环境的光强下应该有较好的功能;(3)与残存视网膜内层神经元有较好的生理兼容性;(4)保护视网膜节细胞固有的触发特性;(5)没有毒性和免疫原性的副作用;(6)所有的治疗应该是微创并且由安全的临床技术来完成[28]。而且这些治疗方案都要求在治疗阶段视网膜下游神经元的结构和功能是完整的。如果节细胞丧失了对上级神经元信号刺激的兴奋性反应或丧失了往下级神经元传递兴奋性的功能,即使在治疗中成功诱导退变感光细胞、双极细胞或节细胞直接对光产生反应,也无法将信息传递到大脑产生视觉。因此了解感光细胞退变过程中节细胞功能变化,对于寻找治疗视网膜退行性疾病的有效治疗窗口有重要的意义。本研究详细阐述了在视网膜退变中期各类节细胞功能的变化,将在一定程度上为临床上寻找有效的防治时间、作用靶点提供重要的参数。
[参考文献]
[1]Bowes C, Li T, Danciger M, et al. Retinal degeneration in the rd mouse is caused by a defect in the beta subunit of rod cGMP-phosphodiesterase[J].Nature, 1990, 347(6294):677-680.
[2]Carter-Dawson LD, LaVail MM, Sidman RL. Differential effect of the rd mutation on rods and cones in the mouse retina[J].Invest Ophthalmol Vis Sci, 1978, 17(6):489-498.
[3]Jiménez AJ, García-Fernández JM, González B, et al. The spatio-temporal pattern of photoreceptor degeneration in the aged rd/rd mouse retina[J]. Cell Tissue Res, 1996, 284(2): 193-202.
[4]Santos A, Humayun MS, de Juan E Jr,et al. Preservation of the inner retinal in retinitis pigmentosa: a morphological analysis[J]. Arch Ophthalmol, 1997, 115(4):511-515.
[5]Marc RE,Jones BW,Anderson JR, et al. Neural reprogramming in retinal degeneration[J]. Invest Ophthalmol Vis Sci, 2007, 48(7):3364-3371.
[6]Marc RE,Jones BW, Watt CB, et al. Neural remodeling in retinal degeneration[J].Prog Retin Eye Res, 2003, 22(5):607-655.
[7]Strettoi E, Porciatti V, Falsini B, et al. Morphological and functional abnormalities in the inner retina of the rd/rd mouse[J]. J Neurosci, 2002, 22(13):5492-5504.
[8]Strettoi E, Pignatelli V, Rossi C,et al. Remodeling of second-order neurons in the retina of rd/rd mutant mice[J]. Vision Res, 2003, 43(8):867-877.
[9]Stasheff SF. Emergence of sustained spontaneous hyperactivity and temporary preservation of OFF responses in ganglion cells of the retinal degeneration (rd1) mouse[J]. J Neurophysiol, 2008, 99(3):1408-1421.
[10]Della Santina L, Inman DM, Lupien CB, et al. Differential progression of structural and functional alterations in distinct retinal ganglion cell types in a mouse model of glaucoma [J]. J Neurosci, 2013, 33(44):17444-17457.
[11]Morgans CW, Zhang J, Jeffrey BG, et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells[J]. Proc Natl Acad Sci U S A, 2009, 106(45): 19174-19178.
[12]Sauvé Y, Girman SV, Wang S,et al. Progressive visual sensitivity loss in the Royal College of Surgeons rat: perimetric study in the superior colliculus[J]. Neuroscience, 2001, 103(1):51-63.
[13]Stasheff SF, Shankar M, Andrews MP. Developmental time course distinguishes changes in spontaneous and light-evoked retinal ganglion cell activity in rd1 and rd10 mice[J]. J Neurophysiol, 2011, 105(6):3002-3009.
[14]Sekirnjak C, Jepson LH, Hottowy P, et al. Changes in physiological properties of rat ganglion cells during retinal degeneration[J]. J Neurophysiol, 2011, 105(5):2560-2571.
[15]Pu M, Xu L, Zhang H. Visual response properties of retinal ganglion cells in the royal college of surgeons dystrophic rat[J]. Invest Ophthalmol Vis Sci, 2006, 47(8):3579-3585.
[16]Trenholm S, Borowska J, Zhang J, et al. Intrinsic oscillatory activity arising within the electrically coupled AII amacrine ON cone bipolar cell network is driven by voltage-gated Na+channels[J]. J Physiol, 2012, 590(10):2501-2517.
[17]Choi H, Zhang L, Cembrowski MS, et al. Intrinsic bursting of AII amacrine cells underlies oscillations in the rd1 mouse retina[J]. J Neurophysiol, 2014, 112(6):1491-1504.
[18]Yee CW, Toychiev AH, Sagdullaev BT. Network deficiency exacerbates impairment in a mouse model of retinal degeneration[J]. Front Syst Neurosci, 2012, 6(8):1-14.
[19]张佳, 项宗勤, 徐颖.视网膜感光细胞退变过程中内层神经元结构和功能的变化[J]. Chinese Journal of Pathophysiology, 2016, 32(1):179-186.
[20]Beltran WA.On the role of CNTF as a potential therapy for retinal degeneration: Dr. Jekyll or Mr. Hyde?[J]. Adv Exp Med Biol, 2008, 613:45-51.
[21]Peng YW, Hao Y, Petters RM, et al. Ectopic synaptogenesis in the mammalian retina caused by rod photoreceptor-specific mutations[J]. Nat Neurosci, 2000, 3(11):1121-1127.
[22]Peng YW, Senda T, Hao Y, et al. Ectopic synaptogenesis during retinal degeneration in the royal college of surgeons rat[J]. Neuroscience, 2003, 119(3):813-820.
[23]Busskamp V, Krol J, Nelidova D, et al. miRNAs 182 and 183 are necessary to maintain adult cone photoreceptor outer segments and visual function[J]. Neuron, 2014, 83(3):586-600.
[24]Li T, Lewallen M, Chen S, et al. Multipotent stem cells isolated from the adult mouse retina are capable of producing functional photoreceptor cells[J]. Cell Res, 2013, 23(6):788-802.
[25]Chuang AT,Margo CE,Greenberg PB. Retinal implants: a systematic review[J].Br J Ophthalmol, 2014, 98(7):852-856.
[26]Busskamp V, Duebel J, Balya D, et al. Genetic reactivation of cone photoreceptors restores visual responses in retinitis pigmentosa[J]. Science, 2010, 329(5990):413-417.
[27]Lagali PS, Balya D, Awatramani GB, et al. Light-activated channels targeted to ON bipolar cells restore visual function in retinal degeneration[J]. Nat Neurosci, 2008, 11(6):667-675.
[28]van Wyk M, Pielecka-Fortuna J, Löwel S, et al. Restoring the ON switch in blind retinas: opto-mGluR6, a next-generation, cell-tailored optogenetic tool[J].PLoS Biol, 2015, 13(5):1-30.
(责任编辑: 林白霜, 余小慧)
Functional changes of retinal ganglion cells in rd1 mice during midterm of retinal pigmentosa
LIU Feng, ZHANG Jia, XU Di, XIANG Zong-qin, XU Ying
(GHMInstituteofCNSRegeneration,JinanUniversity,Guangzhou510632,China.E-mail:xuying@jnu.edu.cn)
[ABSTRACT]AIM: To investigate how the function of retinal ganglion cells (RGCs) change in the midterm of retinal pigmentosa (RP) in rd1 mice (a transgenic animal model of RP). METHODS: The action potentials from multiple RGCs in rd1 mice at postnatal 20 d (P20) or normal C57 mice (control) were simultaneously recorded by multi-electrode array recording. The functional changes of surviving ganglion cells were evaluated by comparing spontaneous and light-evoked activities of RGCs between rd1 and control mice. The extent of photoreceptor degeneration was verified by immunohistochemical staining. RESULTS: Immunohistochemistry results showed the thickness of the retinal photoreceptor layer of rd1 mice was significantly lower than that in normal mice at P20. According to the light response properties, we classified ganglion cells into 6 subgroups: ON sustained, ON transient, ON-OFF sustained, ON-OFF transient, OFF sustained and OFF transient RGCs, with a very tiny percentage of OFF sustained RGCs (1.0%~3.1%). The percentage of RGCs remaining light responsive in rd1 mice was significantly lower than that in C57 mice. The average spontaneous spiking rate for rd1 RGCs was overall significantly increased compared to that in C57 cells, whereas different RGC types had different changes. The light-induced responses and light sensitivities of all types of RGCs in rd1 mice were both significantly lower than those in C57 mice. CONCLUSION: The photoreceptors of rd1 mice are severely degenerated in the midterm of retinal degeneration. The functions of RGCs in rd1 mice in the midterm of degeneration decay obviously, with variance in different RGCs types.
[KEY WORDS]Multi-electrode arrays; Retinal pigmentosa; Retinal ganglion cells; rd1 mice
[文章编号]1000- 4718(2016)05- 0811- 08
[收稿日期]2016- 02- 17[修回日期] 2016- 03- 29
*[基金项目]国家自然科学基金资助项目(No.81470656)
通讯作者△Tel: 020-85227086; E-mail: xuying@jnu.edu.cn
[中图分类号]R774; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.007
杂志网址: http://www.cjpp.net

