组蛋白化学修饰改变对c-Myb结合的影响及其在职业性苯中毒患者造血损伤中的作用*
施益芬, 陈晶晶, 俞 康
(温州医科大学附属第一医院血液科, 浙江 温州 325015)
组蛋白化学修饰改变对c-Myb结合的影响及其在职业性苯中毒患者造血损伤中的作用*
施益芬,陈晶晶,俞康△
(温州医科大学附属第一医院血液科, 浙江 温州 325015)
[摘要]目的: 研究职业性苯中毒造血损伤患者中与拓扑异构酶Ⅱα启动子调控因子c-Myb结合的组蛋白化学修饰改变, 证实组蛋白乙酰化修饰水平改变在职业性苯中毒造血损伤中发挥一定的作用。方法: 25例职业性苯中毒再生障碍性贫血患者为病例组,25例正常人为对照组,提取骨髓单个核细胞,用染色质免疫沉淀(ChIP)探讨与c-Myb结合的组蛋白乙酰化和甲基化水平的改变,RT-PCR法检测c-Myb的mRNA表达水平,组蛋白去乙酰化酶(HDAC)试剂盒检测HDAC活性的变化。结果: 与正常对照组相比,职业性苯中毒再生障碍性贫血患者c-Myb与乙酰化组蛋白H4、H3结合的水平下降(P<0.01), 而与甲基化组蛋白H3K4和H3K9结合的水平无明显改变,差异无统计学显著性。与正常对照组相比,职业性苯中毒再生障碍性贫血患者c-Myb的mRNA表达水平降低,HDAC活性明显升高,差异均有统计学显著性(P<0.05)。结论: 拓扑异构酶Ⅱα启动子调控因子c-Myb可能通过组蛋白乙酰化修饰的改变在职业性苯中毒造血损伤中发挥作用。
[关键词]苯; c-Myb; 组蛋白乙酰化; 组蛋白甲基化; 染色质免疫沉淀; 组蛋白去乙酰化酶
苯是一种具有血液毒性和遗传毒性的重要化工原料。急慢性苯中毒病例报道屡见不鲜。卫生部2010年职业病防治工作和2011年重点工作情况通报中,苯中毒均位列慢性职业中毒前3位。对造血系统损害的表现是慢性苯中毒的主要特征,长期过量接触苯可以导致白细胞和血小板减少、再生障碍性贫血和白血病[1-2]。2012年,国际癌症研究所重申苯为人类致癌物,能导致急性白血病、骨髓增生异常综合征、淋巴瘤等。
苯所致造血毒性和白血病的分子机制尚未被阐明。拓扑异构酶(topoismerase,TOPO)的研究近年来受到关注[3-4]。本课题组的前期研究显示,苯及其代谢物影响骨髓单个核细胞TOPOⅡα启动子组蛋白的化学修饰改变,导致TOPOⅡα表达及活性下降可能参与了苯所致的造血毒性[3, 5-6]。c-Myb是TOPOⅡα启动子的重要调控因子,能明显增加TOPOⅡα的表达[7]。本研究探讨职业性苯中毒造血损伤中c-Myb的改变及与组蛋白化学修饰变化的关系,通过检测职业性苯中毒再生障碍性贫血患者组蛋白去乙酰化酶(histonedeacetylase,HDAC)活性的改变,证实c-Myb可能通过组蛋白乙酰化修饰的改变在职业性苯中毒造血损伤中发挥作用,为进一步认识苯中毒造血损伤的发病机制提供依据。
材料和方法
1对象
实验组的骨髓标本25份取自职业性苯中毒再生障碍性贫血患者,男性9例,女性16例,平均年龄32.5岁(20~56岁),平均触苯时间≥6月(6月~5年)。工作环境中平均苯浓度为87mg/m3(50~1 000mg/m3),远远超过美国政府工业卫生专家协会规定的最高时间加权平均容许浓度(permissibleconcentration-timeweightedaverage,PC-TWA)及短时间接触容许浓度(pemissibleconcentration-shorttermexposurelimit,PC-STEL)。对照组的骨髓标本25份取自年龄、吸烟、饮酒习惯等匹配的健康志愿者,男性11例,女性14例;平均年龄33.8岁(19~58岁)。苯中毒再生障碍性贫血患者根据GBZ68-2002《职业性苯中毒诊断标准》诊断。本研究已通过温州医科大学附属第一医院伦理委员会的认证。所有骨髓捐献者均签署知情同意书。
2主要试剂
RPMI-1640培养基(Gibco);淋巴细胞分离液(天津TBD生物技术发展中心);染色质免疫沉淀(chromatinimmunoprecipiation,ChIP) 分析试剂盒、抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体、抗二甲基组蛋白H3(K9)抗体和抗三甲基组蛋白H3(K4)抗体(Upstate);体积分数为37%的甲醛(Sigma);蛋白酶抑制剂(Calbiochem);TRIzol和PlatinumRPCRSuperMix(Invitrogen);RT-PCR试剂盒、GeneRulerTM50bpDNALadder(MBIFermentas);核蛋白提取试剂盒(Thermo);HDAC活性测定试剂盒(Millipore);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)。
3主要方法
3.1骨髓单核细胞悬液的制备取职业性苯中毒再生障碍性贫血患者及健康志愿献髓员的骨髓5mL,肝素(5×104U/L)抗凝,骨髓标本与RPMI-1640液1∶1混匀后,淋巴细胞分离液密度梯度离心法(2 000r/min离心10min)分离单个核细胞层,制备成单个核细胞悬液。台盼兰染色检测活细胞率,要求拒染率达95%以上。骨髓单个核细胞悬浮培养,调整细胞终浓度为1×109/L。
3.2ChIP检测ChIP检测按ChIP分析试剂盒产品说明书进行。分别在培养液中直接加入37 %的甲醛,使最终浓度为1 %,37 ℃固定10min, 以交联组蛋白和DNA。加入含有蛋白酶抑制剂的SDS细胞裂解液200μL重悬细胞, 冰上孵育10min,用超声将DNA打碎成250~1 000bp(此处提取的DNA片段命名为inputDNA)。用特异性抗体[抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体、抗二甲基组蛋白H3(K9)抗体、抗三甲基组蛋白H3(K4)抗体]沉淀DNA-蛋白复合物, 用蛋白A琼脂吸附复合物, 低盐免疫复合体洗液、高盐免疫复合体洗液、LiCl免疫复合体洗液、TE缓冲液洗去非特异性吸附后, 加入5moL/LNaCl65 ℃置4h以解除蛋白/DNA交联,沉淀的DNA片段-20 ℃保存备用(此DNA片段命名为ChIPedDNA)。ChIPedDNA通过PCR法对目标基因(c-Myb)进行分析。
3.3c-MybDNA水平的检测针对c-Myb的DNA序列设计引物(表1)。将各组得到的ChIPedDNA分别加入上述引物进行PCR反应,反应体系为:PCRSuperMix12μL,调控因子上游引物 0.5μL,调控因子下游引物 0.5μL,上述制得的模板DNA2μL。反应条件为:94 ℃ 5min;94 ℃ 30s,62 ℃ 30s,72 ℃ 1min,35个循环;72 ℃10min,4 ℃ 30min。反应完成后用1.8%琼脂糖凝胶电泳并照相,QuantityOne图像分析系统分析实验结果。c-Myb水平变化=(IP苯中毒组/Input苯中毒组)/(IP对照组/Input对照组)。
3.4c-Myb的mRNA水平检测(1)RNA的提取及cDNA合成:采用TRIzoL法提取总RNA,紫外分光光度计测RNA的纯度及浓度(A260/A280居于1.8~2.0之间认为合格)。采用随机引物法合成cDNA。(2)针对扑异构酶Ⅱα启动子调控因子c-Myb的mRNA序列设计引物,引物与GenBank基因序列核对无误;采用β2-微球蛋白(β2-microglobulin,β2-MG)作为内参照(表1)。(3)PCR扩增反应体系为:PCRSuperMix12μL,上游引物 0.5μL,下游引物 0.5μL,cDNA2μL。反应条件为:95 ℃ 5min;95 ℃ 30s,53 ℃(c-Myb)或52 ℃(β2-MG) 30s,72 ℃ 30s,35个循环;72 ℃10min。经1.5%的琼脂糖凝胶电泳后,QuantityOne图像分析系统分析实验结果。以目标基因与β2-MG扩增产物吸光度值的比值计算表达水平。

表1 引物序列
3.5核蛋白的提取分别收集实验组及对照组的骨髓单个核细胞,等渗PBS液洗2遍;按照Thermo核蛋白提取试剂盒说明书进行抽提,骨髓单个核细胞离心沉淀后,依次加入CERⅠ液、CERⅡ液剧烈振荡、冰浴后离心,弃上清,加NER液剧烈振荡、冰浴后离心,上清液系胞核蛋白。提取的核蛋白用BCA蛋白浓度测定试剂盒测定浓度后-70 ℃保存备用。
3.6HDAC活性测定按照HDAC活性测定试剂盒说明书进行,使用试剂盒所配套的96孔板,各孔加入 2×HDAC assay buffer 10 μL,各待测样品、阴性对照和阳性对照各20 μL,吹打混匀后加入4 mmoL/L HDAC substrate 10 μL,37 ℃孵育60~70 min;稀释activator solution 液20 μL,37 ℃放置10~20 min。在酶标仪405 nm波长处读取吸光度值(A值)。实验重复3次,设复孔3个,取平均值为最终结果。HDAC的活性=(实验组A值-空白对照A值)/蛋白含量(μg)。
4统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,t检验来确定两组之间的差异。以P<0.05为差异有统计学意义。
结果
1苯中毒对c-Myb结合的组蛋白化学修饰改变的影响
1.1与乙酰化组蛋白H4结合的c-Myb水平临床苯中毒病例组c-Myb与乙酰化组蛋白H4结合的水平较正常对照组明显下降,差异有统计学显著性(P<0.01),见图1、3。
1.2与乙酰化组蛋白H3结合的c-Myb水平临床苯中毒病例组c-Myb与乙酰化组蛋白H3结合的水平较正常对照组明显下降,差异有统计学显著性(P<0.01),见图1、3。
1.3与甲基化组蛋白H3K4结合的c-Myb水平临床苯中毒病例组c-Myb与甲基化组蛋白H3K4结合的水平较正常对照组无明显改变,差异无统计学显著性,见图2、3。
1.4与甲基化组蛋白H3K9结合的c-Myb水平临床苯中毒病例组c-Myb与甲基化组蛋白H3K9结合的水平较正常对照组无明显改变,差异无统计学显著性,见图2、3。
2苯中毒对c-Myb mRNA表达水平的影响
临床苯中毒病例组c-Myb的mRNA表达水平较对照组降低,差异有统计学显著性(P<0.05),见图4。
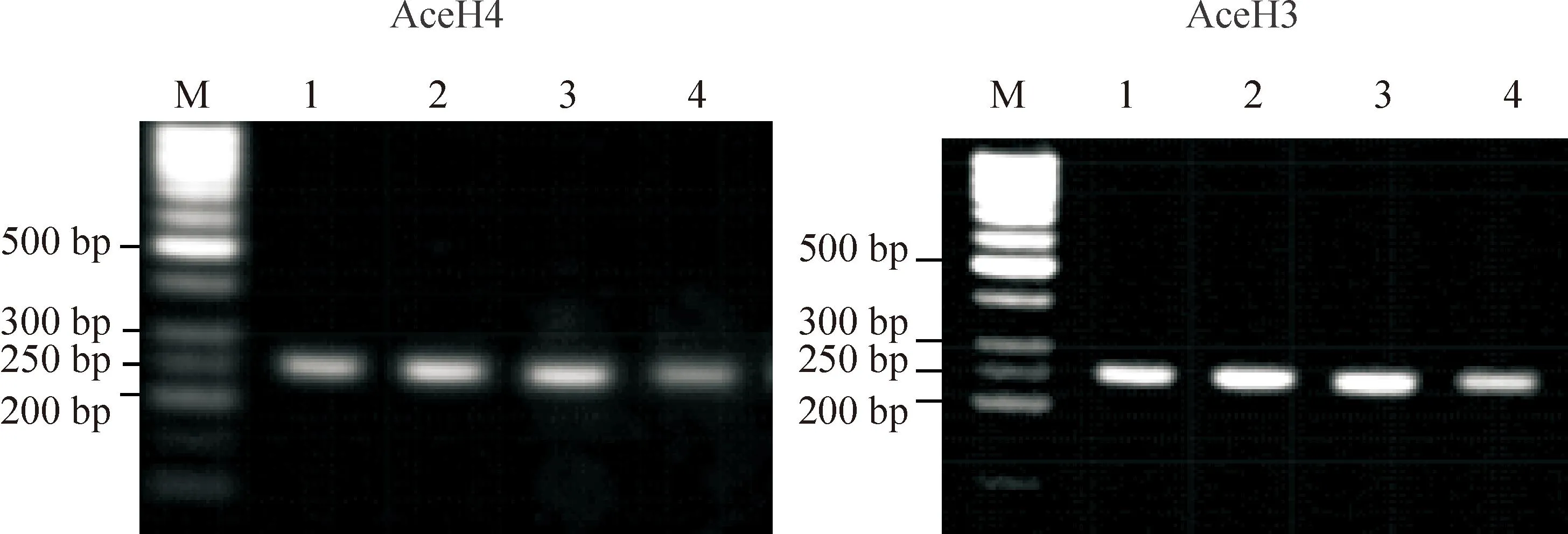
Figure 1.The levels of c-Myb binding to acetylated histone detected by ChIP analysis. M: marker; 1: input control; 2: IP control; 3: input benzene; 4: IP benzene.
图1乙酰化组蛋白结合的c-Myb

Figure 2.The levels of c-Myb binding to methylated histone detected by ChIP analysis. M: marker; 1: input control; 2: IP control; 3: input benzene; 4: IP benzene.
图2甲基化组蛋白结合的c-Myb
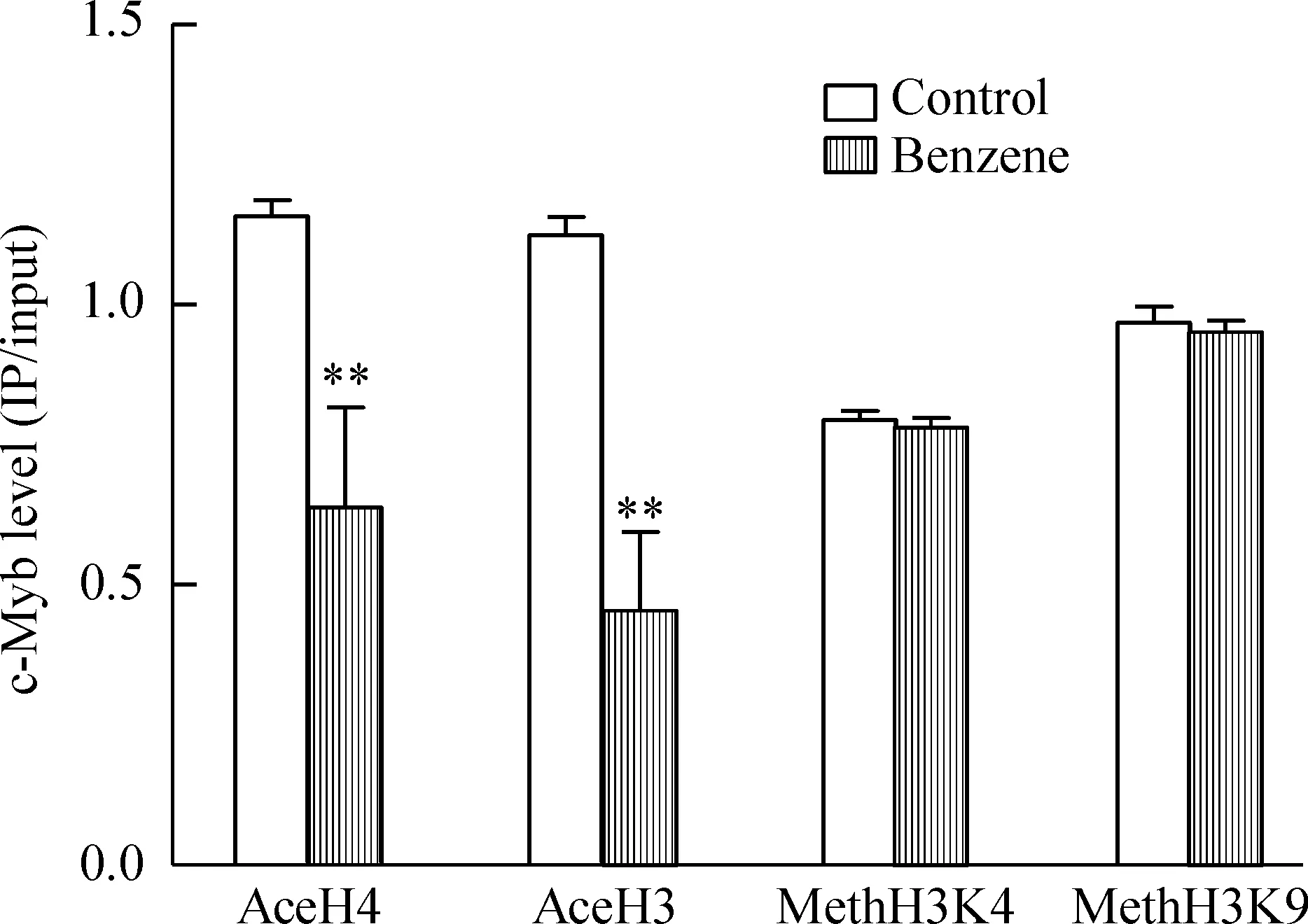
Figure 3.Changes of c-Myb binding levels to histones modified by acetylation and methylation. Mean±SD. n=5.**P<0.01 vs control.
图3c-Myb 结合的组蛋白乙酰化和甲基化修饰水平的变化

Figure 4.The mRNA expression of c-Myb detected by RT-PCR. Mean±SD. n=5.*P<0.05 vs control.
图4RT-PCR检测c-Myb 的mRNA水平
3苯中毒对HDAC活性的影响
临床苯中毒病例组HDAC活性较对照组升高,差异有统计学显著性(P<0.05),见图5。

Figure 5.HDAC activity of bone marrow mononuclear cells. Mean±SD.n=10.*P<0.05 vs control.
图5骨髓单个核细胞HDAC活性
讨论
近年来,苯所致造血毒性已得到广泛的重视,但其毒性机制仍远未阐明,脂质过氧化、细胞凋亡、DNA损伤、细胞微环境受损、免疫异常均是其可能机制之一[8-10]。自1996年Frantz等首次提出苯的活性代谢产物抑制TOPOⅡ活性开始,TOPO在苯所致造血毒性中的作用日渐明确[3-4]。
表观基因机制在肿瘤的发生机制中有着与基因突变机制同等重要的作用。组蛋白的共价修饰是表观基因机制的重要内容, 参与调控多种生物学事件,主要包括组蛋白乙酰化、组蛋白甲基化、DNA甲基化和染色质高级结构中其它成分的修饰。组蛋白乙酰化、甲基化可直接影响一系列细胞核内生物过程,包括基因转录、DNA修复、DNA复制和染色体组装,调控基因的表达[11]。组蛋白乙酰化与基因转录激活有关[12],去乙酰化常见基因转录沉默[13],而组蛋白甲基化的功能则因氨基酸残基类别和它们在组蛋白尾端的位置不同而不尽相同[12],组蛋白H3K4甲基化与基因转录活化相关,而组蛋白H3K9甲基化常见基因转录沉默[14]。
ChIP技术是一种在体内研究DNA和蛋白质相互作用的方法,能够较真实地反映体内染色质与基因转录调控因子的结合情况,被大量应用于其它转录调控因子如CRE结合蛋白[15]及c-Myc等对其靶基因表达的调控分析。我们的前期研究发现苯所致造血毒性与TOPOⅡα的表达(含量、活性)下降相关,而TOPOⅡα启动子组蛋白乙酰化、甲基化化学修饰改变是其表达下降的机制之一[3,5-6]。在此基础上,本课题组借助ChIP技术进一步研究TOPOⅡα启动子调控因子组蛋白化学修饰改变在职业性苯中毒造血损伤机制中发挥的作用[16]。
c-Myb是TOPOⅡα启动子重要的调控因子,在TOPOⅡα启动子近端的5’区存在c-Myb的结合位点[17],c-Myb通过与c-Myb结合位点(-16至-11位点)结合,激活TOPOⅡα的表达[7]。我们针对c-Myb设计了相应的适合ChIP后产物的引物,来观察其水平的改变。研究发现,职业性苯中毒再生障碍性贫血患者c-Myb结合的组蛋白乙酰化修饰水平降低,c-Myb的mRNA表达水平下降,提示c-Myb结合的组蛋白乙酰化水平的改变可能参与了TOPOⅡα表达的降低。
组蛋白乙酰化水平是一个动态平衡状态,由HDAC和组蛋白乙酰基转移酶(histoneacetyltransferases,HAT)共同调控。Sonnemann等[18]通过临床收集各种血液肿瘤标本,进行HDAC活性测定,研究发现体内低乙酰化水平与HDAC活性增高有关,而与HAT活性降低关系不大。因此,本实验进行了HDAC活性检测。研究结果显示职业性苯中毒再生障碍性贫血患者HADC活性较对照组明显升高,提示苯及其代谢产物不仅影响染色质的表观遗传学及后续的基因表达,也切实影响了表观遗传学调控酶的活性,与组蛋白化学修饰改变平行,为c-Myb结合的组蛋白乙酰化水平改变参与TOPOⅡα表达减低提供了一定的依据,极大地支持并论证了本课题组提出的组蛋白化学修饰水平改变在职业性苯中毒造血损伤中发挥作用的假说。
[参考文献]
[1]TakahashiM,TsujimuraN,YoshinoT,etal.Assessmentofbenzene-inducedhematotoxicityusingahuman-likehematopoieticlineageinNOD/Shi-scid/IL-2Rγnullmice[J].PLoSOne, 2012, 7(12):e50448.
[2]SchnatterAR,GlassDC,TangG,etal.Myelodysplasticsyndromeandbenzeneexposureamongpetroleumwor-kers:aninternationalpooledanalysis[J].JNatlCancerInst, 2012,104(22):1724-1737.
[3]YuK,ShiYF,YangKY,etal.DecreasedtopoisomeraseIIαexpressionandalteredhistoneandregulatoryfactorsoftopoisomeraseIIαpromoterinpatientswithchronicbenzenepoisoning[J].ToxicolLett, 2011,203(2):111-117.
[4]SinghR,WinnLM.Theeffectsof1,4-benzoquinoneonc-MybandtopoisomeraseIIinK-562cells[J].MutatRes, 2008,645(1-2):33-38.
[5]施益芬,俞康,陈怡,等. 氢醌对人骨髓单个核细胞拓扑异构酶Ⅱα表达的影响[J].中华劳动卫生职业病杂志,2010, 28(9):660-663.
[6]施益芬,俞康,陈怡,等. 氢醌对人骨髓单个核细胞拓扑异构酶Ⅱα表达的影响及其可能机制[J].温州医学院学报,2010,40(2):164-167.
[7]BrandtTL,FraserDJ,LealS,etal.c-Mybtrans-activatesthehumanDNAtopoisomeraseIIalphagenepromoter[J].JBiolChem,1997,272(10):6278-6284.
[8]McHaleCM,ZhangL,SmithMT.Currentunderstandingofthemechanismofbenzene-inducedleukemiainhumans:implicationsforriskassessment[J].Carcinogenesis, 2012,33(2):240-252.
[9]曾可静,李萡,牛宇哲,等. 职业苯接触工人外周血T-bet和GATA-3表达变化的特点[J]. 中国病理生理杂志, 2011, 27(9):1807-1810.
[10]李萡,曾可静,杨力建,等. 苯接触及苯中毒工人外周血TCR-CD3分子复合物基因表达特点[J]. 中国病理生理杂志, 2010, 26(10):2035.
[11]JenuweinT,AllisCD.Translatingthehistonecode[J].Science, 2001, 293(5532):1074-1080.
[12]BernsteinBE,MeissnerA,LanderES.Themammalianepigenome[J].Cell,2007,128(4):669-681.
[13]BacksJ,OlsonEN.Controlofcardiacgrowthbyhistoneacetylation/deacetylation[J].CircRes, 2006, 98(1):15-24.
[14]WeinbergMS,VilleneuveLM,EhsaniA,etal.TheantisensestrandofsmallinterferingRNAsdirectshistonemethylationandtranscriptionalgenesilencinginhumancells[J].RNA, 2006,12(2):256-262.
[15]BennettMK,OsborneTF.Nutrientregulationofgeneexpressionbythesterolregulatoryelementbindingproteins:increasedrecruitmentofgene-specificcoregulatoryfactorsandselectivehyperacetylationofhistoneH3 in vivo[J].ProcNatlAcadSciUSA, 2000, 97(12):6340-6344.
[16]施益芬,甘一峰,沈志坚,等. 苯中毒病人TOPOⅡα启动子调控因子Sp1组蛋白化学修饰改变[J]. 中国病理生理杂志, 2015, 31(9):1662-1666.
[17]FraserDJ,BrandtTL,KrollDJ.TopoisomeraseIIalphapromotertrans-activationearlyinmonocyticdifferentiationofHL-60humanleukemiacells[J].MolPharmacol,1995, 47(4):696-706.
[18]SonnemannJ,GruhnB,WittigS,etal.Increasedactivityofhistonedeacetylasesinchildhoodacutelymphoblasticleukaemiaandacutemyeloidleukaemia:supportforhistonedeacetylaseinhibitorsasantileukaemicagents[J].BrJHaematol, 2012, 158(5):664-666.
(责任编辑: 林白霜, 罗森)
Effects of c-Myb binding levels to histones modified by acetylation and methylation on hematopoietic damnification in occupational benzene poisoning patients
SHI Yi-fen, CHEN Jing-jing, YU Kang
(Department of Hematology, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325015, China. E-mail: yukang62@126.com)
[ABSTRACT]AIM: To investigate the role of histone modification in the changes of topoisomerase Ⅱα promoter regulatory factor c-Myb binding to histone in the occupational benzene poisoning patients with hematopoietic damnification.METHODS: The bone marrow samples were collected from 25 aplastic anemia patients caused by occupational benzene poisoning and 25 healthy controls. The binding levels of c-Myb to the histone with acetylation or methylation were detected by the technique of chromatin immunoprecipitation (ChIP). The mRNA expression of c-Myb was detected by RT-PCR. The activity of histone deacetylase (HDAC) was measured by the colorimetric HDAC assay kit.RESULTS: Compared with the controls, the binding levels of c-Myb to the acetylated histone H4 and acetylated histone H3 in the occupational benzene poisoning patients decreased (P<0.01), while those to the methylated histone H3K4 and methylated histone H3K9 didn’t obviously change. The mRNA expression of c-Myb in the occupational benzene poisoning patients was significantly down-regulated compared with the controls (P<0.05).The HDAC activity of the bone marrow mononuclear cells in the occupational benzene poisoning patients increased obviously (P<0.05).CONCLUSION: Topoisomerase Ⅱα promoter regulatory factor c-Myb may play an important role in the hematopoietic toxicities of benzene through histone acetylation modification.
[KEY WORDS]Benzene; c-Myb; Histone acetylation; Histone methylation; Chromatin immunoprecipitation; Histone deacetylase
[文章编号]1000- 4718(2016)05- 0907- 05
[收稿日期]2016- 01- 18[修回日期] 2016- 03- 02
*[基金项目]国家自然科学基金资助项目(No. 81172613;No. 81502793);温州市科委基金资助项目(No. Y20120004; No. Y20150034)
通讯作者△Tel: 0577-55579489; E-mail: yukang62@126.com
[中图分类号]R135.1; R363.2
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.023
杂志网址: http://www.cjpp.net

