三叶青水提取物对NK细胞杀伤胃癌BGC-823细胞的影响
袁 雨,朱炳喜,刘军权,周 燏,吕小婷,周忠海,陈永强,杨 阳
1. 徐州医科大学,江苏 徐州 221002; 2. 中国人民解放军第九七医院
三叶青水提取物对NK细胞杀伤胃癌BGC-823细胞的影响
袁 雨1,朱炳喜1,刘军权2,周 燏2,吕小婷2,周忠海2,陈永强2,杨 阳2
1. 徐州医科大学,江苏 徐州 221002; 2. 中国人民解放军第九七医院
目的 探讨三叶青水提取物对人NK细胞杀伤胃癌BGC-823细胞的影响及机制。方法 采用干细胞生长培养基(SCGM)体外扩增人外周血NK细胞,不同浓度三叶青水提取物作用于NK细胞后,采用CCK8法检测三叶青水提取物对NK细胞增殖率的影响,流式细胞术(FCM)检测NK细胞穿孔素(PFP)、颗粒酶B(GraB)及CD107a的表达,乳酸脱氢酶(LDH)释放法检测NK细胞对胃癌BGC-823细胞的杀伤活性。结果 三叶青水提取物作用人NK细胞48 h后,三叶青水提取物0.0003~78.125 μg/ml 浓度组的NK细胞增殖明显(P<0.05);三叶青水提取物0.305~4.883 μg/ml浓度组人NK细胞PFP、GraB及CD107a表达高于对照组(P<0.05);三叶青水提取物0.305~19.531 μg/ml 浓度组人NK细胞对胃癌BGC-823细胞杀伤活性较对照组增强,差异有统计学意义(P<0.05)。结论 三叶青水提取物能促进NK细胞的增殖,能增强NK细胞对胃癌BGC-823细胞的杀伤活性,这可能与三叶青水提取物上调NK细胞PFP、GraB及CD107a表达有关。
三叶青;NK细胞;胃癌BGC-823细胞;杀伤活性
三叶青(Tetrastigma hemsleyani)为葡萄科崖爬藤属植物三叶崖爬藤,主要分布于我国西南及安徽、浙江、江西等地[1]。作用于机体后可发挥清热解毒、活血止痛、祛风化痰、调节免疫等作用,现在临床上多采用三叶青治疗哮喘、肺炎、肝炎、风湿、咽痛、瘰疬等疾病,且具有很好的疗效[2]。近几年来, 三叶青的抗肿瘤作用成为研究热点,许多文献[3-4]报道三叶青提取物在体外具有抑制肿瘤细胞增殖及诱导其凋亡的作用。自然杀伤细胞(natural killer cells,NK)是人体固有免疫的主要淋巴细胞之一,无需事先致敏和免疫即可识别肿瘤及病毒感染细胞,发挥细胞毒性无主要组织相容性复合体(major histocompatibility complex,MHC)限制性[5]。NK细胞杀伤肿瘤细胞主要是通过Fas和FasL相互作用后释放颗粒酶B(Granzyme B,GraB)和穿孔素(perforin,PFP)来实现[6]。本实验主要研究三叶青水提取物在体外作用于人NK细胞后对人NK细胞杀伤胃癌BGC-823细胞的影响及其可能的机制,为将来深入研究三叶青的抗肿瘤机制提供实验依据。
1 材料与方法
1.1 实验材料三叶青块茎(浙江汉邦生物科技有限公司);人胃癌细胞株BGC-823(中国科学院上海细胞研究所);二甲亚砜(dimethyl sulfoxide, DMSO)(Sigma公司);人AB血浆(徐州市血站);淋巴细胞分离液(中国科学院血液病研究所);RPMI 1640培养基、胰蛋白酶、胎牛血清(Gibco公司);PE标记的CD3、FITC标记的CD56(美国BD公司);PE标记的GraB (Granzyme B, GraB)、穿孔素(Perforin, PFP)(Ebioscience公司);乳酸脱氢酶试剂盒、APC标记的CD107a(美国BD公司);CCK8试剂(碧云天生物技术研究所)。
1.2 主要仪器恒温CO2培养箱(德国Heraeus公司);倒置显微镜(德国Wilovert公司);超净工作台(苏州净化设备厂);低温高速离心机(德国Eppendorf公司);流式细胞检测仪(美国BD公司);SEAC全自动酶免系列分析仪(北京西亚克技术有限公司)。
1.3 三叶青水提取物制备由解放军第九七医院药剂科杨阳[7]进行提取,取三叶青干燥药材200 g,加5倍体积80%乙醇水溶液浸泡24 h后,加热回流提取,共3次,每次40 min,合并提取液,过滤,减压回收蒸干,得总提取物。取总提取,加水混悬,分别采用10倍体积的石油醚、乙酸乙酯等进行分步萃取。将上述经有机溶剂提取后的三叶青药材水煮后减压回收蒸干,获得三叶青水提取物。
1.4 NK细胞培养及表型鉴定取健康成年志愿者外周静脉血20 ml,低分子肝素钠抗凝后加入淋巴细胞分离液,离心2 000 r/min×13 min(离心半径为10 cm)。玻璃吸管吸取单个核细胞层,PBS洗涤2次,将细胞加入含有rhIL-2 和人AB血浆的SCGM培养基中,置于37 ℃、5% CO2培养箱中培养。收集培养10 d的NK细胞,PBS洗涤后将细胞浓度调整为1×106/ml。在细胞悬液中加入FITC-Anti-CD56和PE-Anti-CD3,室温下避光孵育15 min,PBS洗涤并重悬细胞,采用流式细胞术检测NK细胞表型。
1.5 胃癌细胞株BGC-823的培养取复苏后的胃癌BGC-823细胞加入细胞培养瓶,随后加入含10%胎牛血清的RPMI 1640培养液15 ml,于37 ℃、5% CO2的培养箱中培养。每天观察细胞生长情况,根据细胞生长情况进行换液。待细胞铺满瓶底时,用2.5 g/L胰蛋白酶消化细胞使其脱壁,收集细胞后离心800 r/min×3 min,弃去上清,使用生理盐水反复吹打混匀细胞,计数后用于实验。
1.6 CCK8法检测三叶青水提取物对人NK细胞增殖的影响取培养10 d的NK细胞,将其配制成1×105/ml,以180 μl/孔的剂量接种于96孔板。设置对照组和实验组,对照组不加三叶青水提取物,实验组加入三叶青水提取物(终浓度分别为0.0003、0.0012、0.0048、0.019、0.076、0.305、1.221、4.883、19.531、78.125、312.5、1250 μg/ml),每组设3个复孔,将96孔板放入 37 ℃、5% CO2培养箱中继续培养NK细胞24 h、48 h、72 h,随后在每孔中加入CCK8 20 μl,继续培养4 h后弃去上清。将酶标仪测定波长调为450 nm,检测96孔板各孔吸光度(OD)值,根据公式计算细胞增殖率(%),每组实验重复3次,取平均值。增殖率(%)=(实验组OD值-对照组OD值)/对照组OD值×100%。
1.7 流式细胞术检测三叶青水提取物作用48 h后NK细胞PFP、GraB、CD107a的表达NK细胞培养10 d后,将其铺入6孔板,3 ml/孔。设置对照组和实验组,对照组不加三叶青水提取物,实验组加入不同浓度三叶青水提取物(终浓度分别为0.076、0.305、1.221、4.883、19.531 μg/ml),用PBS洗涤3次后将细胞数调至1×106/ml。每管加入FITC-Anti-CD56和PE-Anti-CD3各20 μl,GraB和PFP组均加入固定剂100 μl及破膜剂100 μl,随后分别加入anti-GraB-PE、anti-PFP-PE各5 μl。CD107a组不加入破膜剂,仅加入anti-CD107a-APC,三组均设置同型对照抗体管,孵育、洗涤后采用流式细胞检测仪检测NK细胞GraB、PFP及CD107a的表达,每组实验重复3次,取平均值。
1.8 LDH释放法检测三叶青水提取物作用48 h后NK细胞对胃癌BGC-823细胞的杀伤活性取培养10 d的NK细胞铺入6孔板,3 ml/孔。对照组不加三叶青水提取物,实验组加入不同浓度的三叶青水提取物(终浓度分别为0.076、0.305、1.221、4.883、19.531 μg/ml),继续培养48 h,收集NK细胞作为效应细胞,胃癌BGC-823细胞作为靶细胞,将效应细胞和靶细胞分别配成2×106/ml和2×105/ml的细胞悬液,效靶细胞等体积混合(效靶细胞数比例为10∶1)。将混合后的效靶细胞置于37 ℃、5% CO2培养箱中孵育6 h后,离心1 500 r/min×10 min,取上清液。按LDH试剂说明书要求操作,340 nm波长下全自动生化分析仪测定吸光度值(A),每检测样本设3个复管,实验重复3遍。NK细胞的杀伤活性(%)=(A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释放组)× 100%。
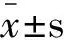
2 结果
2.1 人NK细胞的培养及鉴定NK细胞培养结果显示,人NK细胞在体外扩增培养10d后,可见大的集落和散在的细胞生长,单个细胞呈椭圆形或梭形生长。 流式细胞术检测结果显示,PBMC未培养前NK细胞(CD3-CD56+)比例为6.12%,培养10d后NK细胞比例增加到81.33%(见图1)。
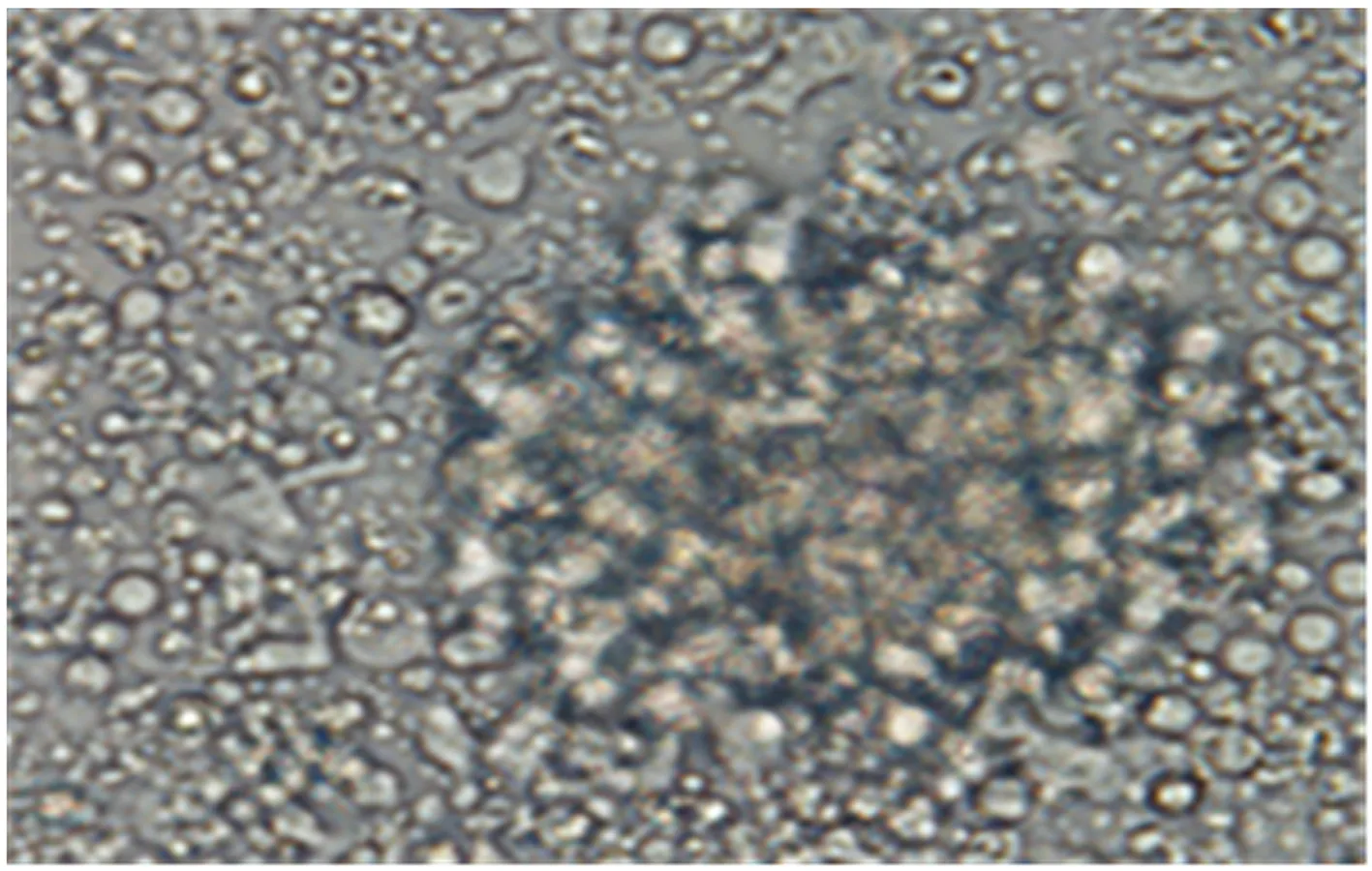
图1 培养10 d的NK细胞倒置显微镜照片(400×)
Fig1InvertedmicroscopephotoofNKcellsculturedafter10days(400×)
2.2 CCK8法检测不同浓度三叶青水提取物对NK细胞增殖的影响三叶青水提取物作用于NK细胞24h、48h和72h后,三叶青水提取物0.0012~78.125μg/ml浓度组的NK细胞增殖率均较对照组升高(P<0.05)。三叶青水提取物作用24h和48h后1 250μg/ml组和72h后312.5~1 250μg/ml组对NK细胞生长有抑制作用(P<0.05)。相同浓度的三叶青水提取物作用于NK细胞后(0.076~78.125μg/ml浓度组),48h组NK细胞增殖率与24h、72h组比较,差异有统计学意义(P<0.05);作用48h时,三叶青水提取物浓度为1.221μg/ml时细胞增殖率为(41.75±2.64)%,达到最高值(见图2)。

注:与对照组比较,*P<0.05;浓度相同时,与其他时间组比较,△P<0.05。
图2 不同浓度三叶青水提取物对NK细胞增殖率的影响
Fig2EffectofdifferentconcentrationsofwaterextractofTetrastigmahemsleyaniontheproliferationrateofNKcells
2.3 三叶青水提取物对NK细胞PFP、GraB、CD107a表达的影响三叶青水提取物作用于NK细胞48h后,NK细胞PFP、GraB和CD107a的表达均有升高,0.305~4.883μg/ml浓度组与对照组比较,差异均有统计学意义(P< 0.05);且当三叶青水提取物浓度为1.221μg/ml时,GraB、PFP和CD107a的表达率均达到最大值;浓度>1.221μg/ml时,三者的表达率开始下降(见表1、图3)。
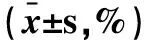

三叶青水提取物(μg/ml)PFPGraBCD107a0(对照组)72.89±2.0853.69±3.5583.76±3.760.07676.16±3.1256.68±2.1388.01±1.860.30582.58±3.84∗62.47±2.60∗90.45±2.63∗1.22190.17±2.14∗69.19±1.33∗93.91±2.08∗4.88383.81±4.47∗67.44±2.04∗90.68±3.26∗19.53180.61±2.73∗60.56±3.05∗84.10±2.47
注:与对照组相比,*P<0.05。

注: A1~3:同型对照组; B1~3:对照组; C1~3:实验组。
2.4 三叶青水提取物对NK细胞杀伤胃癌BGC-823细胞的影响浓度为0.305~19.531 μg/ml的三叶青水提取物作用NK细胞48 h后,NK细胞对胃癌BGC-823细胞的杀伤活性较对照组增强(P<0.05);且浓度为1.221 μg/ml时,NK细胞对胃癌BGC-823细胞的杀伤活性达到最大[(67.75± 2.58)%,见图4]。

注:与对照组比较,*P< 0.05。
3 讨论
近年来,从天然中药中寻找活性成分成为抗肿瘤药物发展的重点之一。三叶青为我国特有珍稀植物,研究[8-9]发现三叶青多种提取成分在体外可抑制肿瘤细胞的生长。丁丽等[10-11]发现三叶青水提取物对胃癌、宫颈癌及恶性黑色素瘤有较强抑制作用。然而,三叶青水提取物对体外诱导培养的NK 细胞的增殖作用及其免疫学影响尚未见报道。本实验结果表明,三叶青水提取物作用于NK细胞24 h、48 h和72 h后,三叶青水提取物浓度为0.0012~78.125 μg/ml时可促进NK细胞的增殖,浓度为0.0012~1.221 μg/ml时,三叶青水提取物促进NK细胞增殖呈上升趋势,浓度为1.221 μg/ml时,NK细胞增殖率达峰值,1.221~78.125 μg/ml时三叶青水提取物促进NK细胞增殖呈下降趋势,由此说明三叶青水提取物对NK细胞具有双向调节作用,在适宜的浓度下可促进NK细胞增殖,提示三叶青水提取物对NK 细胞的增殖具有一定程度的促进作用,这可能对提高体外培养 NK 细胞的数量用于肿瘤的免疫治疗提供了实验依据。
NK 细胞是固有免疫应答中最主要的效应细胞群,其两大主要功能是识别与溶解肿瘤细胞和病毒感染细胞及产生免疫调节性细胞因子[12]。NK细胞功能低下或缺陷的患者易发感染,且肿瘤的发生率和转移率提高[13]。彭六生等[14]研究发现胃癌患者肿瘤组织内NK细胞的百分率与胃癌的进展密切相关,且高于NK细胞百分率中位数的患者总体存活时间较长。本实验发现,0.305~19.531 μg/ml的三叶青水提取物作用于NK细胞后能提高NK细胞对胃癌BGC-823细胞的杀伤作用,且NK细胞杀伤活性增高趋势与三叶青水提取物作用于NK细胞后NK细胞增殖增长趋势一致,由此提示,三叶青水提取物可能通过促进NK细胞的增殖进而增强对胃癌BGC-823细胞的抑制。
穿孔素和颗粒酶被认为是存在于细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)和NK细胞中的具有细胞毒性的物质。GraB以酶原的形式合成加工后储存在细胞质颗粒内,细胞质颗粒内的酸性环境可保持GraB处于非活性状态,从而保障细胞不被自身颗粒酶溶解,然而当与靶细胞接触后,穿孔素可从这些细胞中释放出来,在靶细胞膜上形成穿孔素管道,GraB N-端的酸性二肽被切除成为活性型GraB,通过靶细胞膜上的多聚穿孔素通道进入靶细胞从而杀伤靶细胞[15]。因此,穿孔素和颗粒酶被认为是可以反映NK细胞功能活性的可靠指标。此外, CD107a分子随着细胞脱颗粒到达细胞膜表面,且其表达程度与穿孔素的分泌多少一致。因此,NK细胞表达CD107a分子也可代表其具有杀伤活性[16]。本实验发现,0.305~4.883 μg/ml浓度组三叶青水提取物作用于NK细胞48 h后,与对照组相比,PFP、GraB、CD107a的表达均有不同程度的增加,差异有统计学意义,且在三叶青水提取物浓度为1.221 μg/ml时,PFP、GraB、CD107a表达均达最高。这与三叶青水提取物作用后NK细胞对胃癌BGC-823细胞杀伤活性的峰值一致,表明三叶青水提取物增强NK细胞对胃癌BGC-823细胞的杀伤活性,我们猜测这可能与三叶青水提取物上调PFP、GraB、CD107a的表达有关。
综上所述,三叶青水提取物不仅能够促进NK细胞的增殖,而且可以增强其杀伤胃癌细胞的能力,我们推测这可能与三叶青水提取物促进NK细胞PFP、GraB及CD107a的表达有关,可为三叶青用于胃癌的免疫治疗提供一定的实验依据。
[1]Jiangsu New Medical College. Dictionary of Chinese Herbal Medicine (volume ii) [M]. Shanghai: Shanghai People’s Publishing House, 1977: 2123. 江苏新医学院. 中药大辞典 (下册)[M]. 上海: 上海人民出版社, 1977: 2123.
[2]The State Administration of Traditional Chinese Medicine (Chinese Herbal Medicine) Editorial Board. Chinese herbal medicine [M]. Shanghai: Shanghai Science and Technology Press, 1999: 296-298. 国家中医药管理局(中华本草)编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999: 296-298.
[3]Zeng J, Zhou T, Tong XQ, et al. Effect of Clover extract on Caspase-3 expression in A549 lung carcinoma cells [J]. Jiangsu Med J, 2013, 39(20): 2401-2402. 曾娟, 周婷, 童雪晴, 等. 三叶青提取物对肺癌A549细胞中Caspase-3表达的影响[J]. 江苏医药, 2013, 39(20): 2401-2402.
[4]Xiong Y, Wu X, Rao L. Tetrastigma hemsleyanum (Sanyeqing) root tuber extracts induces apoptosis in human cervical carcinoma HeLa cells [J]. J Ethnopharmacol, 2015, 165: 46-53.
[5]Caligiuri MA. Human natural killer cells [J]. Blood, 2008, 112(3): 461-469.
[6]Trapani JA, Smyth MJ. Functional significance of the perforin/granzyme cell death pathway [J]. Nat Rev Immunol, 2002, 2(10): 735-747.
[7]Yang Y. Study on chemical constituents of Salvia przewalskii and Polygonum capitatum [D]. The Second Military Medical University, 2009. 杨阳. 甘西鼠尾草及头花蓼化学成分研究[D]. 第二军医大学, 2009.
[8]Jia YZ, Lao Q, Qi KX, et al. A dynamic analysis of manifestation of the multi-slice CT (MSCT) and liver function in interventional treatment of rabbit VX2 liver cancer model combined with Tetrastigma Hemsleyanum Diels et. Gilg(SYQ) extract [J]. J Med Res, 2012, 41(4): 56-58. 贾玉柱, 劳群, 祁克信, 等. 三叶青提取物联合介入治疗兔VX2肝癌模型多层螺旋CT表现及肝功能动态分析[J]. 医学研究杂志, 2012, 41(4): 56-58.
[9]Zhong LR, Lin S, Chen WF, et al. Effect of extract of radix tetrastigma hemsleyani on apoptosis of human lung carcinoma H1299 cells and its mechanism study [J]. CJITWM, 2014, 34(11): 1354-1358. 钟良瑞, 林霜, 陈伟芳, 等. 三叶青提取物对人肺癌 H1299 细胞凋亡的影响及机制研究[J]. 中国中西医结合杂志, 2014, 34(11): 1354-1358.
[10]Ding L, Ji QX, Li HW. Effect of water extract of Tetrastigmatis hemsleyani and the serum containing it on the proliferation of AGS cells [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(17): 212-214. 丁丽, 纪其雄, 李鸿文. 三叶青水提物及其含药血清对人胃腺癌细胞株的抑制作用[J]. 中国实验方剂学杂志, 2012, 18(17): 212-214.
[11]Ding L, Ji QX, Lv WT, et al. Research on anti tumor effect of water extract of Tetrastigmatis hemsleyani in vivo and vitro [J]. Chinese Traditional Patent Medicine, 2013, 35(5): 1076-1078. 丁丽, 纪其雄, 吕雯婷, 等. 三叶青水提物体内、体外抗肿瘤作用的研究[J]. 中成药, 2013, 35(5): 1076-1078.
[12]Vivier E, Tomasello E, Baratin M, et al. Functions of natural killer cells [J]. Nat Immunol, 2008, 9(5): 503-510.
[13]Cheng M, Chen Y, Xiao W, et al. NK cell-based immunotherapy for malignant diseases [J]. Cell Mol Immunol, 2013, 10(3): 230-252.
[14]Peng LS. Functional immunoregulation and clinical relevance of NK cells in patients with gastric cancer [D]. The Third Military Medical University, 2014. 彭六生. NK细胞在胃癌中的应答调控及作用研究[D]. 第三军医大学, 2014.
[15]Urrea Moreno R, Gil J, Rodriguez-Sainz C, et al. Functional assessment of perforin C2 domain mutations illustrates the critical role for calcium-dependent lipid binding in perforin cytotoxic function [J]. Blood, 2009, 113(2): 338-346.
[16]Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity [J]. J Immunol Methods, 2004, 294(1-2): 15-22.
(责任编辑:马 军)
Effect of the water extract of Tetrastigma hemsleyani on the cytotoxic activity of NK cells against gastric cancer cell lines BGC-823
YUAN Yu1, ZHU Bingxi1, LIU Junquan2, ZHOU Yu2, LV Xiaoting2, ZHOU Zhonghai2, CHEN Yongqiang2, YANG Yang2
1. Xuzhou Medical University, Xuzhou 221002; 2. The 97th Hospital of Chinese PLA, China
Objective To explore the effect and mechanism of the water extract of Tetrastigma hemsleyani on the cytotoxic activity of NK cells against gastric cancer cell lines BGC-823.Methods The amplification of human NK cells was induced by stem cell growth medium (SCGM) in vitro. NK cells with different concentrations of water extract of Tetrastigma hemsleyani in vitro were cultured. CCK8 assay was used to measure the growth curve of NK cells. The expressions of perforin (PFP), Granzyme B (GraB) and CD107a on NK cells were detected by flow cytometry (FCM). The cytotoxic activity of NK cells to gatric cancer BGC-823 cells was detected by lactate dehydrogenase (LDH) release.Results With the water extract of Tetrastigma hemsleyani after 48 hours, the proliferation rate of human NK cells was increased significantly with the water extract of Tetrastigma hemsleyani at concentrations from 0.0003 to 78.125 μg/ml (P<0.05); the expressions of GraB, PFP and CD107a of human NK cells with the water etract of Tetrastigma hemsleyani at concentrations from 0.305 to 4.883 μg/ml were significantly higher than control group (P<0.05); the cytotoxic activity of human NK cells against BGC-823 with the water extract of Tetrastigma hemsleyani at concentrations from 0.305 to 19.531 μg/ml was remarkably higher than the control group (P<0.05). Conclusion The water extract of Tetrastigma hemsleyani at a certain range of concentrations could promote the proliferation of NK cells and enhance the cytotoxic activity of NK cells to BGC-823 cells. The possible mechanism may be that the water extract of Tetrastigma hemsleyani could increase expressions of PFP, GraB and CD107a.
Tetrastigma hemsleyani; NK cells; Gastric cancer cell lines BGC-823; Cytotoxic activity
袁雨,硕士研究生,研究方向:消化道肿瘤的基础与临床。E-mail: 779192313@qq.com
朱炳喜,主任医师,副教授,研究方向:消化道肿瘤的基础与临床。E-mail: 82200496@163.com
10.3969/j.issn.1006-5709.2016.06.010
R735.2
A
1006-5709(2016)06-0633-05
2015-10-20

